Kohlenstoff
Kohlenstoff (von lat. carbo = Holzkohle oder lat. carbonium = Kohlenstoff) ist ein chemisches Element.
| |||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name, Symbol, Ordnungszahl | Kohlenstoff, C, 6 | ||||||||||||||||||||||||
| Serie | Nichtmetalle | ||||||||||||||||||||||||
| Gruppe, Periode, Block | 14 (IVA), 2, p | ||||||||||||||||||||||||
| Dichte, Mohshärte | 2267 kg/m3, 0,5 (Graphit) 10,0 (Diamant) | ||||||||||||||||||||||||
| Aussehen | schwarz (Graphit) farblos (Diamant) | ||||||||||||||||||||||||
| Atomar | |||||||||||||||||||||||||
| Atomgewicht | 12,0107 amu | ||||||||||||||||||||||||
| Atomradius (berechnet) | 70 (67) pm | ||||||||||||||||||||||||
| Kovalenter Radius | 77 pm | ||||||||||||||||||||||||
| van der Waals-Radius | 170 pm | ||||||||||||||||||||||||
| Elektronenkonfiguration | [He]2s22p2 | ||||||||||||||||||||||||
| e- 's pro Energieniveau | 2, 4 | ||||||||||||||||||||||||
| Oxidationszustände (Oxid) | 4, 2 (leicht sauer) | ||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||
| Physikalisch | |||||||||||||||||||||||||
| Aggregatzustand (Magnetismus) | fest (unmagnetisch) | ||||||||||||||||||||||||
| Schmelzpunkt | 3773 K (3500 °C) | ||||||||||||||||||||||||
| Siedepunkt | 5100 K (4827 °C) | ||||||||||||||||||||||||
| Molares Volumen | 5,29 · 10-6 m3/mol | ||||||||||||||||||||||||
| Verdampfungswärme | 355,8 kJ/mol (sublimiert) | ||||||||||||||||||||||||
| Schmelzwärme | k. A. (sublimiert) | ||||||||||||||||||||||||
| Dampfdruck | 0 Pa | ||||||||||||||||||||||||
| Schallgeschwindigkeit | 18350 m/s | ||||||||||||||||||||||||
| Verschiedenes | |||||||||||||||||||||||||
| Elektronegativität | 2,55 (Pauling-Skala) | ||||||||||||||||||||||||
| Spezifische Wärmekapazität | 710 J/(kg · K) | ||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 0,061 · 106/m Ohm | ||||||||||||||||||||||||
| Wärmeleitfähigkeit | 129 W/(m · K) | ||||||||||||||||||||||||
| 1. Ionisierungsenergie | 1086,5 kJ/mol | ||||||||||||||||||||||||
| 2. Ionisierungsenergie | 2352,6 kJ/mol | ||||||||||||||||||||||||
| 3. Ionisierungsenergie | 4620,5 kJ/mol | ||||||||||||||||||||||||
| 4. Ionisierungsenergie | 6222,7 kJ/mol | ||||||||||||||||||||||||
| 5. Ionisierungsenergie | 37831 kJ/mol | ||||||||||||||||||||||||
| 6. Ionisierungsenergie | 47277,0 kJ/mol | ||||||||||||||||||||||||
| Stabilste Isotope | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| SI-Einheiten und Standardbedingungen werden benutzt, sofern nicht anders angegeben. | |||||||||||||||||||||||||
Modifikationen des Kohlenstoff
Elementarer Kohlenstoff kommt in zwei Modifikationen vor: Diamant und
Graphit. Makroskopisch sind die Eigenschaften nahezu diametral.
Graphit ist ein guter elektrischer Halbleiter von tiefschwarzer Farbe. Er
ist leicht spaltbar und dient als Schmiermittel.
Diamant ist ein sehr guter Isolator und transparent. Diamant ist das härteste
bekannte Material und wird als Schleifmittel eingesetzt.
Alle Werkstoffe auf Kohlenstoff-Basis lassen sich auf diese Grundtypen
zurückführen (s. u.).
Atommodell des Kohlenstoffs
Das Modell der Atom- und Molekülorbitale veranschaulicht, wie es zu der unterschiedlichen Ausprägung der Erscheinungsformen des Kohlenstoffs kommt.
Kohlenstoff besitzt sechs Elektronen. Nach dem Schalenmodell besetzen zwei Elektronen die innere 1s-Schale. Das 2s-Niveau der zweiten Schale nimmt ebenfalls zwei Elektronen auf, zwei weitere das 2px- und 2py- Niveau. Nur die vier äußeren Elektronen der zweiten Schale treten chemisch in Erscheinung. Die Aufenthaltswahrscheinlichkeit der Elektronen in einem s-Niveau ist kugelförmig. In einem p-Niveau ist sie anisotrop. Die Elektronen bevölkern einen tropfenförmigen Raum, jeweils einen Tropfen links und rechts vom Zentrum entlang der x-Achse, wenn man sich das Atom im Zentrum eines kartesischen Koordinatensystem plaziert vorstellt. Senkrecht dazu stehen das py- und pz-Orbital.
Diamant (sp3) Struktur

Wird ein Kohlenstoff-Atom in einen angeregten Zustand versetzt, hybridisieren
die s und p Niveaus und bilden gemeinsam neue
Aufenthaltswahrscheinlichkeiten für die Elektronen aus. Beteiligen sich das s-
und
alle drei p-Orbitale, spricht man von einer sp3 Hybridisierung. Die
Orbitale nehmen eine langgestreckte Tropfenform an. War sie bei den p-
Orbitalen spiegelsymmetrisch zum Mittelpunkt angeordnet, erscheinen sie jetzt
keulenartig in eine Richtung verlängert. Das Bild veranschaulicht die
Hauptkeulen, die Nebenkeulen wurden der Übersichtlichkeit wegen fortgelassen.
Die vier sp3-Orbitale orientieren sich symmetrisch zueinander im Raum,
sie nehmen die Form eines Tetraeders an.
Überlappen sich die sp3-Orbitale angeregter Atome, bilden sie feste kovalente Bindungen. Sie bilden das Grundgerüst des Diamantgitters (siehe Kristallstruktur dort.)
Graphit (sp2) Struktur
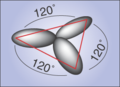
Beteiligen sich nur 2 der p-Orbitale an der Hybridisierung, entstehen die sog. sp2-Orbitale. Die sp2- Orbitale richten sich senkrecht zum übriggebliebenen p-Orbital aus. Steht z.B. das p-Orbital senkrecht auf der x-y-Ebene, liegen die sp2- Orbitale symmetrisch in der x-y-Ebene. Sie haben den gleichen Winkel von 120° zueinander. Das Bild links veranschaulicht die Situation. Das p-Orbital ist der Übersichtlichkeit wegen fortgelassen worden.
Angeregte sp2-Kohlenstoff-Atome reagieren miteinander und bilden feste kovalente
Bindungen, aber nur in einer Ebene. Ihre Struktur ist hexagonal, d.i. die
Grundstruktur der Planarebenen des Graphits (siehe Kristallgitterstruktur
dort). Die übriggebliebenen p-Orbitale wechselwirken ebenfalls
untereinander. Sie formen die pi-Bindungen mit deutlich geringeren
Bindungsenergien als die sigma-Bindungen der sp2 bzw. sp3-
Orbitale.
Chemisch spechen wir von einer Doppelbindung. Die Schreibweise C=C
vernachlässigt den unterschiedlichen Charakter beider Bindungen.
Die Bindungsenergie der diamantartigen tetraedrischen sp3-Einfachbindung 'C-C'
liegt bei 350 kJ/mol, die der graphitartigen hexagonalen sp2-Doppelbindung C-C
nur um 260 kJ/mol höher.
In einem Kohlenstoff-Ring mit sechs Kohlenstoff-Atomen stabilisiert sich die pi-Bindung
durch Delokalisierung der Elektronen innerhalb des Rings (mehr dazu siehe
Benzol).
Dreifach (sp1) Bindung
Wenn nur ein p-Orbital mit dem s-Orbital hybridisiert, formen sich zwei linear angeordnete Bindungskeulen. Orientieren wir sie entlang der x-Achse, zeigen die verbliebenen p-Orbitale in y- und z-Richtung. Zwei Atome formen eine Kohlenstoff-Dreifachbindung. Die pi-Bindung lokalisiert die Elektronen zwischen den beiden Atomen, weitere Atome können nicht in den Verband aufgenommen werden. Das Gas Acetylen HC --- CH ist die größtmögliche Struktur auf Basis der sp1-Bindung.
Erscheinungsformen des Kohlenstoffs
Elementarer Kohlenstoff existiert in drei Modifikationen, basierend auf den Bindungsstrukturen sp3, sp2 und sp1. sp1 tritt makroskopisch nicht in Erscheinung. Unterschiede in der Anordnung von sp2-gebundenen Kohlenstoff-Atomen werden manchesmal als gesonderte (makroskopische) Modifikation bezeichnet.
Diamant
Die sp3-kovalent tetragonal gebundenen Kohlenstoff-Atome besitzen keine freien Elektronen. Das Material ist deshalb ein Isolator, das Licht nicht absorbiert. Diamant ist metastabil, unter schonenden Bedingungen wandelt er sich bei hohen Temperaturen um in Graphit. (siehe Diamant).
Graphit
Die sp2-kovalent hexagonal gebundenen Kohlenstoff-Atome formen hochfeste Ebenen. Die Ebenen untereinander sind nur locker über Van-der-Waals-Kräfte gebunden. Makroskopisch dominiert die Spaltbarkeit entlang der Planarebenen. Die Festigkeit der Ebenen tritt nicht in Erscheinung, dafür sind sie zu dünn (siehe Graphit).
Fullerene
Eine hexagonale Struktur ist planar. Ersetzt man einige Sechsecke durch Fünfecke, entsteht eine räumliche Struktur, ein Fußball-Molekül. Hier liegen die sp2-Bindungen nicht in einer Ebene, sondern sind räumlich zu einer Kugel geformt sind. Die kleinste mögliche Fußballstruktur erfordert 60 Kohlenstoff-Atome. Die Molekülkugeln untereinander binden sich über eine schwache Van-der-Waals-Wechselwirkung, genauso wie beim Graphit (siehe Fulleren).
Kohlenstoffnanoröhren
Die vierte Form von Kohlenstoff sind zylindrisch angeordnete, sp2-gebundene Kohlenstoffatome. Ihre Geometrie entsteht aus einer planaren Schicht Graphit, die zu einem Zylinder aufgerollt wird. Die entstandene Röhre kann zusätzlich noch verdreht sein, wodurch sich die elektrischen Eigenschaften ändern. Es können mehrere einwandige Röhren konzentrisch ineinander liegen, so dass man von multiwalled carbon nanotubes (MWCNT) spricht, im Gegensatz zu single-walled carbon nanotubes (SWCNT). (siehe Kohlenstoffnanoröhren)
Kohlenstoffnanoschaum
Die fünfte Form von Kohlenstoff ist eine zufällig orientierte, netzartige Anordnung von Kohlenstoff-Clustern, die einen durchschnittlichen Durchmesser von je sechs bis neun Nanometern besitzen. Sie hat mit zwei Milligramm/Kubikzentimeter die niedrigste Dichte aller bekannten Feststoffe und weist als erste Form reinen Kohlenstoffs bei Raumtemperatur ferromagnetische Eigenschaften auf, wenn auch nur für wenige Stunden nach der Herstellung. Bei weniger als 90 Kelvin wird sie wieder magnetisiert. Der Stoff ist ein Halbleiter.
Kohlenstoff-Fasern
Kohlenstoff-Fasern bestehen aus graphitartig sp2-gebundenem Kohlenstoff. In einer Idealfaser liegen die Grapitlagen geordnet wie in einer langen Papierrolle vor, die Graphitebenen orientiert entlang der Faserachse. In Wirklichkeit sind die Ebenen stark gestört und bilden nur lokale Ordnungen aus. Das Maß der Störung beeinflusst die Festigkeit (siehe Kohlenstofffaser).
Ruß
Ruß besteht ebenfalls aus Kohlenstoff auf Graphitbasis. Je reiner der Ruß, desto deutlicher treten die Eigenschaften von Graphit hervor. Lampen- oder Kerzenruß ist stark mit organischen Verbindungen verunreinigt, die die Bildung größerer Graphit-Verbände verhindern (siehe Ruß)
Glaskohlenstoff
Glasartiger Kohlenstoff ist eine Kohlenstoffform mit ausgeprägter struktureller Fehlordnung und glasartigem Bruchbild. Die Kohlenstoffatome mit sp2-Bindung sind in ebenen Schichten mit hexagonaler Symmetrie angeordnet. Im Gegensatz zu Graphit sind diese Schichten bei glasartigem Kohlenstoff nicht regelmäßig über größere Bereiche hinweg geordnet. Bänder aus graphitisch geordneten, übereinander geschichteten Strukturen bilden eine polymerähnliche Knäuelstruktur. Glasartiger Kohlenstoff ist im Makrobereich porenfrei, zwischen den Graphitschichten sind aber zahlreiche Hohlräume vorhanden. Ähnlich wie bei Gläsern beträgt der Durchmesser etwa 1 bis 3nm.
Folgen der strukturellen Fehlordnung sind die geringe Dichte, die im Vergleich zu Graphit geringere elektrische und thermische Leitfähigkeit und die Isotropie des Werkstoffs. Trotz der aufgeweiteten Struktur beträgt die Helium-Permeabilität nach der Vakuumverfallsmethode nur 10-11 cm2 s-1. Eine der interessantesten Eigenschaften von glasartigem Kohlenstoff ist die Hochtemperaturbeständigkeit im Vakuum oder Inertgas bis 3000°C. An Luft ist Glaskohlenstoff bis ca. 600°C beständig.
Glaskohlenstoff bildet auf Grund der starken Fehlordnung keine Interkalationsverbindungen. Die Folge ist die außerordentlich hohe Korrosionsbeständigkeit gegen saure und alkalische Reagenzien und Schmelzen. Lediglich Sauerstoff über 600°C und oxidierenden Schmelzen greifen Glaskohlenstoff an. Die hohe Reinheit des Werkstoffs prädestiniert Ihn für Anwendungen in der Analytik, Halbleiter- und Reinststofftechnik. Da Gefäße aus glasartigem Kohlenstoff keine Memory-Effekte zeigen, ist das Material im Bereich der Ultraspurenanalytik vielseitig einsetzbar.
Glasartiger Kohlenstoff SIGRADUR® der HTW GmbH ([www.htw-germany.com]) ist in zwei Sorten lieferbar: SIGRADUR®K (Herstellungstemperatur 1000°C) und SIGRADUR®G (Herstellungstemperatur 2200°C). Der wesentliche Unterschied zwischen beiden Formen des glasartigen Kohlenstoffs SIGRADUR®K und SIGRADUR®G ist die Reaktivität gegenüber oxidierenden Reagenzien, wie Salpetersäure, Perchlorsäure oder Sauerstoff. Die Oxidationsgeschwindigkeit von SIGRADUR®G ist in siedender 65%iger Salpetersäure 24fach geringer als die von SIGRADUR®K. Die mechanischen Eigenschaften, wie z.B. Härte und Festigkeit von glasartigem Kohlenstoff sind mit denen von Hochleistungskeramiken vergleichbar. Weitere Informationen: [www.htw-germany.com]
Kohlenstoff-Verbindungen
Einige Verbindungen des Kohlenstoffs gehören zur anorganischen Chemie:
- die Oxide Kohlenstoffmonoxid (CO) und Kohlenstoffdioxid (CO2)
- die Kohlensäure (H2CO3) sowie ihre Salze, die Carbonate.
- Kohlenstoffdisulfid (Schwefelkohlenstoff, CS2).
Anorganische Verbindungen, in denen Kohlenstoff vorkommt:
- Kalk
- Kohlenmonoxid
- Kohlendioxid
- Kohlenwasserstoffen
- Fluorchlorkohlenwasserstoff
- Fluorkohlenwasserstoff
- Chlorkohlenwasserstoff
- Stahl
Die gesamte lebende Natur basiert auf so genannten organischen Kohlenstoff-Verbindungen, hauptsächlich in Verbindung mit Wasserstoff, Sauerstoff und Stickstoff. Zwischen der Erde, ihren Ozeanen und der Erdatmosphäre findet ein kontinuierlicher Fluss von Kohlenstoff statt. Diesen Prozess nennt man Kohlenstoffzyklus.
Die organische Chemie umfasst, aufgrund der Fähigkeit des Kohlenstoffs, lange Ketten und kovalente Bindungen mit anderen Atomen zu bilden, mehr Verbindungen als die gesamte anorganische Chemie. Auch die Biochemie ist ein Teil der organischen Kohlenstoffchemie.