Zelllinie
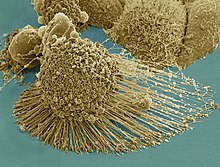


Eine Zelllinie bezeichnet in der Zellbiologie eine immortalisierten Zelltyp.
Eigenschaften
Aufgrund der im Vergleich zu Primärzellen hohen Wachstums- und Zellteilungsrate und der unbegrenzten Teilungsfähigkeit werden Zelllinien standardmäßig in der Zellkultur verwendet. Zelllinien besitzen als immortalisierte Zellen kein Hayflick-Limit und können sich unbegrenzt teilen. Sie werden künstlich durch eine Immortalisierung oder durch Fusion mit Tumorzellen im Rahmen der Hybridom-Technik erzeugt oder entstehen natürlich durch bestimmte Kombinationen an Mutationen bei der Entstehung von Tumoren, z. B. durch manche mutierte Onkogene und mutiertes p53.[1] Nicht jede immortalisierte Zelllinie kann sich unbegrenzt teilen, wenn auch dann die Anzahl maximaler Zellteilungen erhöht ist.[2] Einen vorübergehend immortalisierten Grenzfall zwischen Zelllinien und normalen Zellen bilden konditional reprogrammierte Zellen, die sich unbegrenzt teilen können, solange zwei Faktoren hinzugegeben werden – Fütterzellen und der Inhibitor der Rho-Kinase Y-27632.[3][4][5] Stammzelllinien sind Zelllinien von Stammzellen.
Erzeugung
Es gibt verschiedene Methoden zur Erzeugung von Zelllinien:[6]
- Isolierung aus Tumorgewebe ist die älteste Methode und wurde bereits bei HeLa angewendet.[7]
- Einbringung von immortalisierenden Genen oder Viren[8][9]
- Hybridom-Technik durch Zellfusion mit Tumorzellen[10]
Verwendung
Zelllinien werden in den Lebenswissenschaften in Zellkulturlaboren zu Forschungszwecken eingesetzt, wenn Versuche in lebenden eukaryotischen Zellen durchgeführt werden. In der Biotechnologie werden Zelllinien zur Produktion größerer Mengen an rekombinanten Proteinen in Bioreaktoren verwendet, wenn eine möglichst humantypische Glykosylierung des Proteins notwendig ist. Die langfristige Lagerung von Zelllinien erfolgt durch Kryokonservierung.
Kontaminationen mit anderen Zelllinien
Aufgrund der jahrelangen Verwendung und Weitergabe sind vermutlich 20 % der Zelllinien mit anderen Zelllinien kontaminiert.[11] Durch fehlerhafte Beschriftung oder durch Kontamination falsch identifizierte Zelllinien werden in der Datenbank Register of Misidentified Cell Lines aufgeführt.[12] Ebenso führt Cellosaurus eine Datenbank mit problematischen Zelllinien.[13] IGRhCellID ist eine Website mit Software zur Identifikation von Zelllinien und Kontaminationen.[14]
Kontaminationen mit Mikroorganismen
Mit Mikroorganismen kontaminierte Zelllinien werden mit geeigneten Antibiotika behandelt. Kontaminationen mit Mycoplasmen können aus dem Zellkulturmedium bzw. aus dem FCS stammen, da sie bei der Sterilfiltration der Medien nicht entfernt werden.[15] Aufgrund einer fehlenden bakteriellen Zellwand sind sie resistent gegen Antibiotika, die in die Zellwandsynthese eingreifen.
Beispiele
Es ist zu beachten, dass die folgende Auflistung der Zellkultur-Linien unvollständig ist. Alleine die ATCC führt bis zu 4.000 Zelllinien,[16] weitere gibt es bei der DSMZ und der CCOS.
| Zelllinie | Bedeutung | Ursprungsspezies | Ursprungsgewebe | Morphologie | Link |
|---|---|---|---|---|---|
| 293-T | enthält Plasmid mit temperatursensitiver Mutante des Simian-Virus 40 großen T-Antigens | Mensch | Niere (Embryo) Derivat von HEK-293 | Epithel | DSMZ Cellosaurus |
| A431 | Mensch | Haut | Epithel | DSMZ Cellosaurus | |
| A549 | Mensch | Adenokarzinom der Lunge | Epithel | DSMZ Cellosaurus | |
| BCP-1 | Mensch | Blut | Lymphozyt | ATCC Cellosaurus | |
| bEnd.3 | brain endothelial | Maus | Gehirn / Großhirnrinde | Endothel | ATCC Cellosaurus |
| BHK-21 | syrian baby hamster kidney | Hamster | Niere (embryonal) | Fibroblast | DSMZ Cellosaurus |
| BxPC-3 | Mensch | Pankreas, Adenokarzinom | Epithel | DSMZ Cellosaurus | |
| BY-2 | Bright Yellow-2 | Tabak | Am Keimling induzierter Kallus | DSMZ ( vom 8. November 2007 im Internet Archive) | |
| CHO | Chinese hamster ovary | Hamster | Ovarien | Epithel | ICLC Cellosaurus |
| COS-1 | Durch Transformation eines origin-defective SV-40 aus CV-1 Zellen hervorgegangen | Affe – Chlorocebus aethiops (Äthiopische Grünmeerkatze) | Niere | Fibroblast | DSMZ Cellosaurus |
| COS-7 | Durch Transformation eines origin-defective SV-40 aus CV-1 Zellen hervorgegangen | Affe – Chlorocebus aethiops | Niere | Fibroblast | DSMZ Cellosaurus |
| CV-1 | Affe – Chlorocebus aethiops | Niere | Fibroblast | Cellosaurus | |
| EPC | herpesviral induziertes, papuläres Epitheliom | Fisch (Pimephales promelas) | Haut | Epithel | ATCC Cellosaurus |
| HaCaT | human adult, calcium, temperature | Mensch | Keratinozyt | Epithel | Cellosaurus |
| HDMEC | human dermal microvascular endothelial cells | Mensch | Vorhaut | Endothel | Journal of Investigative Dermatology[17] |
| HEK-293 | human embryonic kidney | Mensch | Niere (embryonal) | Epithel | DSMZ Cellosaurus |
| HeLa | Henrietta Lacks | Mensch | Zervixkarzinom (Gebärmutterhalskrebs) | Epithel | DSMZ Cellosaurus |
| Hep G2 | human hepatocellular carcinoma | Mensch | Leberzellkarzinom | Epithel | DSMZ Cellosaurus |
| HL-60 | human leukemia | Mensch | Promyeloblasten | Blutzellen | DSMZ Cellosaurus |
| HMEC-1 | immortalized human microvascular endothelial cells | Mensch | Vorhaut | Endothel | ATCC Cellosaurus |
| HUVEC | human umbilical vein endothelial cells | Mensch | Nabelschnurvene | Endothel | ICLC |
| HT-1080 | Mensch | Fibrosarkom | Bindegewebszellen | DSMZ Cellosaurus | |
| Jurkat | Mensch | T-Zell-Leukämie | Blutzellen | DSMZ Cellosaurus | |
| K562 | älteste Leukämie-Zelllinie des Menschen | Mensch | Blut | myeloische Blutzellen, etabliert 1975 | DSMZ Cellosaurus |
| LNCaP | Mensch | Prostata Adenokarzinom | Epithel | DSMZ Cellosaurus | |
| MCF-7 | Michigan Cancer Foundation | Mensch | Brust, Adenokarzinom | Epithel | DSMZ Cellosaurus |
| MCF-10A | Michigan Cancer Foundation | Mensch | Brustdrüse | Epithel | ATCC Cellosaurus |
| MDCK-Zellen | Madin Darby canine kidney | Hund | Niere | Epithel | ATCC Cellosaurus |
| MTD-1A | Maus | Brustdrüse | Epithel | Cellosaurus | |
| MyEnd | myocardial endothelial | Maus | Herz | Endothel | Cellosaurus |
| Neuro-2A (N2A) | Neuroblastom | Maus | Gehirn | Neuroblast | DSMZ Cellosaurus |
| NIH-3T3 | NIH, 3-day transfer, inoculum 3 × 105 cells, contact-inhibited NIH Swiss mouse embryo | Maus | Embryo | Fibroblast | DSMZ Cellosaurus |
| NTERA-2 cl.D1 [NT2/D1] | Pluripotente Zelle mit Tretinoin differenzierbar | Mensch | Hoden, Lungenmetastase | Epithel | ATCC Cellosaurus |
| P19 | Pluripotente Zelle mit Tretinoin differenzierbar | Maus | Embryonales Karzinom | Epithel | DSMZ Cellosaurus |
| PANC-1 | pancreas 1 | Mensch | Pankreas, Adenokarzinom | Epithel | DSMZ Cellosaurus |
| Peer | Mensch | T cell leukemia | DSMZ Cellosaurus | ||
| RTL-W1 | rainbow-trout liver – Waterloo 1 cells | Regenbogenforelle – Oncorhynchus mykiss | Leber | Fibroblast (wahrscheinlich) | Cellosaurus |
| Sf-9 | Spodoptera frugiperda | Insekt – Spodoptera frugiperda (Nachtfalter) | Ovar | DSMZ Cellosaurus | |
| Saos-2 | Osteosarkom | Mensch | Knochen | Epithel | DSMZ Cellosaurus |
| T2 | Mensch | T cell leukemia /B cell line hybridoma | DSMZ Cellosaurus | ||
| T84 | Mensch | Kolorektales Karzinom / Lungenmetastase | Epithel | ATCC Cellosaurus | |
| U-937 | Mensch | Burkitt-Lymphom | monozytär | DSMZ Cellosaurus |
Geschichte
Die älteste tierische Zelllinie ist vermutlich das Sticker-Sarkom, ein infektiöser Tumor natürlichen Ursprungs, der vor bis zu 11.000 Jahren entstand.[18][19][20] Seit seiner Entstehung hat das Sticker-Sarkom etwa 1,9 Millionen Mutationen angesammelt, 646 Gene wurden deletiert.[20] In den Jahren 1951/1952 wurde erstmals eine unsterbliche menschliche Zelllinie aus einem Cervixkarzinom etabliert, welche später unter dem Namen HeLa bekannt wurde. In den folgenden Jahrzehnten wurden insbesondere Nährmedien, Wachstumsfaktoren und Bedingungen weiterentwickelt und neue Zelllinien etabliert.
Einzelnachweise
- ↑ Y. Katakura, S. Alam, S. Shirahata: Immortalization by gene transfection. In: Methods in cell biology. Band 57, 1998, S. 69–91, ISSN 0091-679X. PMID 9648100.
- ↑ D. Guo, L. Zhang, X. Wang, J. Zheng, S. Lin: Establishment methods and research progress of livestock and poultry immortalized cell lines: A review. In: Front Vet Sci. (2022), Band 9, S. 956357. doi:10.3389/fvets.2022.956357. PMID 36118350; PMC 9478797 (freier Volltext).
- ↑ X. Wu, S. Wang, M. Li, J. Li, J. Shen, Y. Zhao, J. Pang, Q. Wen, M. Chen, B. Wei, P. J. Kaboli, F. Du, Q. Zhao, C. H. Cho, Y. Wang, Z. Xiao, X. Wu: Conditional reprogramming: next generation cell culture. In: Acta pharmaceutica Sinica. B. Band 10, Nummer 8, August 2020, S. 1360–1381, doi:10.1016/j.apsb.2020.01.011, PMID 32963937, PMC 7488362 (freier Volltext).
- ↑ M. Zhong, L. Fu: Culture and application of conditionally reprogrammed primary tumor cells. In: Gastroenterology report. Band 8, Nummer 3, Juni 2020, S. 224–233, doi:10.1093/gastro/goaa023, PMID 32665854, PMC 7333928 (freier Volltext).
- ↑ S. Chapman, X. Liu, C. Meyers, R. Schlegel, A. A. McBride: Human keratinocytes are efficiently immortalized by a Rho kinase inhibitor. In: The Journal of clinical investigation. Band 120, Nummer 7, Juli 2010, S. 2619–2626, doi:10.1172/JCI42297, PMID 20516646, PMC 2898606 (freier Volltext).
- ↑ Maqsood MI, Matin MM, Bahrami AR, Ghasroldasht MM: Immortality of cell lines: challenges and advantages of establishment. In: Cell Biology International. 37. Jahrgang, Nr. 10, Oktober 2013, S. 1038–45, doi:10.1002/cbin.10137, PMID 23723166.
- ↑ Rebecca Skloot: Henrietta's Dance. In: Johns Hopkins Magazine. Abgerufen am 5. April 2021.
- ↑ Henle W, Henle G: Epidemiologic aspects of Epstein-Barr virus (EBV)-associated diseases. In: Annals of the New York Academy of Sciences. 354. Jahrgang, 1980, S. 326–31, doi:10.1111/j.1749-6632.1980.tb27975.x, PMID 6261650.
- ↑ Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE: Extension of life-span by introduction of telomerase into normal human cells. In: Science. 279. Jahrgang, Nr. 5349, Januar 1998, S. 349–52, doi:10.1126/science.279.5349.349, PMID 9454332, bibcode:1998Sci...279..349B.
- ↑ Kwakkenbos MJ, van Helden PM, Beaumont T, Spits H: Stable long-term cultures of self-renewing B cells and their applications. In: Immunological Reviews. 270. Jahrgang, Nr. 1, März 2016, S. 65–77, doi:10.1111/imr.12395, PMID 26864105, PMC 4755196 (freier Volltext).
- ↑ J. Neimark: Line of attack. In: Science. Band 347, Nummer 6225, Februar 2015, S. 938–940, doi:10.1126/science.347.6225.938, PMID 25722392.
- ↑ Register of Misidentified Cell Lines. In: iclac.org. 16. Januar 2023, abgerufen am 26. Mai 2023 (englisch).
- ↑ Home: Cellosaurus query 'problematic cell line'. In: cellosaurus.org. Abgerufen am 26. Mai 2023 (englisch).
- ↑ C. K. Shiau, D. L. Gu, C. F. Chen, C. H. Lin, Y. S. Jou: IGRhCellID: integrated genomic resources of human cell lines for identification. In: Nucleic acids research. Band 39, Database issueJanuar 2011, S. D520–D524, doi:10.1093/nar/gkq1075, PMID 21051335, PMC 3013678 (freier Volltext). Website [1].
- ↑ Gerhard Gstraunthaler, Toni Lindl: Zell- und Gewebekultur – Allgemeine Grundlagen und spezielle Anwendungen. Springer, 2013. ISBN 978-3-642-35997-2. S. 32–43.
- ↑ ATCC Cell Lines. Abgerufen am 6. Februar 2018 (englisch).
- ↑ Zbigniew Ruszczak et al.: Effects of rIFN alpha, beta, and gamma on the morphology, proliferation, and cell surface antigen expression of human dermal microvascular endothelial cells in vitro. In: The Journal of Investigative Dermatology. Band 95, Nr. 6, Dezember 1990, S. 693–699, doi:10.1111/1523-1747.ep12514496, PMID 1979080 (englisch).
- ↑ Claudio Murgia et al.: Clonal origin and evolution of a transmissible cancer. In: Cell. Band 126, Nr. 3, 11. August 2006, S. 477–487, doi:10.1016/j.cell.2006.05.051, PMID 16901782, PMC 2593932 (freier Volltext) – (englisch).
- ↑ Iain D. O’Neill: Concise review: transmissible animal tumors as models of the cancer stem-cell process. In: Stem Cells (Dayton, Ohio). Band 29, Nr. 12, Dezember 2011, S. 1909–1914, doi:10.1002/stem.751, PMID 21956952 (englisch).
- ↑ a b Heidi G. Parker, Elaine A. Ostrander: Cancer. Hiding in plain view--an ancient dog in the modern world. In: Science (New York, N.Y.). Band 343, Nr. 6169, 24. Januar 2014, S. 376–378, doi:10.1126/science.1248812, PMID 24458629, PMC 5204361 (freier Volltext) – (englisch).




