Atom

Die Atome sind Grundbausteine der Materie. Sie sind die kleinste Einheit, in die sich Materie mit chemischen oder mechanischen Mitteln zerlegen lässt. Der Name „Atom“ leitet sich vom griechischen ἄτομος/átomos, α-τεμνω ab, was „das Unzerschneidbare“ bedeutet. Anfang des 20. Jahrhunderts wurde entdeckt, dass Atome aus einer Atomhülle mit Elektronen und einem positiv geladenen Atomkern bestehen. Einige Jahrzehnte später fand man heraus, dass der Atomkern aus positiv geladenen Protonen und ungeladenen Neutronen aufgebaut ist.
Elektronen sind durch die elektromagnetische Wechselwirkung an einen oder mehrere Atomkerne gebunden. Dadurch entstehen die im Alltag bekannten chemischen Verbindungen. Deren Struktur und chemische Eigenschaften hängen wegen der Austauschwechselwirkung von der genauen Anzahl der Elektronen ab. Alle Atomsorten (Nuklide), die im neutralen Zustand dieselbe Anzahl Elektronen und damit Protonen besitzen, werden zu ein und demselben Element gezählt, wobei sich die Anzahl der Neutronen unterscheiden kann.
Verglichen mit alltäglichen Gegenständen sind Atome mit einem Durchmesser von etwa 0,1 nm winzig klein und deutlich kleiner als die Wellenlänge des Lichts. Einzelne Atome können daher nur mit speziellen Hilfsmitteln wie dem Rastertunnelmikroskop beobachtet werden. Entsprechend klein ist die Masse eines Atoms. Ein Wasserstoff-Atom wiegt ca. 10−27 kg. Dabei sind über 99,9 % der Masse im Atomkern konzentriert.
Entdeckungsgeschichte
Philosophische Überlegungen
Das Konzept, dass Materie aus diskreten Grundeinheiten (also „kleinsten Teilchen“) aufgebaut ist und nicht in beliebig kleine Stücke zerteilt werden kann, existiert seit Jahrtausenden, aber diese Ideen beruhten auf abstrakten philosophischen Überlegungen und nicht auf empirischer experimenteller Untersuchung. Die den Atomen in der Philosophie zugeschriebenen Eigenschaften variierten stark je nach philosophischer Schule, insbesondere zu verschiedenen Zeiten und in verschiedenen Kulturen. Dennoch wurde die Grundidee des Atoms Jahrtausende später von Wissenschaftlern übernommen, weil sie eine elegante Erklärung für neue Entdeckungen in der Chemie bot.[1]
Die früheste bekannte Erwähnung des Atomkonzepts in der Philosophie stammt aus dem 6. Jahrhundert v. Chr. aus Indien.[2] Die Nyaya- und Vaisheshika-Schulen entwickelten ausgearbeitete Theorien, wie sich Atome zu komplexeren Gebilden zusammenschlössen (erst in Paaren, dann je drei Paare).[3] Die Atomvorstellung in der griechischen Philosophie ist erstmals von Leukipp überliefert, dessen Schüler Demokrit seine Vorstellungen systematisierte. Etwa 450 v. Chr. prägte Demokrit den Begriff átomos, was etwa „das Unzerschneidbare“ bedeutet, also ein nicht weiter zerteilbares Objekt bezeichnet. In der Zeit des Hellenismus vertrat Epikur eine Atomtheorie. Obwohl die indischen und griechischen Atomvorstellungen rein philosophischer Natur waren, hat die moderne Chemie die Bezeichnung von Demokrit beibehalten.[1]
Bis zur Entwicklung der Chemie als Wissenschaft brachte das Atomkonzept keine neuen Erklärungen. 1661 publizierte der Naturphilosoph Robert Boyle sein Werk The Sceptical Chymist, in dem er argumentierte, die Materie sei aus diversen Kombinationen verschiedener „corpuscules“ aufgebaut und nicht aus den vier Elementen Wasser, Erde Feuer und Luft.[4] 1789 prägte Antoine Lavoisier den Begriff Element für Grundstoffe, die mit chemischen Methoden nicht weiter zerlegt werden können.[5]
Naturwissenschaftliche Forschung

1803 benutzte der englische Lehrer und Naturphilosoph John Dalton das Atomkonzept, um zu erklären, wieso Elemente immer in Verhältnissen kleiner ganzer Zahlen miteinander reagieren – Gesetz der multiplen Proportionen – und weshalb bestimmte Gase sich besser in Wasser lösen als andere. Er nahm an, dass jedes Element aus einer einzigartigen Sorte von Atomen besteht und dass diese Atome sich miteinander verbinden und dadurch chemische Verbindungen bilden.[6][7]
1827 erhielt die Atomtheorie durch die Beobachtungen des Botanikers Robert Brown zusätzliche Unterstützung. Er stellte bei Untersuchungen mit dem Mikroskop fest, dass Pollen und Staubkörner in Wasser sich ungeordnet hin und her bewegten – ein Phänomen, das als Brownsche Bewegung bekannt wurde. Diese Beobachtung wurde durch eine mathematische Untersuchung Albert Einsteins von 1905 als Effekt von Stößen mit Wassermolekülen, die sich thermisch bewegen, erklärt.[8][9][10] Der französische Physiker Jean Perrin benutzte Einsteins Arbeit, um experimentell Masse und Größe von Atomen zu bestimmen, und bestätigte damit Daltons Atomtheorie.[11]
Joseph John Thomson entdeckte 1897 bei seiner Arbeit mit Kathodenstrahlen das Elektron und stellte fest, dass es ein Bestandteil von Atomen ist, womit er das Konzept des Atoms als unzerteilbarer Einheit zerstörte.[12] Thomson glaubte, dass die Elektronen im Atom verteilt seien und ihre Ladung durch ein gleichmäßiges, positiv geladenes Medium kompensiert würde (Thomsonsches Atommodell).
Eine Forschungsgruppe um Ernest Rutherford beschoss 1909 eine Goldfolie mit (positiv geladenen) Heliumatomkernen (Alphastrahlung) und stellte fest, dass ein kleiner Anteil der Teilchen um sehr viel größere Winkel abgelenkt wurden, als Thomsons Modell es vorhersagte. Rutherford schloss aus diesem Experiment, dass die positive Ladung eines Atoms und der Großteil seiner Masse in einem Atomkern in der Mitte des Atoms konzentriert sei und die Elektronen um diesen Kern kreisten wie die Planeten um die Sonne (Rutherfordsches Atommodell). Die positiv geladenen Teilchen, die sehr nah an diesen Kern kamen, würden sehr viel stärker abgelenkt, als andere.[13]
Bei Experimenten mit den Produkten radioaktiver Zerfälle stellte der Radiochemiker Frederick Soddy 1913 fest, dass es anscheinend mehr als eine Atomart für jedes Element gab.[14] Der Begriff Isotop für verschiedene Atome desselben Elements wurde von Margaret Todd geprägt. J. J. Thomson entwickelte bei seiner Arbeit über ionisierte Gase ein Verfahren zur Trennung verschieden schwerer Atome, was zur Entdeckung stabiler Isotope führte.[15]

1913 überarbeitete Niels Bohr Rutherfords Atommodell und nahm an, dass die Elektronen sich nur auf bestimmten quantisierten Umlaufbahnen (Schalen) aufhalten und zwischen diesen „springen“, sich jedoch nicht in Zwischenzuständen aufhalten könnten.[16] Ein Elektron muss eine bestimmte Menge an Energie aufnehmen oder abgeben, um zwischen diesen festen Schalen zu wechseln. Wenn das Licht, das von einem erhitzten Material abgestrahlt wird, durch ein Prisma geleitet wird, erzeugt es ein farbiges Emissionsspektrum. Die Existenz fester Spektrallinien in diesen Spektren wurde erfolgreich durch die Übergänge des Elektrons zwischen den Schalen im Atome erklärt.[17]
Chemische Bindungen wurden 1916 von Gilbert Newton Lewis im Rahmen des bohrschen Atommodells durch Wechselwirkung der Elektronen der Bestandteile erklärt.[18] Um zu erklären, dass sich die chemischen Eigenschaften der Elemente grob periodisch mit der Ordnungszahl verhalten,[19] schlug Irving Langmuir 1919 vor, dass Elektronen in einem Atom verbunden oder verklumpt seien. Elektronengruppen besetzten nach dieser Vorstellung bestimmte Elektronenschalen um den Kern.[20]
Der Stern-Gerlach-Versuch von 1922 erbrachte neue Erkenntnisse über die quantenmechanischen Eigenschaften von Atomen. Ein Strahl aus Silberatomen, der durch ein speziell geformtes Magnetfeld geleitet wird, spaltet sich abhängig von der Richtung des Drehimpulses des äußersten Elektrons des Atoms auf. Es wurde erwartet, dass diese Richtung zufällig ist und der Strahlquerschnitt eine Linie beschreiben würde. Stattdessen wurde der Strahl in zwei Teile aufgespalten, was darauf hindeutete, dass nur zwei Ausrichtungen des Drehimpulses oder Spins vorkommen.[21]
Aufbauend auf dem von Louis de Broglie 1924 postulierten Welle-Teilchen-Dualismus entwickelte Erwin Schrödinger 1926 ein Atommodell, das die Elektronen als dreidimensionale Wellen und nicht als Teilchen beschreibt. Eine Folge der Beschreibung durch Wellen ist, dass es unmöglich ist, genaue Werte sowohl für Ort als auch Impuls eines Elektrons zu erhalten. Dieser Sachverhalt wurde als Unschärferelation 1926 von Werner Heisenberg im Kontext eines verwandten Modells beschrieben. Nach der Unschärferelation können nur Wahrscheinlichkeitsverteilungen für Wertebereiche von Ort und Impuls angegeben werden. Obwohl sich dieses Modell schwer bildlich darstellen ließ, gelang es damit sehr viel besser als mit den Vorläufermodellen, die Eigenschaften insbesondere größerer Atome als Wasserstoff, wie z. B. ihre Spektrallinien und ihre Elektronenstruktur, zu beschreiben. Daher wurde das bohrsche Atommodell zugunsten des sogenannten Orbitalmodells des Atoms verworfen, das beschreibt, in welchen Gebieten die Elektronen sich am wahrscheinlichsten aufhalten.[22][23]

Die Entwicklung des Massenspektrometers ermöglichte es, Atommassen genau zu messen. Das Gerät verwendet einen Magneten, um einen Ionenstrahl auf eine gekrümmte Bahn zu lenken. Die Ablenkung wird dabei durch das Verhältnis der Masse der Ionen zu ihrer Ladung bestimmt. Francis William Aston zeigte mit einem solchen Instrument, dass Isotope des gleichen Elements verschiedene Atommassen haben und dass diese sich um ganzzahlige Vielfache der Masse des Wasserstoffatoms unterscheiden.[24] Die Erklärung für die Existenz verschiedener Isotope gelang mit der Entdeckung des Neutrons, eines neutralen Teilchens mit einer Masse ähnlich der des Protons, durch James Chadwick im Jahr 1932. Isotope wurden als Atomsorten mit gleich vielen Protonen, aber verschieden vielen Neutronen im Atomkern erklärt.[25]
Der deutsche Chemiker Otto Hahn, ein Schüler Rutherfords, untersuchte im Jahr 1938 Atomkerne. Dazu beschoss er Uran-Atome mit Neutronen in der Erwartung, dass sich die Masse der Atome erhöht, also Transurane entstehen. Chemisch wurde jedoch überraschenderweise Barium nachgewiesen. In einem Brief unterrichtete er seine Mitarbeiterin Lise Meitner, die aufgrund ihrer jüdischen Religion vor den Nazis nach Schweden geflohen war, über die experimentellen Befunde und merkte dabei an, dass das Uran ja „nicht in Barium zerplatzt sein kann“. Lise Meitner und ihr Neffe Otto Frisch konzipierten eine neue Versuchsanordnung: nach der Bestrahlung von Uran mit Neutronen suchten sie mittels einer Ionisationskammer explizit nach leichten Spaltprodukten, waren dabei erfolgreich und konnten Hahns Ergebnis als Kernspaltung interpretieren[26] (siehe auch: Entdeckung der Kernspaltung).[27] Hahn erhielt den Nobelpreis für Chemie des Jahres 1944, wobei der Beitrag von Meitner und Frisch, trotz dahingehender Bemühungen Hahns, nicht berücksichtigt wurde.
In den 1950er Jahren ermöglichte die Entwicklung verbesserter Teilchenbeschleuniger und Teilchendetektoren die Untersuchung von Atomen bei sehr hohen Energien.[28] Die „Tiefinelastische Streuung“ von Elektronen sehr hoher Energie an Atomkernen zeigte, dass Neutronen und Protonen Hadronen sind, die aus Quarks zusammengesetzt sind.[29]
1985 entwickelte eine Arbeitsgruppe um Steven Chu an den Bell Labs ein Verfahren, die Temperatur von Atomen mittels Laserstrahlung stark zu verringern. Im selben Jahr gelang es einer Gruppe um William D. Phillips, Natriumatome in einer Magnetfalle einzuschließen. Durch Kombination dieser Verfahren mit einer Methode, die den Dopplereffekt benutzt, gelang es einer Arbeitsgruppe um Claude Cohen-Tannoudji, geringe Mengen von Atomen auf einige Mikrokelvin zu kühlen. Dieses Verfahren ermöglicht es, die Atome mit hoher Genauigkeit zu untersuchen,[30] und ermöglichte auch die experimentelle Realisierung der Bose-Einstein-Kondensation.[31] In den 2000er Jahren wurde die Handhabbarkeit einzelner Atome durch neue Technologien unter anderem genutzt um einen Transistor aus nur einem Metallatom mit organischen Liganden herzustellen.[32]
Atomsorten


Es gibt verschiedene Atomsorten, die sich nach einzelnen Bestandteilen unterscheiden. Unterscheiden sich zwei Atome in einem oder mehreren Kernbestandteilen, so spricht man von verschiedenen Nukliden. Nuklide können sich in der Anzahl Protonen und Neutronen, aber auch im Energiezustand des Kerns unterscheiden. Ist die Anzahl an Protonen zweier Nuklide gleich, handelt es sich um Atome des gleichen chemischen Elements. Nuklide eines Elementes mit unterschiedlicher Neutronenanzahl werden Isotope genannt. Seltener werden auch Isotone unterschieden, bei denen sich die Protonenanzahl unterscheidet, während die Neutronenzahl gleich ist. Nuklide, die sich nur im Energiezustand des Kerns unterscheiden, werden Isomere genannt.
Es sind mit dem Stand von 2003 insgesamt etwa 3200 Nuklide[33], die sich auf etwa 2700 Isotope[34] und 117 bekannte Elemente bis zum Ununoctium verteilen. Die Stabilität der Nuklide hängt von dem Verhältnis von Protonen und Neutronen ab, bei einem ungünstigen Verhältnis ist der Kern instabil und zerfällt zu anderen Kernen. Genauer lassen sich die Stabilitäten des Kerns mit dem Schalenmodell erklären.
Wird das gesamte Atom betrachtet, kann zwischen neutralen und geladenen Atomen unterschieden werden. Bei neutralen Atomen entspricht die Anzahl der Elektronen der an Protonen, dadurch ist das resultierende Atom elektrisch neutral. Sind dagegen mehr oder weniger Elektronen als Protonen im Atom, so ist das Atom elektrisch geladen und wird Ion genannt. Sind weniger Elektronen als Protonen vorhanden, ist das Atom positiv geladen und man spricht von einem Kation. Bei einem Elektronenüberschuss sind die Atome negativ geladen und das Ion wird nun Anion genannt.
Um Elemente und Nuklide zu sortieren, sind verschiedene graphische Hilfsmittel entwickelt worden. Für Elemente wird das Periodensystem verwendet, bei dem die einzelnen Elemente nach Aufbau und Eigenschaften nach aufsteigender Ordnungszahl sortiert und gleichzeitig nach Eigenschaften, die eng mit der Besetzung der Orbitale verbunden sind, in Gruppen untereinander gesetzt werden. Isotope werden in Nuklidkarten dargestellt, bei denen auf einer Achse die Protonen-, auf der anderen die Neutronenzahl aufgetragen ist. Häufig wird über die Farbe zusätzlich die Art des Zerfalls dargestellt.
Entstehung
Stabile Protonen und Elektronen existierten eine Sekunde nach dem Urknall. In den folgenden drei Minuten verschmolz ein Teil der Protonen und Neutronen miteinander und bildete vor allem Deuterium- und Helium-, in geringerem Umfang auch Lithiumkerne. Möglicherweise wurden auch kleinere Mengen Beryllium und Bor durch diese primordiale Nukleosynthese gebildet.[35] Die ersten vollständigen Atome mit gebundenen Elektronen wurden erst 380.000 Jahre nach dem Urknall gebildet, als das Universum durch Expansion ausreichend abgekühlt war und damit Rekombinationen von Atomkernen und Elektronen möglich waren.[36]
Alle schwereren Atome werden durch verschiedene Prozesse der Kernfusion erzeugt. Die wichtigsten sind dabei die der Nukleosynthese, bei denen in Sternen zunächst Helium, anschließend auch schwerere Elemente bis zum Eisen gebildet werden. Seltener sind die Spallation, die bei der Entstehung von 6Li wichtig ist[37], der in Supernovae ablaufende r-Prozess und der s-Prozess, der in AGB-Sternen abläuft. Durch diese beiden Prozesse können auch schwerere Elemente als Eisen entstehen. Weiterhin spielen radioaktiver Zerfälle eine Rolle für die Synthese verschiedener Elemente und Isotope.
Vorkommen und Verteilung

Atome bilden nach dem Lambda-CDM-Modell mit einer mittleren Dichte von 0,25 Atome/m3 etwa 4,6 % der Energiedichte des beobachtbaren Universums. Der Rest setzt sich aus etwa 23 % dunkler Materie und 72 % dunkler Energie, sowie Neutrinos zusammen, deren Natur jedoch noch weitgehend unklar ist.[38] Innerhalb einer Galaxie wie der Milchstraße ist die Konzentration von Atomen viel höher, nämlich zwischen 105 und 109 Atome/m3 im interstellaren Medium (ISM).[39] Die Sonne befindet sich in der weitgehend staubfreien lokalen Blase, daher ist die Dichte in der Umgebung des Sonnensystems nur etwa 103 Atome/m3.[40]
In der Verteilung der unterschiedlichen Elemente dominiert im Universum mit Abstand Wasserstoff, danach folgt das um etwa eine Zehnerpotenz seltenere Helium. Alle schwereren Elemente sind deutlich seltener und machen nur einen kleinen Teil der im Universum vorhandenen Elemente aus. Die Häufigkeiten dieser Elemente werden dabei von den verschiedenen Mechanismen der Nukleosynthese bestimmt.[41]
Sterne bilden dichte Wolken im interstellaren Medium und die Entwicklungsprozesse von Sternen sorgen für eine ständige Anreicherung des interstellaren Mediums mit schwereren Elementen als Wasserstoff und Helium. Bis zu 95 % der Atome in der Milchstraße sind in Sternen konzentriert und die Gesamtmasse der Atome macht etwa 10 % der Masse der Milchstraße aus,[42] wobei der Rest der Masse von dunkler Materie herrührt.[43]
Auf der Erde überwiegen im Gegensatz zum Universum die schweren Elemente, da Wasserstoff und Helium im Sonnensystem vorwiegend in der Sonne und den Gasplaneten enthalten sind. Die häufigsten Elemente sind Sauerstoff, Eisen, Silicium und Magnesium. Dabei besteht der Erdkern vorwiegend aus Eisen, während in der Erdkruste Sauerstoff und Silicium in Form von Silicaten dominieren.
Bestandteile des Atoms
Ein Atom ist aus zwei unterschiedlichen Bestandteilen aufgebaut, einem positiv geladenem Atomkern, der im Vergleich zum gesamten Atom sehr klein ist und fast die gesamte Masse des Atoms besitzt, sowie der Atomhülle, die aus negativ geladenen Elektronen besteht.
Atomkern
Aufbau

Die in einem Atom vorhandenen, aneinander gebundenen Protonen und Neutronen, zusammen auch als Nukleonen bezeichnet, bilden den Atomkern. Die Nukleonen zählen zu den Hadronen. Das Proton ist positiv geladen, das Neutron ist elektrisch neutral. Nach dem Standardmodell der Elementarteilchenphysik sind Proton und Neutron aus Elementarteilchen, den Quarks, aufgebaut. Die Quarks werden durch die starke Wechselwirkung zusammengehalten, die durch Gluonen vermittelt wird. Diese starke Wechselwirkung ist auch für den Zusammenhalt des Atomkerns verantwortlich, da sie in Abständen bis zu etwa 2,5 Femtometer deutlich stärker als die gegenseitige elektrische Abstoßung der Protonen ist.[44] Der Radius des Kerns ist abhängig von der Anzahl Nukleonen und beträgt etwa fm, (A: Anzahl der Nukleonen im Kern).[45] Das ist sehr viel kleiner als der Radius des Atoms, der ungefähr im Bereich von 105 fm liegt. Nach dem Schalenmodell des Atomkerns sind Kerne mit bestimmten Nukleonenzahlen, beispielsweise Helium, Sauerstoff oder Blei, besonders stabil.
Bei niedrigen Ordnungszahlen sind Kerne mit annähernd gleich vielen Neutronen wie Protonen am stabilsten. Bei größeren Ordnungszahlen bewirkt die gegenseitige Abstoßung der Protonen, dass nur Kerne mit mehr Neutronen als Protonen stabil sind. Das Verhältnis von Neutronen zu Protonen in stabilen Atomkernen steigt daher mit zunehmender Ordnungszahl bis auf etwa 1,5. Ist das Verhältnis von Protonen und Neutronen ungünstig, so ist der Kern instabil und wandelt sich unter Energieabgabe spontan in stabilere Kerne um. Dieses Phänomen wird als Radioaktivität bezeichnet.
Masse
Da der Großteil der Atommasse von den Neutronen und Protonen stammt, wird die Gesamtzahl diese Teilchen in einem Atom als Massenzahl bezeichnet. Die Masse eines Atoms wird oft mittels der atomaren Masseneinheit angegeben. Diese Einheit entspricht einem Zwölftel der Masse des Kohlenstoffisotops 12C und ist etwa 1,66 × 10−27 kg.[46] Ein Atom des leichtesten Wasserstoffisotops hat eine Masse von 1,007825 u. Die Masse eines Atoms entspricht etwa dem Produkt aus der Massenzahl und der atomaren Masseneinheit. Das schwerste stabile Nuklid ist das Bleiisotop 208Pb mit einer Masse von 207,9766521 u.[47]
Da makroskopische Mengen einer Substanz sehr viele Atome enthalten und die Angabe ihrer Anzahl als natürliche Zahl unhandlich wäre, verwendet man für die Stoffmenge eine eigene Einheit, das Mol. Ein Mol eines Elements sind etwa 6,022 × 1023 Atome. Diese Zahl wurde so gewählt, dass ein Mol eines Elementes mit der Atommasse 1 u eine Masse von 0,001 kg oder 1 g hat. 12C hat beispielsweise eine Atommasse von 12 u, also hat ein Mol Kohlenstoff eine Masse von 0,012 kg.[46] Daher ist es in der Chemie üblich, Atommassen auch indirekt in g/mol anzugeben.
Bildung und Zerfall
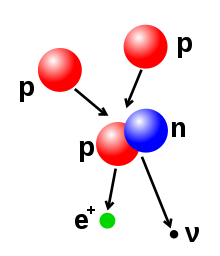
In welcher Art ein Atomkern zerfällt ist für das jeweilige Nuklid typisch. Mitunter kann ein Kern auch auf mehrere Arten zerfallen, so dass mehrere Zerfallsarten zu einem bestimmten Prozentsatz an einem Zerfall beteiligt sind. Die wichtigsten radioaktiven Zerfälle sind der Alpha-Zerfall, bei dem ein Helium-Atomkern aus zwei Protonen und zwei Neutronen abgegeben wird, der Beta-Zerfall, bei dem mittels der schwachen Wechselwirkung ein Neutron des Kerns in ein Proton oder umgekehrt umgewandelt wird und Elektronen und ein Antineutrino bzw. ein Positron und ein Neutrino ausgesendet werden, sowie der Gamma-Zerfall, bei dem ein Isomer unter Aussendung von Gammastrahlung in ein niedrigeres Energieniveau gelangt. Jedes radioaktive Isotop hat eine charakteristische Zerfallszeit – die Halbwertszeit – die angibt, wie lange es dauert bis die Hälfte einer Probe zerfallen ist.
Größere Atomkerne können aus kleineren Kernen gebildet werden. Dieser Vorgang wird Kernfusion genannt. Es ist so, dass sich Atomkerne für die Fusion sich sehr nah kommen müssen. Diesem Annähern steht die elektrostatische Abstoßung der positiv geladenen Protonen, der sogenannte Coulombwall entgegen. Aus diesem Grund ist eine Kernfusion nur unter sehr hohen Temperaturen von mehreren Millionen Grad und hohen Drücken, wie sie im Inneren von Sternen herrschen, möglich. Bei der Kernfusion werden durch Umwandlung von Masse in Energie gemäß der Äquivalenz von Masse und Energie, E = mc2 große Mengen Energie frei. Diese Energie äußert sich im Massendefekt und entspricht der Bindungsenergie des Atomkerns.[48] Die Kernfusion ist bei Elementen bis zum Eisen eine exotherme Reaktion, so dass sie selbsterhaltend ist und in Sternen kontinuierlich weiterläuft. Bei Atomkernen die größer sind als der des Eisens, nimmt die Bindungsenergie ab und die Fusion schwererer Atomkerne ist daher endotherm. Sie ist damit kein selbsterhaltender Prozess, was dazu führt, dass die Kernfusion in Sternen zum Erliegen kommt, wenn die leichten Atomkerne aufgebraucht sind.[49]
Atomhülle
Die Atomhülle besteht aus den negativ geladenen Elektronen und umgibt den Kern. Sie ist etwa 10.000-mal größer als dieser und bestimmt damit die Größe des Atoms. Gleichzeitig sind die Elektronen mit einer Masse von 9,11 × 10−31 kg so leicht, dass die Elektronenhülle praktisch nichts zur Masse des Atoms beiträgt. Sie sind zudem so klein, dass mit derzeitigen Messmethoden keine Ausdehnung festgestellt werden kann.[50]
Aufbau
Elektronen werden, wie alle Teilchen, in der Quantenmechanik durch eine Wellenfunktion beschrieben, die die Wahrscheinlichkeit angibt, mit der das Elektron in einem bestimmten Gebiet zu finden ist. Diese Wellenfunktion wird mit der Schrödingergleichung beschrieben, die die potentielle und kinetische Energie des Elektrons im Potential des Kerns beschreibt. Sie ist exakt nur für das Wasserstoffatom und wasserstoffähnliche Atome mit nur einem Elektron lösbar. Für kompliziertere Systeme mit mehreren Elektronen wird das Orbitalmodell als gute Nährung verwendet. Bei diesen gilt das Pauli-Prinzip, nachdem sich jedes Elektron in mindestens einem Zustand, repräsentiert durch unterschiedliche Quantenzahlen, unterscheiden muss. Dies führt dazu, dass jedes Orbital mit lediglich zwei Elektronen mit entgegengesetztem Spin, einer Art Eigendrehung des Elektrons, besetzbar ist, siehe Elektronenkonfiguration.
Eigenschaften
Die Atomhülle bestimmt maßgeblich viele Eigenschaften des gesamten Atoms. Je mehr Elektronen in der Hülle enthalten sind, desto größer ist ihre Ausdehnung. Allerdings ist diese diffus und besitzt keine exakt definierbare äußere Grenze. Daher wird ihre Größe üblicherweise durch den Abstand der Atomkerne zweier chemisch gebundener Atome angegeben. Neben der Anzahl der Elektronen und der Stärke ihrer Bindung an den Kern spielt auch die Umgebung, etwa die Anzahl benachbarter Atome eine Rolle für die Größe eines Atoms. Im Periodensystem gilt allgemein die Regel, dass die Größe durch zusätzliche Schalen von oben nach unten zunimmt, während von links nach rechts die Größe abnimmt, da die Elektronen stärker an den Kern gebunden sind. Dementsprechend ist das kleinste Atom das Heliumatom mit einem Radius von 32 pm, während eines der größten bekannten Atome das Cäsiumatom mit einem Radius von 225 pm ist.[51]
Im Gegensatz zu den Kernbestandteilen lassen sich Elektronen durch relativ kleine Energien beeinflussen. So besitzt jedes Elektron eines Atoms eine typische Energie, die sogenannte Bindungsenergie, durch die es vollständig entfernt werden kann. Die Größe der Bindungsenergie hängt von der Größe des Atoms, dem Abstand des Elektrons vom Kern und dem Ionisierungsgrad des Atoms ab. Auch die Art, Geometrie und Besetzung der Orbitale hat einen Einfluss auf die Bindungsenergie. Elektronen müssen durch Energieaufnahme nicht vollständig entfernt werden, es ist auch möglich, dass sie in weiter außen liegende Orbitale gehoben werden. Die Anregungsenergie kann in Form eines Photons bestimmter Wellenlänge wieder abgegeben werden, siehe Fluoreszenz.

Für viele Atome liegen diese Wellenlängen im sichtbaren Teil des Spektrums. Dadurch kommt das typische Linienspektrum vieler Elemente zu Stande. Bekannt ist beispielsweise die Natrium-D-Linie, eine Doppelline des Natriums im gelben Spektralbereich bei 588,99 nm und 589,59 nm.[52] Da die Energiedifferenz bei Absorption und Emission gleich ist, lassen sich die Linienspektren sowohl in Absorptions- als auch als Emissionsspektren beobachten.
Ein vor allem in der Chemie verwendetes anschauliches Maß für die Fähigkeit eines Atoms, Elektronen anzuziehen, ist die Elektronegativität. Je größer die Elektronegativität ist, desto stärker kann ein Atom Elektronen anziehen.
Atommodelle
In der Geschichte der Physik wurden mehrere Modelle zum Verständnis des Atoms entwickelt. Einige von ihnen werden heute nicht mehr verwendet und sind nur von wissenschaftsgeschichtlichem Interesse. Andere verwendet man je nach Anwendungsbereich als Näherung noch heute. In der Regel beschränkt man sich auf das einfachste Modell, welches im gegebenen Zusammenhang noch ausreicht, um die auftretenden Fragen zu klären.
Antiquierte Modelle
Das 1903 aufgestellte Rosinenkuchenmodell von Thomson ging davon aus, dass das Atom aus einer Kugel besteht, in der die positive Ladung und die Masse gleichmäßig verteilt ist und in der punktförmige Elektronen wie Rosinen in einem Kuchen eingebettet sind. Dieses Modell wurde 1909 durch den Rutherfordschen Streuversuch widerlegt, der nachwies, dass die positive Ladung eines Atoms in einem nahezu punktförmigen Kern konzentriert ist.
Rutherford stellte sich daher vor, dass die Elektronen wie Planeten im Sonnensystem um den Atomkern kreisen, von dem sie elektrostatisch angezogen werden. Diese Annahme stand jedoch im Widerspruch zur Elektrodynamik, aus der folgt, dass Ladungsträger, die sich wie hier die Elektronen auf gekrümmten Bahnen bewegen, kontinuierlich elektromagnetische Wellen abstrahlen und damit Energie abgeben.
Atome als harte Kugeln
Das einfachste Atommodell, das noch heute in Gebrauch ist, stellt sich ein Atom als eine harte Kugel mit festem Radius vor. Dieses Modell wird in der Kristallographie und in der kinetischen Gastheorie verwendet.
Das Bohrsche Atommodell
Das 1913 von Niels Bohr formulierte Bohrsche Atommodell greift das Rutherfordsche Planetenmodell auf. Danach bewegen sich die Elektronen auf Kreisbahnen um den Kern, wobei nur solche Bahnen erlaubt sind, bei denen der Bahndrehimpuls ein ganzzahliges Vielfaches einer Naturkonstanten, nämlich des reduzierten Planckschen Wirkungsquantums, ist.
Sommerfeld erweiterte das Bohrsche Atommodell um elliptische Elektronenbahnen. Wolfgang Pauli fand das Pauli-Prinzip, demgemäß keine zwei Elektronen in allen Quantenzahlen übereinstimmen können. Daraus folgt, dass bei zunehmender Ordnungszahl die zusätzlichen Elektronen, die die zusätzliche Kernladung ausgleichen, nur außen „angebaut“ werden können.
Das Schalenmodell
Das Schalenmodell ist in der Atomphysik ein Modell des Aufbaus der Atomhülle bzw. der Elektronenhüllen von Atomen. Das Schalenmodell ist eine Erweiterung des Bohrschen Atommodells und eine Vereinfachung des Orbitalmodells:
- Elektronen kreisen um den Atomkern ähnlich wie im Bohrschen Atommodell und
- der Aufenthaltsort der Elektronen kann nur durch eine Wahrscheinlichkeitsfunktion – die sog. Wellenfunktion als Lösung der Schrödingergleichung – bestimmt werden. Die Wellenfunktion kann durch sog. Wahrscheinlichkeitswolken oder -schalen visualisiert werden (wie im Orbitalmodell).
Das atomare Schalenmodell ist ein Atommodell, nach dem sich die Protonen und Neutronen eines Atoms im zentralen Atomkern und die Elektronen in der Atomhülle in um diesen angeordneten Schalen befinden. Die Schalen kann man sich bildlich wie bei einer Zwiebel vorstellen, die man von der Mitte ausgehend nicht nach oben und unten sondern radiär durchschreitet. Es sind räumliche Aufenthaltsbereiche für Elektronen mit ähnlichem Energiegehalt. Die erste Schale ausgehend vom Atomkern wird K-Schale genannt und fasst maximal zwei Elektronen; auf der nächsten Schale, der L-Schale, können maximal acht Elektronen untergebracht werden.
Die weiter außen liegenden Schalen können zwar mehr als acht Elektronen enthalten, bei den Hauptgruppen-Elementen spielen diese zusätzlichen Elektronen aber bezüglich der chemischen Eigenschaften so gut wie keine Rolle.
Das Orbitalmodell

Orbitale sind Einzelelektronen-Wellenfunktionen in der Quantenmechanik und werden meist mit oder (kleines Psi) abgekürzt. Das Betragsquadrat einer Wellenfunktion wird als Aufenthaltswahrscheinlichkeitsdichte des Elektrons interpretiert, das sie beschreibt (Bornsche Wahrscheinlichkeitsinterpretation).
Im Orbitalmodell existieren keine Kreisbahnen wie im Atommodell von Niels Bohr und auch keine anderen, definierten Bahnen (Trajektorien). Vielmehr brachten Entwicklungen der Quantenmechanik die Erkenntnis, dass der genaue Aufenthaltsort der Elektronen aufgrund der Unschärferelation Werner Heisenbergs nicht exakt, sondern nur ihre Verteilung stochastisch beschrieben werden kann.
Da die Aufenthaltswahrscheinlichkeit der Elektronen mit dem Abstand vom Atomkern asymptotisch gegen null geht und sich bis ins Unendliche erstreckt, wählt man als Orbital den Aufenthaltsraum, in dem sich das betrachtete Elektron mit etwa 90 % Wahrscheinlichkeit aufhält. Man erhält damit Räume, die ungefähr der Größe der Atome entsprechen. Die Begrenzungsflächen sind Flächen gleicher Aufenthaltswahrscheinlichkeit (Isoflächen). Die Abstände der größten Wahrscheinlichkeiten innerhalb der Orbitale, ein Elektron anzutreffen, entsprechen den von Niels Bohr errechneten Bahnabständen.
Die direkte Interpretation von Orbitalen als Wellenfunktionen ist nur bei Einzelelektronensystemen möglich. Bei Mehrelektronensystemen werden aber Orbitale in Slater-Determinanten eingesetzt um Mehrelektronen-Wellenfunktionen zu konstruieren. Solche Orbitale können durch Hartree-Fock-, Kohn-Sham-Rechnungen (siehe: Dichtefunktionaltheorie (Quantenphysik)) oder MCSCF-Rechnungen (MCSCF: Multiconfiguration Self Consistent Field) bestimmt werden, sind aber im Regelfall nicht eindeutig definiert (verschiedene Orbitalsätze repräsentieren die gleiche Mehrteilchen-Wellenfunktion).
Beobachtung

Das Rastertunnelmikroskop ist ein Gerät zur Oberflächenuntersuchung, das einzelne Atome sichtbar macht. Es verwendet den Tunneleffekt, der es Teilchen erlaubt, eine Energiebarriere zu passieren, die sie klassisch nicht überwinden könnten. Bei diesem Gerät tunneln Elektronen zwischen einer elektrisch leitenden Spitze und der elektrisch leitenden Probe. Bei Seitwärtsbewegungen zur Abrasterung der Probe wird die Höhe der Spitze so nachgeregelt, dass immer derselbe Strom fließt. Die Bewegung der Spitze bildet dann die Topographie und Elektronenstruktur der Probe ab. Da der Tunnelstrom sehr steil vom Abstand abhängt, ist die laterale Auflösung viel feiner als der Radius der Spitze, manchmal atomar.[53][54]
Ein Atom kann ionisiert werden, indem eines seiner Elektronen entfernt wird. Die elektrische Ladung sorgt dafür, dass die Flugbahn eines Ions von einem Magnetfeld abgelenkt wird. Dabei werden leichtere Atome stärker abgelenkt als schwerere. Das Massenspektrometer nutzt dieses Prinzip, um das Masse-zu-Ladung-Verhältnis von Ionen zu bestimmen.
Die Elektronenenergieverlustspektroskopie misst den Energieverlust eines Elektronenstrahls bei der Wechselwirkung mit einer Probe in einem Transmissionselektronenmikroskop. Eine tomographische Atomsonde erstellt ein dreidimensionales Bild mit einer Auflösung unterhalb eines Nanometers und kann die chemischen Elemente einzelner Atome feststellen.[55]
Atomspektren können benutzt werden um die Elementzusammensetzung entfernter Sterne zu bestimmen. Die verschiedenen Elemente lassen sich durch charakteristische Absorptionslinien im Spektrum identifizieren, die auf Absorption durch Atome des entsprechenden Elements in der Sternatmosphäre zurückgehen. Gasentladungslampen, die dasselbe Element enthalten, zeigen diese Linien als Emissionslinien.[56] Auf die Weise wurde Helium im Spektrum der Sonne nachgewiesen – 23 Jahre bevor es auf der Erde entdeckt wurde.[57]
Seltene und theoretische Formen
Zu jedem Materieteilchen gibt es ein entsprechendes Antiteilchen mit entgegengesetzter elektrischer Ladung. Das Positron ist ein positiv geladenes Antielektron und das Antiproton ist das negativ geladene Äquivalent zum Proton. Wenn ein Teilchen und das entsprechende Antiteilchen aufeinander treffen, annihilieren sie sich gegenseitig. Daher und wegen eines Überschusses an Materie gegenüber Antimaterie, dessen Ursache – die Baryogenese – nicht abschließend geklärt ist, sind die Antiteilchen selten im Universum. Im Ergebnis wurden keine Antimaterie-Atome in der Natur gefunden.[58][59] Allerdings wurden erstmals 1996 am CERN in Genf Antiwasserstoffatome künstlich hergestellt und nachgewiesen.[60][61]
Andere exotische Atome wurden hergestellt, in denen eines der Protonen, Neutronen oder Elektronen durch andere Teilchen derselben Ladung ersetzt wurden. Beispielsweise kann ein Elektron durch ein schwereres Myon ersetzt werden, wobei ein myonisches Atom entsteht. Solche exotischen Atome können benutzt werden um fundamentale physikalische Theorien zu überprüfen.[62][63][64]
Auch das Mott-Wannier-Exziton, ein Atom aus zwei Quasiteilchen der Festkörperphysik, gehorcht den gleichen Gesetzen.
Einzelnachweise
- ↑ a b Leonid I. Ponomarev: The Quantum Dice. 2. Auflage. Inst. of Physics Pub, 1993, ISBN 0-7503-0251-8, S. 14–15.
- ↑ Mrinalkanti Gangopadhyaya: Indian atomism: History and sources. Humanities Press, Atlantic Highlands (NJ) 1981, ISBN 0-391-02177-X.
- ↑ Dick Teresi: Lost Discoveries: The Ancient Roots of Modern Science--from the Babylonians to the Maya. Simon & Schuster, 2003, ISBN 0-7432-4379-X, S. 213–214.
- ↑ Robert Siegfried: From Elements to Atoms: A History of Chemical Composition. In: Transactions of the Americal Philosophical Society. Band 92, Nr. 4. American Philosophical Society, 2002, ISBN 0-87169-924-9, S. 42–55.
- ↑ Lavoisier's Elements of Chemistry. In: Elements and Atoms. Le Moyne College, Department of Chemistry, abgerufen am 18. Dezember 2007 (englisch).
- ↑ Charles Adolphe Wurtz: The Atomic Theory. D. Appleton and company, New York 1881, S. 1–2.
- ↑ J. Dalton: A New System of Chemical Philosophy, Part 1. S. Russell, London/Manchester 1808.
- ↑ Albert Einstein: Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen. In: Annalen der Physik. Band 322, Nr. 8, 1905, S. 549–560, doi:10.1002/andp.19053220806 (PDF [abgerufen am 4. Februar 2007]).
- ↑ Robert M. Mazo: Brownian Motion: Flucuations, Dynamics, and Applications. In: The International Series of Monographs on Physics. Band 112. Oxford University Press, 2002, ISBN 0-19-851567-7, S. 1–7.
- ↑ Y. K. Lee, Kelvin Hoon: Brownian Motion. Imperial College, London, 1995, abgerufen am 18. Dezember 2007 (englisch).
- ↑ G. Patterson: Jean Perrin and the triumph of the atomic doctrine. In: Endeavour. Band 31, Nr. 2, 2007, S. 50–53, doi:10.1016/j.endeavour.2007.05.003.
- ↑ The Nobel Foundation: J.J. Thomson. Nobelprize.org, 1906, abgerufen am 20. Dezember 2007 (englisch).
- ↑ E. Rutherford: The Scattering of a and ß Particles by Matter and the Structure of the Atom. In: Philosophical Magazine. Band 21, 1911, S. 669–688 (PDF, PDF [abgerufen am 18. Juni 2009]).
- ↑ Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation, abgerufen am 18. Januar 2008 (englisch).
- ↑ Joseph John Thomson: Bakerian Lecture: Rays of Positive Electricity. In: Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. Band 89, Nr. 607, 1913, S. 1–20 (PDF [abgerufen am 18. Juni 2009]).
- ↑ David P. Stern: The Atomic Nucleus and Bohr's Early Model of the Atom. NASA Goddard Space Flight Center, 16. Mai 2005, abgerufen am 20. Dezember 2007.
- ↑ Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture. The Nobel Foundation, 11. Dezember 1922, abgerufen am 16. Februar 2008 (englisch).
- ↑ Gilbert N. Lewis: The Atom and the Molecule. In: Journal of the American Chemical Society. Band 38, Nr. 4, April 1916, S. 762–786, doi:10.1021/ja02261a002.
- ↑ Eric R. Scerri: The Periodic Table. Oxford University Press US, 2007, ISBN 0-19-530573-6, S. 205–226.
- ↑ Irving Langmuir: The Arrangement of Electrons in Atoms and Molecules. In: Journal of the American Chemical Society. Band 41, Nr. 6, 1919, S. 868–934, doi:10.1021/ja02227a002.
- ↑ Marlan O. Scully, Willis E. Lamb Jr., Aaim Barut: On the theory of the Stern-Gerlach apparatus. In: Foundations of Physics. Band 17, Nr. 6, Juni 1987, S. 575–583, doi:10.1007/BF01882788.
- ↑ Kevin Brown: The Hydrogen Atom. MathPages, 2007, abgerufen am 21. Dezember 2007 (englisch).
- ↑ David M. Harrison: The Development of Quantum Mechanics. University of Toronto, März 2000, abgerufen am 21. Dezember 2007 (englisch).
- ↑ Francis W. Aston: The constitution of atmospheric neon. In: Philosophical Magazine. Band 39, Nr. 6, 1920, S. 449–55.
- ↑ James Chadwick: Nobel Lecture: The Neutron and Its Properties. Nobel Foundation, 12. Dezember 1935, abgerufen am 21. Dezember 2007 (englisch).
- ↑ Lise Meitner, Otto Robert Frisch: Disintegration of uranium by neutrons: a new type of nuclear reaction. In: Nature. Band 143, 1939, S. 239.
- ↑ Manfred Schroeder: Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages. (Online [abgerufen am 4. Juni 2009]).
- ↑ Sven Kullander: Accelerators and Nobel Laureates. The Nobel Foundation, 28. August 2001, abgerufen am 31. Januar 2008 (englisch).
- ↑ Staff: The Nobel Prize in Physics 1990. The Nobel Foundation, 17. Oktober 1990, abgerufen am 31. Januar 2008 (englisch).
- ↑ P. Domokos, J. Janszky, P. Adam: Single-atom interference method for generating Fock states. In: Physical Review. Band 50, 1994, S. 3340–3344, doi:10.1103/PhysRevA.50.3340 (Online [abgerufen am 3. Januar 2008]).
- ↑ The Nobel Prize in Physics 1997. Nobel Foundation, 15. Oktober 1997, abgerufen am 10. Februar 2008 (englisch).
- ↑ Jiwoong Park, et al: Coulomb blockade and the Kondo effect in single-atom transistors. In: Nature. Band 417, Nr. 6890, 2002, S. 722–725, doi:10.1038/nature00791 (Online [abgerufen am 3. Januar 2008]).
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. A 729, 2003, S. 3–128 ([http://www.nndc.bnl.gov/amdc/nubase/Nubase2003.pdf pdf).
- ↑ Ulrich Abram, Gernot Frenking: Isotope. In: Römpp Chemie-Lexikon. (Online [abgerufen am August 2008])..
- ↑ Craig J. Copi, David N. Schramm, Michael S Turner: Big-Bang Nucleosynthesis and the Baryon Density of the Universe. In: Science. Band 267, 1995, S. 192–199, doi:10.1126/science.7809624, PMID 7809624.
- ↑ Brian Abbott: Microwave (WMAP) All-Sky Survey. Hayden Planetarium, 30. Mai 2007, abgerufen am 13. Januar 2008 (englisch).
- ↑ D. C. Knauth, S. R. Federman, David L. Lambert, P. Crane: Newly synthesized lithium in the interstellar medium. In: Nature. Band 405, 2000, S. 656–658, doi:10.1038/35015028.
- ↑ Gary Hinshaw: What is the Universe Made Of? NASA/WMAP, 10. Februar 2006, abgerufen am 7. Januar 2008 (englisch).
- ↑ Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg: Radiochemistry and Nuclear Chemistry. Elsevier, 2001, ISBN 0-7506-7463-6.
- ↑ Arthur F. Davidsen: Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission. In: Science. Band 259, Nr. 5093, 1993, S. 327–334, doi:10.1126/science.259.5093.327, PMID 17832344.
- ↑ A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. Band 15, 1970, S. 121–146.
- ↑ James Lequeux: The Interstellar Medium. Springer, 2005, ISBN 3-540-21326-0.
- ↑ Nigel Smith: The search for dark matter. In: Physics World. 6. Januar 2000 (Online [abgerufen am 14. Februar 2008]).
- ↑ Jeremy I. Pfeffer: Modern Physics: An Introductory Text. Imperial College Press, 2000, ISBN 1-86094-250-4, S. 330–336.
- ↑ Tatjana Jevremovic: Nuclear Principles in Engineering. Springer, 2005, ISBN 0-387-23284-2, S. 63.
- ↑ a b Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu: Quantities, Units and Symbols in Physical Chemistry. 2. Auflage. Blackwell Scientific Publications, 1993, ISBN 0-632-03583-8.
- ↑ G. Audi, A. H. Wapstra, C. Thibault: The Ame2003 atomic mass evaluation (II). In: Nuclear Physics. A729, 2003, S. 337–676 (Online).
- ↑ J. Kenneth Shultis, Richard E. Faw: Fundamentals of Nuclear Science and Engineering. CRC Press, 2002, ISBN 0-8247-0834-2, S. 72–76.
- ↑ M. P. Fewell: The atomic nuclide with the highest mean binding energy. In: American Journal of Physics. Band 63, Nr. 7, 1995, S. 653–658, doi:10.1119/1.17828.
- ↑ Wolfgang Demtröder: Atoms, Molecules and Photons. An Introduction to Atomic-, Molecular- and Quantum Physics. Springer, Berlin 2006, ISBN 3-540-20631-0, S. 39–42.
- ↑ Steven S. Zumdahl: Introductory Chemistry: A Foundation. 5. Auflage. Houghton Mifflin, 2002, ISBN 0-618-34342-3.
- ↑ Yu. Ralchenko, A. E. Kramida, J. Reader: NIST Atomic Spectra Database. National Institute of Standards and Technology, Gaithersburg, MD, 2008, abgerufen am 27. März 2010 (Version 3.1.5).
- ↑ Marilyn Jacox, J. William Gadzuk: Scanning Tunneling Microscope. National Institute of Standards and Technology, November 1997, abgerufen am 11. Januar 2008 (englisch).
- ↑ The Nobel Prize in Physics 1986. The Nobel Foundation, abgerufen am 11. Januar 2008 (englisch, insbesondere der Nobel-Preis-Vortrag von G. Binnig und H. Rohrer).
- ↑ Erwin W. Müller, John A. Panitz, S. Brooks McLane: The Atom-Probe Field Ion Microscope. In: Review of Scientific Instruments. Band 39, Nr. 1, 1968, ISSN 0034-6748, S. 83–86, doi:10.1063/1.1683116.
- ↑ Jim Lochner, Meredith Gibb, Phil Newman: What Do Spectra Tell Us? NASA/Goddard Space Flight Center, 30. April 2007, abgerufen am 3. Januar 2008 (englisch).
- ↑ Mark Winter: Helium. WebElements, 2007, abgerufen am 3. Januar 2008 (englisch).
- ↑ Steve Koppes: Fermilab Physicists Find New Matter-Antimatter Asymmetry. University of Chicago, 1. März 1999, abgerufen am 14. Januar 2008 (englisch).
- ↑ William J. Cromie: A lifetime of trillionths of a second: Scientists explore antimatter. Harvard University Gazette, 16. August 2001, abgerufen am 14. Januar 2008 (englisch).
- ↑ Tom W. Hijmans: Particle physics: Cold antihydrogen. In: Nature. Band 419, 2002, S. 439–40, doi:10.1038/419439a.
- ↑ Staff: Researchers 'look inside' antimatter. BBC News, 30. Oktober 2002, abgerufen am 14. Januar 2008 (englisch).
- ↑ Roger Barrett, Daphne Jackson, Habatwa Mweene: The Strange World of the Exotic Atom. In: New Scientist. Nr. 1728, 1990, S. 77–115 (Online [abgerufen am 4. Januar 2008]).
- ↑ Paul Indelicato: Exotic Atoms. In: Physica Scripta. T112, 2004, S. 20–26, doi:10.1238/Physica.Topical.112a00020.
- ↑ Barrett H. Ripin: Recent Experiments on Exotic Atoms. American Physical Society, Juli 1998 (Online [abgerufen am 15. Februar 2008]).
Literatur
- Hans-Werner Kirchhoff: Vorstellungen vom Atom 1800-1934. Aulis Verlag Deubner, 2001, ISBN 978-3-7614-2300-4.
- Michael F. L'Annunziata: Handbook of Radioactivity Analysis. Academic Press, 2003, ISBN 0-12-436603-1.
- H. F. Beyer, V. P. Shevelko: Introduction to the Physics of Highly Charged Ions. CRC Press, 2003, ISBN 0-7503-0481-2.
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg: Radiochemistry and Nuclear Chemistry. Elsevier, 2001, ISBN 0-7506-7463-6.
- Wolfgang Demtröder: Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. 1. Auflage. Springer, 2002, ISBN 3-540-20631-0.
- Richard Feynman: Six Easy Pieces. The Penguin Group, 1995, ISBN 978-0-14-027666-4.
- Grant R. Fowles: Introduction to Modern Optics. Courier Dover Publications, 1989, ISBN 0-486-65957-7.
- Mrinalkanti Gangopadhyaya: Indian atomism: History and sources. Humanities Press, Atlantic Highlands (NJ) 1981, ISBN 0-391-02177-X.
- David L. Goodstein: States of Matter. Courier Dover Publications, 2002, ISBN 0-486-49506-X.
- Tatjana Jevremovic: Nuclear Principles in Engineering. Springer, 2005, ISBN 0-387-23284-2.
- James Lequeux: The Interstellar Medium. Springer, 2005, ISBN 3-540-21326-0.
- Z.-P.Liang, E. M. Haacke: Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. Hrsg.: J. G. Webster. Band 2. John Wiley & Sons, 1999, ISBN 0-471-13946-7, S. 412–26 (PDF).
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu: Quantities, Units and Symbols in Physical Chemistry. 2. Auflage. International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, Oxford 1993, ISBN 0-632-03583-8.
- Richard Myers: The Basics of Chemistry. Greenwood Press, 2003, ISBN 0-313-31664-3.
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr: Prentice Hall Science Explorer: Chemical Building Blocks. Prentice-Hall, Inc., Upper Saddle River, New Jersey USA 2002, ISBN 0-13-054091-9.
- Jeremy I. Pfeffer, Shlomo Nir: Modern Physics: An Introductory Text. Imperial College Press, 2000, ISBN 1-86094-250-4.
- Leonid I. Ponomarev: The Quantum Dice. 2. Auflage. Inst. of Physics Pub, 1993, ISBN 0-7503-0251-8.
- J. Kennth Shultis, Richard E. Faw: Fundamentals of Nuclear Science and Engineering. CRC Press, 2002, ISBN 0-8247-0834-2.
- Robert Siegfried: From Elements to Atoms: A History of Chemical Composition. In: Transactions of the Americal Philosophical Society. Band 92, Nr. 4. American Philosophical Society, 2002, ISBN 0-87169-924-9.
- Alan D. Sills: Earth Science the Easy Way. Barron's Educational Series, 2003, ISBN 0-7641-2146-4.
- Boris M. Smirnov: Physics of Atoms and Ions. Springer, 2003, ISBN 0-387-95550-X.
- Dick Teresi: Lost Discoveries: The Ancient Roots of Modern Science-from the Babylonians to the Maya. Simon & Schuster, 2003, ISBN 0-7432-4379-X, S. 213–214.
- David R. Lide (Hrsg.): Handbook of Chemistry & Physics. 88. Auflage. CRC, 2002, ISBN 0-8493-0486-5 (Online [abgerufen am 23. Mai 2008]).
- Graham Woan: The Cambridge Handbook of Physics. Cambridge University Press, 2000, ISBN 0-521-57507-9.
- Marco Zaider, Harald H. Rossi: Radiation Science for Physicians and Public Health Workers. Springer, 2001, ISBN 0-306-46403-9.
- Steven S. Zumdahl: Introductory Chemistry: A Foundation. 5. Auflage. Houghton Mifflin, 2002, ISBN 0-618-34342-3 (Online [abgerufen am 5. Februar 2008]).
Weblinks
- HydrogenLab: Wie sieht ein Atom aus?
- Das Atom im Jugendportal des Informationskreises Kernenergie
- Übersicht über die verschiedenen Atommodelle
Vorlage:Link FA Vorlage:Link FA Vorlage:Link FA Vorlage:Link FA Vorlage:Link GA Vorlage:Link GA

![{\displaystyle {\begin{smallmatrix}1{,}07{\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df647acf54df6e7dbebf1642c801f545dc0283e1)






