Ammoniumperrhenat
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
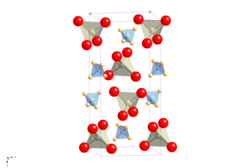
| |||||||||||||||||||
| _ N3− _ H+ _ Re7+ _ O2− | |||||||||||||||||||
| Raumgruppe |
I41/a (Nr. 88) | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumperrhenat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | NH4ReO4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 268,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,97 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung ab 200 °C[2] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ammoniumperrhenat ist eine anorganische chemische Verbindung aus der Gruppe der Perrhenate.
Gewinnung und Darstellung
Ammoniumperrhenat kann durch Reaktion von einer Perrheniumsäurelösung mit Ammoniak gewonnen werden.[5]
Eigenschaften
Ammoniumperrhenat ist ein weißer Feststoff,[1] der wenig löslich in Wasser ist. Er zerfällt bei 400 °C in Rhenium(IV)-oxid, Wasser und Stickstoff. Er besitzt eine tetragonale Kristallstruktur vom Scheelit-Typ mit der Raumgruppe I41/a (Raumgruppen-Nr. 88) und den Gitterparametern a = 587,1 pm und c = 1294,2 pm.[5]
Verwendung
Die bei der Reduktion von Ammoniumperrhenat mit 2-Hydrazinopyridin und Triphenylphosphin entstehenden Rhenium(III)-organohydrazide sind potenzielle Radiopharmaka.[1]
Einzelnachweise
- ↑ a b c d e Datenblatt Ammonium perrhenate, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 2. August 2013 (PDF).
- ↑ a b c Georg Brauer: Ammoniumperrhenat. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 1108.
- ↑ a b O. Glemser: Ammonium Perrhenate. In: Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, New York. Band 1, S. 1484–1485.
- ↑ a b Eintrag zu Ammoniumperrhenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ a b Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1633.







