Strontiumacetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
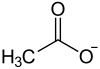 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumacetat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H6SrO4 | |||||||||||||||
| Kurzbeschreibung | farblose hygroskopische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse |
| |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 2,1 g·cm−3[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Strontiumacetat ist das Strontiumsalz der Essigsäure mit der Konstitutionsformel Sr(CH3COO)2.
Herstellung
Strontiumacetat kann durch Reaktion von Strontiumcarbonat oder Strontiumhydroxid mit Essigsäure dargestellt werden.
Eigenschaften
Strontiumacetat kristallisiert in der Kälte als Tetrahydrat, bei Raumtemperatur als Hemihydrat.[3]
Strontiumacetat zersetzt sich bei ca. 380 °C unter Bildung von Strontiumcarbonat.[6]
Einzelnachweise
- ↑ Eintrag zu STRONTIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. März 2022.
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-92.
- ↑ a b R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2, Verlag S. Hirzel, 1908, S. 231–232. (Volltext)
- ↑ a b Datenblatt Strontium acetate, 99.995% trace metals basis bei Sigma-Aldrich, abgerufen am 26. Februar 2013 (PDF).
- ↑ V. V. Cole, B. K. Harned, R. Hafkesbring: The Toxicity of Strontium and Calcium. In: Journal of Pharmacology and Experimental Therapeutics. 71, 1941, S. 1–5; Abstract.
- ↑ A. K. Galwey, M. E. Brown: Thermal decomposition of ionic solids. Verlag Elsevier, 1999, ISBN 0-444-82437-5, S. 450. (eingeschränkte Vorschau in der Google-Buchsuche)


![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)





