„Schwefeldioxid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Änderung 112786088 von 89.182.11.185 wurde rückgängig gemacht. Nicht nur S_8 verbrennt zu SO2. | |||
| (216 dazwischenliegende Versionen von mehr als 100 Benutzern, die nicht angezeigt werden) | |||
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie | {{Infobox Chemikalie | ||
| Strukturformel = [[Datei: | | Strukturformel = [[Datei:Structural formula of sulfur dioxide.svg|130px|Strukturformel von Schwefeldioxid]] | ||
| Suchfunktion = | | Suchfunktion = SO2 O2S | ||
| Andere Namen = * Schwefel(IV)-oxid | | Andere Namen = * Schwefel(IV)-oxid | ||
* Schwefligsäureanhydrid | * Schwefligsäureanhydrid | ||
* {{E-Nummer|220|Abruf=2020-12-29}} | |||
| Summenformel = SO<sub>2</sub> | | Summenformel = SO<sub>2</sub> | ||
| CAS = 7446-09-5 | | CAS = {{CASRN|7446-09-5}} | ||
| EG-Nummer = 231-195-2 | |||
| ECHA-ID = 100.028.359 | |||
| PubChem = 1119 | | PubChem = 1119 | ||
| Beschreibung = farbloses, stechend riechendes, giftiges Gas<ref name="GESTIS"/> | | ChemSpider = | ||
| Beschreibung = farbloses, stechend riechendes, giftiges Gas<ref name="GESTIS" /> | |||
| Molare Masse = 64,06 g·[[mol]]<sup>−1</sup> | | Molare Masse = 64,06 g·[[mol]]<sup>−1</sup> | ||
| Aggregat = gasförmig | | Aggregat = gasförmig | ||
| Dichte = | |||
| Dichte = 2,73 kg·m<sup>−3</sup> (1 bar, 15 °C) <ref name="praxair">[http://www.praxair.com/praxairgermany.nsf/AllContent/210E0695B80371F785256ECC0032087A/$File/SDB%20Schwefeldioxid-2006.10.16.pdf Sicherheitsdatenblatt (Praxair)]</ref> | |||
| Schmelzpunkt = −75,5 [[Grad Celsius|°C]]<ref name="Pangas">{{Internetquelle |url=https://produkte.linde-gas.at/sdb_konform/SO2_10021800DE.pdf |titel=Sicherheitsdatenblatt |datum=2021-12-21 |sprache=de |abruf=2023-03-28}}<!--http://www.pangas.ch/internet.lg.lg.che/de/images/pangas_sdb_schwefeldioxid_d553_115220.pdf--></ref> | |||
| Schmelzpunkt = −75 [[Grad Celsius|°C]] <ref name="praxair" /> | |||
| Siedepunkt = −10 °C | | Siedepunkt = −10,05 °C<ref name="Pangas" /> | ||
| Dampfdruck = 0, | | Dampfdruck = 0,3271 M[[Pascal (Einheit)|Pa]]<ref name="Pangas" /> (20 °C) | ||
| Löslichkeit = | | Löslichkeit = * 228,3 g/l bei 0 °C<ref name="GESTIS" /> | ||
* 112,7 g/l bei 20 °C<ref name="GESTIS" /> | |||
| Quelle GHS-Kz = {{CLP|CAS=7446-09-5|ZVG=1020}} | |||
| Dipolmoment = 1,63305 [[Debye|D]]<ref name="CRC90_9_52">{{CRC Handbook|Auflage=90|Titel=Dipole Moments|Kapitel=9|Startseite=52}}</ref> (5,4473 · 10<sup>−30</sup> [[Coulomb|C]] · [[Meter|m]]) | |||
| GHS-Piktogramme = {{GHS-Piktogramme|04|06|05}} | |||
| Brechungsindex = 1,000686 (0 °C, 101,325 kPa)<ref name="CRC90_10_254">{{CRC Handbook|Auflage=90|Titel=Index of Refraction of Gases|Kapitel=10|Startseite=254}}</ref> | |||
| CLH = {{CLH-ECHA|ID=100.028.359|Name=Sulphur dioxide|Abruf=2016-02-01}} | |||
| Quelle GHS-Kz = <ref name="GESTIS">{{GESTIS|Name=Schwefeldioxid|ZVG=1020|CAS=7446-09-5|Abruf=2021-01-08}}</ref> | |||
| GHS-Piktogramme = {{GHS-Piktogramme|04|05|06}} | |||
| GHS-Signalwort = Gefahr | | GHS-Signalwort = Gefahr | ||
| H = {{H-Sätze|331|314}} | | H = {{H-Sätze|280|331|314}} | ||
| EUH = {{EUH-Sätze| | | EUH = {{EUH-Sätze|071}} | ||
| P = {{P-Sätze|260|280 | | P = {{P-Sätze|260|280|303+361+353+315|304+340+315|305+351+338+315|403|405}} | ||
| Quelle P = <ref name="GESTIS" /> | | Quelle P = <ref name="GESTIS" /> | ||
| MAK = * [[Deutsche Forschungsgemeinschaft|DFG]]: 1 ml·m<sup>−3</sup> bzw. 2,7 mg·m<sup>−3</sup><ref name="GESTIS" /> | |||
| Quelle GefStKz = {{CLP|CAS=7446-09-5|ZVG=1020}} | |||
* Schweiz: 0,5 ml·m<sup>−3</sup> bzw. 1,3 mg·m<sup>−3</sup><ref>{{SUVA-MAK |Name=Schwefeldioxid |CAS-Nummer=7446-09-5 |Abruf=2020-05-16}}</ref> | |||
| Gefahrensymbole = {{Gefahrensymbole|T}} | |||
| ToxDaten = {{ToxDaten |Typ=LC50 |Organismus=Ratte |Applikationsart=inhalativ |Wert=2520 [[Parts per million|ppm]]·1 h |Bezeichnung= |Quelle=<ref>{{ChemID|CAS=7446-09-5|Name=Sulfur dioxide|Abruf=}}</ref> }} | |||
| R = {{R-Sätze|23|34}} | |||
| S = {{S-Sätze|(1/2)|9|26|36/37/39|45}} | |||
| MAK = 1,3 mg·m<sup>−3</sup> <ref name="GESTIS">{{GESTIS|ZVG=1020|CAS=7446-09-5|Name=Schwefeldioxid|Datum=30. März 2008}}</ref> | |||
| LD50 = [[LC50|LC<sub>50</sub>]] 2520 [[Parts per million|ppm]] (Ratte, inhalation) <ref>{{ChemID|7446-09-5|Sulfur dioxide}}</ref> | |||
}} | }} | ||
'''Schwefeldioxid''', SO<sub>2</sub>, ist das [[Anhydrid]] der [[Schweflige Säure|Schwefligen Säure]] H<sub>2</sub>SO<sub>3</sub>. Schwefeldioxid ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut (physikalisch) wasserlöslich und bildet mit Wasser in sehr geringem Maße Schweflige Säure. Es entsteht | '''Schwefeldioxid''', SO<sub>2</sub>, ist das [[Anhydrid]] der [[Schweflige Säure|Schwefligen Säure]] H<sub>2</sub>SO<sub>3</sub>. Schwefeldioxid ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut (physikalisch) wasserlöslich und bildet mit Wasser in sehr geringem Maße Schweflige Säure. Es entsteht unter anderem bei der Verbrennung von schwefelhaltigen fossilen [[Brennstoff]]en wie [[Kohle]] oder [[Erdöl]]produkten, die bis zu 4 Prozent [[Schwefel]] enthalten. Auch [[Biomasse]] enthält je nach Herkunft teils erhebliche Mengen Schwefel, da dieser ein [[Mengenelemente|Mengenelement]] in allen bekannten Lebewesen ist, wodurch bei Verbrennung ebenfalls Schwefeldioxid entsteht. Dadurch trägt es in erheblichem Maß zur [[Luftverschmutzung]] bei. Es ist der Grund für [[Saurer Regen|sauren Regen]], wobei das Schwefeldioxid zunächst von Sauerstoff zu [[Schwefeltrioxid]] oxidiert wird und dann mit Wasser zu [[Schwefelsäure]] (H<sub>2</sub>SO<sub>4</sub>) umgesetzt wird.<ref name="HoWi">{{Holleman-Wiberg|Auflage=102.|Startseite=?}}</ref> Um den Eintrag von Schwefeldioxid zu verhindern, gibt es verschiedene Verfahren zur [[Rauchgasentschwefelung]]. Zudem findet sich Schwefeldioxid im Umfeld von [[Hochtemperaturgebiet]]en und aktiven [[Vulkan]]en.<ref>H. U. Schmincke: ''Vulkanismus.'' Wiss. Buchgesellschaft, Darmstadt 2000, S. 224 ff.</ref> In den meisten Industrieländern werden Erdöl und Erdgas und daraus entstehende Produkte bereits vor der Verbrennung – zumeist mittels [[Hydrodesulfurierung]] – entschwefelt. Auch [[Biogas]] wird gemeinhin bei der [[Biogasaufbereitung]] vom enthaltenen [[Schwefelwasserstoff]] befreit, um ein ungiftigeres und sichereres Produkt zu erhalten. Die Kosten entsprechender Verfahren können – anders als der relativ preisgünstige [[REA-Gips]], welcher kaum die Kosten der Rauchgasentschwefelung deckt – zumeist zu großen Teilen oder gänzlich durch Verwendung der anfallenden Schwefelmengen in der chemischen Industrie gedeckt werden. | ||
Um dies zu verhindern gibt es verschiedene Verfahren zur [[Rauchgasentschwefelung]]. Zudem findet sich Schwefeldioxid im Umfeld von [[Hochtemperaturgebiet]]en und aktiven [[Vulkan]]en.<ref>H. U. Schmincke: ''Vulkanismus.'' Wiss. Buchgesellschaft, Darmstadt, 2000, 224ff.</ref> | |||
== Herstellung == | == Herstellung == | ||
Schwefeldioxid kann durch verschiedene Verfahren hergestellt werden: | Schwefeldioxid kann durch verschiedene Verfahren hergestellt werden: | ||
* durch Verbrennen von Schwefel oder Schwefelwasserstoff | * durch Verbrennen von [[Schwefel]] oder [[Schwefelwasserstoff]] | ||
:<math> | :<math>\mathrm { S + O_2 \ \longrightarrow \ SO_2}</math> | ||
* durch das Rösten von sulfidischen Erzen, z. B. von [[Pyrit]]: | * durch das [[Rösten (Metallurgie)|Rösten]] von sulfidischen Erzen, z. B. von [[Pyrit]]: | ||
:<math> | :<math>\mathrm {4 \; FeS_2 + 11 \; O_2 \ \longrightarrow \ 2 \; Fe_2O_3 + 8 \; SO_2} \qquad \Delta H<0 </math> | ||
* aus | * aus [[Sulfite]]n durch stärkere Säuren | ||
:<math> | :<math>\mathrm { Na_2SO_3 + 2 \; HCl \ \longrightarrow \ 2 \; NaCl + H_2O + SO_2}</math> | ||
* aus [[Kaliumdisulfit]] unter sauren Bedingungen: | |||
:<math>\mathrm{K_2S_2O_5 \ + \ 2 \ HCl \ \rightarrow \ 2 \ KCl \ + \ 2 \ SO_2 \ + \ H_2O}</math> | |||
== Eigenschaften == | == Eigenschaften == | ||
=== Physikalische Eigenschaften === | |||
Schwefeldioxid ist ein stechend riechendes, farbloses Gas. Es hat eine gute Wasserlöslichkeit, Lösungen sind dabei leicht sauer. Das Molekül ist gewinkelt: | |||
Schwefeldioxid hat eine [[Relative Dichte|relative Gasdichte]] von 2,26 (Dichteverhältnis zu trockener [[Luft]] bei gleicher [[Temperatur]] und gleichem [[Druck (Physik)|Druck]]) und eine [[Dichte]] der flüssigen Phase am Siedepunkt von 1,458 kg/l. Die Gasdichte unter [[Normalbedingungen]] (0 °C, 1013 mbar) beträgt 2,9285 kg·m<sup>−3</sup>, bei einer Temperatur von 15 °C und einem Druck von 1 bar hingegen 2,728 kg·m<sup>−3</sup>. | |||
Die [[Kritische Temperatur (Thermodynamik)|kritische Temperatur]] liegt bei 157,5 °C, der [[Kritischer Druck|kritische Druck]] bei 78,8 bar und die [[Kritische Dichte (Thermodynamik)|kritische Dichte]] erhält den Wert 0,525 g·cm<sup>−3</sup>. Am [[Tripelpunkt]] liegt eine Temperatur von −75,5 °C und ein Druck von 16,7 [[Bar (Einheit)|mbar]] (12,56 [[Torr]]) vor.<ref> {{Literatur | Autor= Giauque, W.F.; Stephenson, C.C.| Titel= Sulfur Dioxide. The Heat Capacity of Solid and Liquid. Vapor Pressure. Heat of Vaporization. The Entropy Values from Thermal and Molecular Data| Sammelwerk= [[Journal of the American Chemical Society]]| Band=60 | Nummer= 6| Datum= 1938| Seiten= 1389–1394| DOI=10.1021/ja01273a034}}</ref> | |||
=== Chemische Eigenschaften === | |||
[[Datei:Sulfur-dioxide-2D.svg|150px|Strukturformel von Schwefeldioxid mit Bindungslängen und Winkeln]] | |||
Schwefeldioxid ist ein farbloses, stechend riechendes und [[Korrodieren|korrodierendes]] Gas. Es löst sich gut in [[Wasser]], wobei eine [[Schwache Säuren|schwach saure]] Lösung entsteht. Des Weiteren wirkt Schwefeldioxid als [[Reduktionsmittel]].<ref name="RIEDEL">{{Literatur |Autor=[[Erwin Riedel]], [[Christoph Janiak]] |Titel=Anorganische Chemie |Auflage=9 |Verlag=Walter de Gruyter GmbH |Ort=Berlin |Datum=2015 |Seiten=470 |ISBN=978-3-11-035526-0 }}</ref> | |||
Das Schwefeldioxid-Molekül kann durch zwei [[Mesomerie|mesomere Grenzstrukturen]] beschrieben werden: | |||
{| class="prettytable" align="left" | |||
|[[E-Nummer]] || 220 | |||
|- | |||
| [[Kritische Temperatur (Thermodynamik)|kritische Temperatur]] || 157,5 °C<ref name="GESTIS" /> | |||
|- | |||
| [[kritischer Druck]] || 79 bar<ref name="GESTIS" /> | |||
|}<br style="clear:left" /> | |||
[[Datei:Resonance structures of sulfur dioxide.svg|300px|Resonanzstrukturen von Schwefeldioxid (mesomere Grenzstrukturen)]] | |||
Schwefeldioxid ist [[Mesomerie|mesomeriestabilisiert]]: | |||
Hierbei werden die beiden [[Sigma-Bindung|σ-Bindungen]] (zwei S–O-Bindungen) und das [[Freies Elektronenpaar|freie Elektronenpaar]] am [[Schwefel|S-Atom]] von dem [[S-Orbital|s-]] und den zwei [[P-Orbital|p-Orbitalen]] des S-Atoms gebildet. Die [[π-Bindung]] ist über das gesamte Molekül delokalisiert (Mehrzentren-π-Bindung).<ref name="RIEDEL" /> | |||
[[Datei:Sulfurdioxide-resonance.svg|400px|none|Mesomere Grenzformeln von Schwefeldioxid]] | |||
=== Molekülgeometrie === | |||
Gemäß dem [[VSEPR-Modell]] ist das Schwefeldioxid-Molekül gewinkelt gebaut. Daraus resultiert ein [[Bindungswinkel]] (O–S–O) von 119,5°. Die beiden S–O-Bindungen sind mit einer [[Bindungslänge]] von 143 pm gleich lang und damit sehr kurz.<ref name="RIEDEL" /> | |||
[[Datei:Angle and bond length of sulfur dioxide molecule.svg|150px|Winkel und Bindungslänge eines Schwefeldioxid-Moleküls]] | |||
Schwefeldioxid besitzt als Molekülsymmetrie die [[Punktgruppe]] C<sub>2v</sub>.<ref name="RIEDEL 2">{{Literatur |Autor=Erwin Riedel, Christoph Janiak |Titel=Anorganische Chemie |Auflage=9 |Verlag=Walter de Gruyter GmbH |Ort=Berlin |Datum=2015 |Seiten=238 |ISBN=978-3-11-035526-0 }}</ref> | |||
== Verwendung == | == Verwendung == | ||
[[Flüssigkeit|Flüssiges]] Schwefeldioxid löst zahlreiche Stoffe und hat sich daher als wertvolles aprotisch-polares [[Lösungsmittel]] etabliert. | [[Flüssigkeit|Flüssiges]] Schwefeldioxid löst zahlreiche Stoffe und hat sich daher als wertvolles aprotisch-polares [[Lösungsmittel]] etabliert. | ||
In der [[Lebensmittelindustrie]] findet Schwefeldioxid als [[Konservierung]]s-, [[Antioxidantien|Antioxidations]]- und [[Desinfektion]]smittel Verwendung, vor allem für Trockenfrüchte, Kartoffelgerichte, Fruchtsäfte, Marmelade und [[Wein]]. Wein- und Bierfässer werden zur Desinfizierung vor der Verwendung durch Behandlung mit SO<sub>2</sub>-Gas ''ausgeschwefelt''. | In der [[Lebensmittelindustrie]] findet Schwefeldioxid als [[Konservierung]]s-, [[Antioxidantien|Antioxidations]]- und [[Desinfektion]]smittel Verwendung, vor allem für Trockenfrüchte, Kartoffelgerichte, Fruchtsäfte, Marmelade und [[Wein]]. Wein- und Bierfässer werden zur Desinfizierung vor der Verwendung durch Behandlung mit SO<sub>2</sub>-Gas ''ausgeschwefelt''.<ref>{{Internetquelle |hrsg=Grillo-Werke AG |titel=SCHWEFELDIOXID FLÜSSIG |url=https://grillo.de/?page_id=74 |abruf=2018-11-09}}</ref> | ||
Schwefeldioxid zerstört das [[Thiamin|Vitamin B1]]; ebenso finden sich in Laborversuchen Hinweise auf eine Zerstörung von [[Cobalamine|B12-Vitaminen]].<ref> | Schwefeldioxid zerstört das [[Thiamin|Vitamin B1]]; ebenso finden sich in Laborversuchen Hinweise auf eine Zerstörung von [[Cobalamine|B12-Vitaminen]].<ref>H.-D. Belitz, W. Grosch: ''Food Chemistry.'' Springer Verlag, Berlin/ Heidelberg 1999.</ref> In der [[Europäische Union|EU]] ist es als [[Lebensmittelzusatzstoff]] der Nummer ''E 220'' auch für [[Ökologische Landwirtschaft|Bio]]-Produkte zugelassen. | ||
Es dient auch zur Herstellung von [[Sulfurylchlorid]] SO<sub>2</sub>Cl<sub>2</sub> und [[Thionylchlorid]] SOCl<sub>2</sub>. | Es dient auch zur Herstellung von [[Sulfurylchlorid]] SO<sub>2</sub>Cl<sub>2</sub> und [[Thionylchlorid]] SOCl<sub>2</sub>. In der [[Sulfochlorierung]] dient es zur Herstellung von [[Tenside]]n. | ||
Ferner ist Schwefeldioxid ein wichtiges [[Edukt]] zur Herstellung von [[Schwefeltrioxid]], um anschließend konzentrierte [[Schwefelsäure]] z. | Ferner ist Schwefeldioxid ein wichtiges [[Edukt]] zur Herstellung von [[Schwefeltrioxid]], um anschließend konzentrierte [[Schwefelsäure]] z. B. mit dem [[Kontaktverfahren]] herzustellen. | ||
Schwefeldioxid dient auch zur Herstellung von vielen Chemikalien, Medikamenten und Farbstoffen und zum [[Bleichen]] von Papier und Textilien. | Schwefeldioxid dient auch zur Herstellung von vielen Chemikalien, Medikamenten und Farbstoffen und zum [[Bleichen]] von Papier und Textilien. | ||
Es lässt Tinte verblassen. | Es lässt Tinte verblassen. | ||
Außerdem wird es als [[Schutzgas]]<ref>Matthias Bünck: ''Gießeigenschaften.'' In: Andreas Bührig-Polaczek, Walter Michaeli, Günter Spur (Hrsg.): ''Handbuch Spanen.'' Hanser, München 2014, S. 36.</ref> verwendet, etwa um flüssige Metallschmelzen in der [[Gießerei]] an der Oxidation zu hindern. | |||
== Aufbewahrung == | |||
Schwefeldioxid wird in der Industrie meist aus [[Gasflasche|Druckgasflaschen]] bezogen und wird häufig zur Temperierung in der Produktionsumgebung, also in Innenräumen aufbewahrt, oft auch direkt neben [[Industrieofen|Thermoprozessanlagen]].<ref name=":0">{{Literatur|Titel=SO2 Schrank zum Gesundheitsschutz |Sammelwerk=LT Gasetechnik|Datum=2016-10-26|Online=http://www.lt-gasetechnik.de/so2-schrank-zum-gesundheitsschutz-der-mitarbeiter/|Abruf=2017-04-12}}</ref> Im Rahmen der Gefährdungsbeurteilung ist für die Aufbewahrung von Schwefeldioxid gemäß § 5 [[Arbeitsschutzgesetz]] und § 6 [[Gefahrstoffverordnung|GefStoffV]] zu ermitteln, ob sich durch die Lagerung von Gefahrstoffen Gefährdungen für die Beschäftigten oder andere Personen ergeben können. | |||
Für die Aufbewahrung von Schwefeldioxid gelten (in Deutschland) insbesondere folgende Vorschriften: | |||
* [[TRGS]] 510 Lagerung von Gefahrstoffen in ortsbeweglichen Behältern | |||
* [[Technische Regeln für Betriebssicherheit|TRBS]] 3145 / TRGS 745 Ortsbewegliche Druckgasbehälter – Füllen, Bereitstellen, innerbetriebliche Beförderung, Entleeren | |||
* [[TRBS]] 3146 / TRGS 726 Ortsfeste Druckanlagen für Gase | |||
Zum Gesundheitsschutz der Mitarbeiter und um den Anforderungen des Arbeitsschutzgesetzes zu entsprechen, sind Schwefeldioxid -Flaschen daher in einer geeigneten Aufbewahrungseinrichtung aufzubewahren. Geeignet dafür ist der entsprechend ausgestattete Sicherheitsgasflaschenschrank, dessen besondere Ausstattung für die Schwefeldioxid-Aufbewahrung aus folgenden wesentlichen Komponenten besteht: | |||
* Der [[Sicherheitsschrank]] an sich, für eine oder mehrere Schwefeldioxid-Flasche(n) und eine Stickstoffgas-Flasche. Dabei sind oft zwei Flaschen Schwefeldioxid für den Betrieb und die automatische Umschaltung vorgesehen. Eine Flasche steht im Schrank zum Vortemperieren, aus der zweiten Flasche wird das Gas zur Verwendung entnommen. Die Stickstoffgas-Flasche dient der Versorgung der Spüleinrichtung für den sicheren Flaschenwechsel. Der Sicherheitsschrank wird als feuerhemmender Schrank ausgeführt, da das unter Druck stehende Gas bei Erwärmung explodieren kann und dann schwere Verätzungen der Haut und schwere Augenschäden verursacht. Der Schrank sollte abschließbar sein, da das Sicherheitsdatenblatt für Schwefeldioxid „P405 - Unter Verschluss aufbewahren“ vorgibt. | |||
* Schwefeldioxid -Druckregelstation aus Edelstahl mit automatischer Umschaltung, zur unterbrechungsfreien Medienversorgung. Die Schwefeldioxid -Gasflaschen werden mit Edelstahlwellschlauch angeschlossen. Die verwendeten Armaturen müssen aus Edelstahl sein, da Schwefeldioxid mit Luftfeuchtigkeit zu [[Schwefelsäure]] (H<sub>2</sub>SO<sub>4</sub>) umgesetzt wird. | |||
* Ein automatisches Absperrmagnetventil ermöglicht die Absperrung der Schwefeldioxid -Prozessleitung zur Verwendungsstelle bei Not-Aus-Betätigung oder bei Gas-Alarm. | |||
* Der Gaswarnsensor im Sicherheitsschrank, ggfs. mit zusätzlichen weiteren Gaswarnsensoren in der Nähe der Verwendungsstellen, erzeugt den Gas-Alarm mit optischem und akustischem Signal. | |||
* Fremdbelüftung mit Ventilator zur manuellen Betätigung durch den Benutzer und automatischen Auslösung bei Ansprache der Gaswarneinrichtung. Meist ist der Lüftungsauslass an ein Lüftungssystem angebunden, damit die Gase nicht in die Produktionsumgebung entweichen. | |||
Mit dieser speziellen Ausstattung des Schwefeldioxid-Schranks werden Beschäftigte sicher vor der Gefahr zu hoher Schwefeldioxid-Konzentration in Atemluft sowie vor Verätzungen bei Unfällen geschützt.<ref name=":0" /> | |||
== Einsatz in Konzentrationslagern == | |||
Bei Experimenten mit [[Giftgas]]en, die im kroatischen [[KZ Stara Gradiška]] durchgeführt wurden, wurde neben [[Zyklon B]] auch Schwefeldioxid an serbischen, jüdischen und Roma-Frauen sowie Kindern eingesetzt.<ref>Michele Frucht Levy: ''„The Last Bullet for the Last Serb“ - The Ustasa Genocide against Serbs 1941–1945.'' In: David M. Crowe (Hrsg.): ''Crimes of State Past and Present.'' Routledge, 2011, ISBN 978-0-415-57788-5, S. 71. ({{Google Buch |BuchID=GRTdAAAAQBAJ |Seite=71}})</ref> | |||
== Umweltverschmutzung == | == Umweltverschmutzung == | ||
[[Datei:UBA Schwefeldioxid Emissionen in Deutschland seit 1990.png|mini|Drastische Emissionsreduktion seit 1990 in Deutschland]] | |||
Schwefeldioxid schädigt in hohen Konzentrationen Mensch, Tiere und Pflanzen. Die Oxidationsprodukte führen zu „Saurem Regen“, der empfindliche Ökosysteme wie Wald und Seen gefährdet, Gebäude und Materialien angreift. Die SO<sub>2</sub>-Emissionen der entwickelten Industriestaaten konnten jedoch in den letzten zwei Jahrzehnten durch die Nutzung schwefelarmer bzw. schwefelfreier Brenn- und Kraftstoffe und mittels [[Rauchgasentschwefelung]] stark reduziert werden. | |||
Schwefeldioxid schädigt in hohen Konzentrationen Mensch, Tiere und Pflanzen. Die Oxidationsprodukte führen zu „[[Saurer Regen|saurem Regen]]“, der empfindliche Ökosysteme wie Wald und Seen gefährdet sowie Gebäude und Materialien angreift. Dazu zählt auch die Schwächung von [[Forstpflanze]]n, die nach außerordentlichen Wintern stärkere Frostschäden erleiden als vergleichbare Pflanzen in weniger belasteten Gebieten.<ref>Theodor Keller: ''Frostschäden als Folge einer latenten Immissionsschädigung.'' In: ''[[Gefahrstoffe – Reinhaltung der Luft|Staub – Reinhalt. Luft]].'' 38, Nr. 1, 1978, S. 24–26.</ref> Die SO<sub>2</sub>-[[Emission (Umwelt)|Emissionen]] der entwickelten Industriestaaten konnten jedoch in den letzten zwei Jahrzehnten durch die Nutzung schwefelarmer bzw. schwefelfreier Brenn- und Kraftstoffe und mittels [[Rauchgasentschwefelung]] stark reduziert werden. | |||
Von allen [[Verkehrsträger]]n leistet der internationale Schifffahrtsverkehr den höchsten Emissionsbeitrag. Dort liegt der maximal zulässige Schwefelgehalt im Brennstoff | Von allen [[Verkehrsträger]]n leistet der internationale Schifffahrtsverkehr den höchsten Emissionsbeitrag. Dort liegt der von der [[Internationale Seeschifffahrts-Organisation|IMO]] festgelegte maximal zulässige Schwefelgehalt im Brennstoff für Schiffe seit dem 1. Januar 2020 bei 0,5 Prozent. Dabei kann der Grenzwert jedoch auch durch den Einsatz von [[Abgasentschwefelung in der Seeschifffahrt|Scrubbern]] zur Abgasnachbehandlung eingehalten werden.<ref>{{Internetquelle|url=https://www.umweltbundesamt.de/themen/neuer-schwefelgrenzwert-fuer-seeschiffskraftstoffe|titel=Neuer Schwefelgrenzwert für Seeschiffskraftstoffe|werk=Umweltbundesamt.de|datum=2020-01-15|abruf=2021-06-20}}</ref> Diese Grenze gilt auch für kalifornische Küstengewässer.<ref>wiwo.de: {{Webarchiv |url=http://www.wiwo.de/technik/neuer-antrieb-fuer-schiffe-225810/ |text=Neuer Antrieb für Schiffe |wayback=20080321075018}}.</ref> In der Ost- und Nordsee gibt es [[Schwefelemissions-Überwachungsgebiet]]e (engl. [[Sulphur Emission Control Area|SECA]]), in denen der Grenzwert seit dem 1. Januar 2015 0,1 Prozent beträgt. Außerhalb dieser Gebiete muss ein Grenzwert von 0,5 Prozent eingehalten werden, wobei auch hier der Einsatz von Scrubbern zulässig ist, um die Emissionen entsprechend zu verringern.<ref>{{Internetquelle|url=https://www.bsh.de/DE/THEMEN/Schifffahrt/Umwelt_und_Schifffahrt/Schiffsemissionen/schiffsemissionen_node.html|titel=Schiffsemissionen|werk=bsh.de|abruf=2021-06-20}}</ref> | ||
[[Datei:Physical Drivers of climate change-de.svg|thumb|Physikalische Antriebe des Klimawandels; der kühlende Effekt von Schwefeldioxid ist der stärkste aller bekannten kühlenden Antriebe]] | |||
2019 wurde eine Studie von [[Transport and Environment]] veröffentlicht, welche zeigt, dass allein die Kreuzfahrtschiffe von [[Carnival Corporation & plc|Carnival]] im Jahr 2017 etwa zehnmal so viele [[Schwefeloxid]]e entlang Europas Küsten [[Emission (Umwelt)|ausgestoßen]] haben wie alle [[Personenkraftwagen]] (über 260 Millionen) in Europa zusammen.<ref>{{Internetquelle |url=https://www.transportenvironment.org/publications/one-corporation-pollute-them-all |titel=One corporation to pollute them all |werk=transportenvironment.org |datum=2019-06-04 |sprache=en |abruf=2019-06-16}}</ref><ref>{{Internetquelle |url=https://www.nabu.de/news/2019/06/26502.html |titel=Massive Abgasbelastung in Häfen durch Kreuzfahrtschiffe |werk=[[Naturschutzbund Deutschland|nabu.de]] |datum=2019-06-05 |abruf=2019-06-16}}</ref> Das [[Max-Planck-Institut für Meteorologie]] konnte im Rahmen einer Studie zeigen, dass in der Umgebung der stark frequentierten Seehäfen [[Rotterdam]], [[Antwerpen]] und [[Milford Haven]] eine erheblich dichtere [[Wolkendecke]] herrscht als im Umland. Schwefeldioxid und Stickoxide wirken als [[Kondensationskeim]]e und regen die Wolkenbildung an. Die durch diese Wolkendecke verstärkte [[Albedo]] führte zu einer Verringerung der Sonneneinstrahlung in den darunterliegenden Gebieten.<ref>planet-erde.de: [http://www.planet-erde.de/aktuelles/planeterde-news/dicke-luft-am-meer/ ''Dicke Luft am Meer'']</ref> | |||
Auch global kann Schwefeldioxid durch Erhöhung des Aerosolgehalts zur [[Trübung der Atmosphäre]] beitragen, etwa nach starken [[Vulkanausbruch|Vulkanausbrüchen]] und damit zur Kühlung des Planeten führen. | |||
Das [[Max-Planck-Institut für Meteorologie]] konnte im Rahmen einer Studie zeigen, dass in der Umgebung der stark frequentierten Seehäfen [[Rotterdam]], [[Antwerpen]] und [[Milford Haven]] eine erheblich dichtere Wolkendecke herrscht als im Umland. Schwefeldioxid und Stickoxide wirken als [[Kondensationskeim]]e und regen die Wolkenbildung an. Die durch diese Wolkendecke verstärkte [[Albedo]] führte zu einer Verringerung der Sonneneinstrahlung in den darunterliegenden Gebieten.<ref>Dicke Luft am Meer [http://www.planet-erde.de/aktuelles/planeterde-news/dicke-luft-am-meer/ Online bei www.planet-erde.de]</ref> | |||
== Sicherheitshinweise == | == Sicherheitshinweise == | ||
Eine Schwefeldioxidkonzentration, die über dem [[MAK-Wert]] liegt, kann beim Menschen zu Kopfschmerzen, Übelkeit und Benommenheit führen. In höheren Konzentrationen schädigt das Gas stark die Bronchien und Lungen.<ref>[ | Eine Schwefeldioxidkonzentration, die über dem [[MAK-Wert]] liegt, kann beim Menschen zu Kopfschmerzen, Übelkeit und Benommenheit führen. In höheren Konzentrationen schädigt das Gas stark die Bronchien und Lungen.<ref>zusatzstoffe-online.de: [https://www.zusatzstoffe-online.de/zusatzstoffe/220-schwefeldioxid/ ''Schwefeldioxid E220'']</ref> | ||
Eine Exposition gegenüber hohen Schwefeldioxidkonzentrationen über einen längeren Zeitraum kann durch die Zerstörung des für die [[Blutbildung]] wichtigen B12-Vitamins zu [[Anämie]] führen. | Eine Exposition gegenüber hohen Schwefeldioxidkonzentrationen über einen längeren Zeitraum kann durch die Zerstörung des für die [[Blutbildung]] wichtigen B12-Vitamins zu [[Anämie]] führen. | ||
2021 hat die [[Weltgesundheitsorganisation]] ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Schwefeldioxid liegt bei 40 µg/m<sup>3</sup> im 24-Stunden-Mittel.<ref>WHO: [https://apps.who.int/iris/handle/10665/345329 WHO global air quality guidelines: particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide.]</ref> | |||
== Einzelnachweise == | |||
<references /> | |||
== Weblinks == | == Weblinks == | ||
{{Commonscat|Sulfur dioxide|Schwefeldioxid}} | {{Commonscat|Sulfur dioxide|Schwefeldioxid}} | ||
{{Wiktionary}} | |||
* [https://earth.nullschool.net/#current/chem/surface/level/overlay=so2smass/winkel3/loc=9.3,50.1/ Globale Karte der aktuellen Schwefeldioxidverteilung]. | |||
== Einzelnachweise == | |||
[[Kategorie:Schwefelverbindung]] | |||
<references /> | |||
[[Kategorie:Sauerstoffverbindung]] | |||
{{Normdaten|TYP=s|GND=4180392-9}} | |||
[[Kategorie:Schwefeloxid]] | |||
[[Kategorie:Lebensmittelkonservierungsstoff]] | [[Kategorie:Lebensmittelkonservierungsstoff]] | ||
[[Kategorie:Antioxidationsmittel]] | [[Kategorie:Antioxidationsmittel]] | ||
[[Kategorie:Lebensmittelzusatzstoff (EU)]] | |||
[[als:Schwefeldioxid]] | |||
[[ar:ثنائي أكسيد الكبريت]] | |||
[[bg:Серен диоксид]] | |||
[[bs:Sumpor dioksid]] | |||
[[ca:Diòxid de sofre]] | |||
[[cs:Oxid siřičitý]] | |||
[[cy:Sylffwr deuocsid]] | |||
[[da:Svovldioxid]] | |||
[[el:Διοξείδιο του θείου]] | |||
[[en:Sulfur dioxide]] | |||
[[eo:Sulfura dioksido]] | |||
[[es:Dióxido de azufre]] | |||
[[et:Vääveldioksiid]] | |||
[[fa:گوگرد دیاکسید]] | |||
[[fi:Rikkidioksidi]] | |||
[[fr:Dioxyde de soufre]] | |||
[[he:גופרית דו-חמצנית]] | |||
[[hi:सल्फर डाइआक्साइड]] | |||
[[hr:Sumporov dioksid]] | |||
[[hu:Kén-dioxid]] | |||
[[is:Brennisteinsoxíð]] | |||
[[it:Anidride solforosa]] | |||
[[ja:二酸化硫黄]] | |||
[[kk:Күкірт диоксиді]] | |||
[[ko:이산화 황]] | |||
[[lt:Sieros dioksidas]] | |||
[[lv:Sēra dioksīds]] | |||
[[mk:Сулфур диоксид]] | |||
[[ml:സൾഫർ ഡയോക്സൈഡ്]] | |||
[[mr:सल्फर डायॉक्साईड]] | |||
[[ms:Sulfur dioksida]] | |||
[[nl:Zwaveldioxide]] | |||
[[nn:Svoveldioksid]] | |||
[[no:Svoveldioksid]] | |||
[[pl:Dwutlenek siarki]] | |||
[[pt:Dióxido de enxofre]] | |||
[[ro:Dioxid de sulf]] | |||
[[ru:Оксид серы(IV)]] | |||
[[sh:Sumpor dioksid]] | |||
[[simple:Sulfur dioxide]] | |||
[[sk:Oxid siričitý]] | |||
[[sl:Žveplov dioksid]] | |||
[[sr:Сумпор-диоксид]] | |||
[[su:Walirang dioksida]] | |||
[[sv:Svaveldioxid]] | |||
[[th:ซัลเฟอร์ไดออกไซด์]] | |||
[[tr:Kükürt dioksit]] | |||
[[uk:Діоксид сірки]] | |||
[[ur:Sulfur dioxide]] | |||
[[vi:Lưu huỳnh điôxit]] | |||
[[zh:二氧化硫]] | |||
Aktuelle Version vom 17. Juni 2024, 18:11 Uhr
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
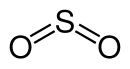 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Schwefeldioxid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | SO2 | |||||||||||||||
| Kurzbeschreibung | farbloses, stechend riechendes, giftiges Gas[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 64,06 g·mol−1 | |||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | −10,05 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex | 1,000686 (0 °C, 101,325 kPa)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Schwefeldioxid, SO2, ist das Anhydrid der Schwefligen Säure H2SO3. Schwefeldioxid ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut (physikalisch) wasserlöslich und bildet mit Wasser in sehr geringem Maße Schweflige Säure. Es entsteht unter anderem bei der Verbrennung von schwefelhaltigen fossilen Brennstoffen wie Kohle oder Erdölprodukten, die bis zu 4 Prozent Schwefel enthalten. Auch Biomasse enthält je nach Herkunft teils erhebliche Mengen Schwefel, da dieser ein Mengenelement in allen bekannten Lebewesen ist, wodurch bei Verbrennung ebenfalls Schwefeldioxid entsteht. Dadurch trägt es in erheblichem Maß zur Luftverschmutzung bei. Es ist der Grund für sauren Regen, wobei das Schwefeldioxid zunächst von Sauerstoff zu Schwefeltrioxid oxidiert wird und dann mit Wasser zu Schwefelsäure (H2SO4) umgesetzt wird.[9] Um den Eintrag von Schwefeldioxid zu verhindern, gibt es verschiedene Verfahren zur Rauchgasentschwefelung. Zudem findet sich Schwefeldioxid im Umfeld von Hochtemperaturgebieten und aktiven Vulkanen.[10] In den meisten Industrieländern werden Erdöl und Erdgas und daraus entstehende Produkte bereits vor der Verbrennung – zumeist mittels Hydrodesulfurierung – entschwefelt. Auch Biogas wird gemeinhin bei der Biogasaufbereitung vom enthaltenen Schwefelwasserstoff befreit, um ein ungiftigeres und sichereres Produkt zu erhalten. Die Kosten entsprechender Verfahren können – anders als der relativ preisgünstige REA-Gips, welcher kaum die Kosten der Rauchgasentschwefelung deckt – zumeist zu großen Teilen oder gänzlich durch Verwendung der anfallenden Schwefelmengen in der chemischen Industrie gedeckt werden.
Herstellung
Schwefeldioxid kann durch verschiedene Verfahren hergestellt werden:
- durch Verbrennen von Schwefel oder Schwefelwasserstoff
- aus Sulfiten durch stärkere Säuren
- aus Kaliumdisulfit unter sauren Bedingungen:
Eigenschaften
Physikalische Eigenschaften
Schwefeldioxid hat eine relative Gasdichte von 2,26 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine Dichte der flüssigen Phase am Siedepunkt von 1,458 kg/l. Die Gasdichte unter Normalbedingungen (0 °C, 1013 mbar) beträgt 2,9285 kg·m−3, bei einer Temperatur von 15 °C und einem Druck von 1 bar hingegen 2,728 kg·m−3. Die kritische Temperatur liegt bei 157,5 °C, der kritische Druck bei 78,8 bar und die kritische Dichte erhält den Wert 0,525 g·cm−3. Am Tripelpunkt liegt eine Temperatur von −75,5 °C und ein Druck von 16,7 mbar (12,56 Torr) vor.[11]
Chemische Eigenschaften
Schwefeldioxid ist ein farbloses, stechend riechendes und korrodierendes Gas. Es löst sich gut in Wasser, wobei eine schwach saure Lösung entsteht. Des Weiteren wirkt Schwefeldioxid als Reduktionsmittel.[12]
Das Schwefeldioxid-Molekül kann durch zwei mesomere Grenzstrukturen beschrieben werden:
Hierbei werden die beiden σ-Bindungen (zwei S–O-Bindungen) und das freie Elektronenpaar am S-Atom von dem s- und den zwei p-Orbitalen des S-Atoms gebildet. Die π-Bindung ist über das gesamte Molekül delokalisiert (Mehrzentren-π-Bindung).[12]
Molekülgeometrie
Gemäß dem VSEPR-Modell ist das Schwefeldioxid-Molekül gewinkelt gebaut. Daraus resultiert ein Bindungswinkel (O–S–O) von 119,5°. Die beiden S–O-Bindungen sind mit einer Bindungslänge von 143 pm gleich lang und damit sehr kurz.[12]
Schwefeldioxid besitzt als Molekülsymmetrie die Punktgruppe C2v.[13]
Verwendung
Flüssiges Schwefeldioxid löst zahlreiche Stoffe und hat sich daher als wertvolles aprotisch-polares Lösungsmittel etabliert.
In der Lebensmittelindustrie findet Schwefeldioxid als Konservierungs-, Antioxidations- und Desinfektionsmittel Verwendung, vor allem für Trockenfrüchte, Kartoffelgerichte, Fruchtsäfte, Marmelade und Wein. Wein- und Bierfässer werden zur Desinfizierung vor der Verwendung durch Behandlung mit SO2-Gas ausgeschwefelt.[14]
Schwefeldioxid zerstört das Vitamin B1; ebenso finden sich in Laborversuchen Hinweise auf eine Zerstörung von B12-Vitaminen.[15] In der EU ist es als Lebensmittelzusatzstoff der Nummer E 220 auch für Bio-Produkte zugelassen. Es dient auch zur Herstellung von Sulfurylchlorid SO2Cl2 und Thionylchlorid SOCl2. In der Sulfochlorierung dient es zur Herstellung von Tensiden.
Ferner ist Schwefeldioxid ein wichtiges Edukt zur Herstellung von Schwefeltrioxid, um anschließend konzentrierte Schwefelsäure z. B. mit dem Kontaktverfahren herzustellen.
Schwefeldioxid dient auch zur Herstellung von vielen Chemikalien, Medikamenten und Farbstoffen und zum Bleichen von Papier und Textilien. Es lässt Tinte verblassen.
Außerdem wird es als Schutzgas[16] verwendet, etwa um flüssige Metallschmelzen in der Gießerei an der Oxidation zu hindern.
Aufbewahrung
Schwefeldioxid wird in der Industrie meist aus Druckgasflaschen bezogen und wird häufig zur Temperierung in der Produktionsumgebung, also in Innenräumen aufbewahrt, oft auch direkt neben Thermoprozessanlagen.[17] Im Rahmen der Gefährdungsbeurteilung ist für die Aufbewahrung von Schwefeldioxid gemäß § 5 Arbeitsschutzgesetz und § 6 GefStoffV zu ermitteln, ob sich durch die Lagerung von Gefahrstoffen Gefährdungen für die Beschäftigten oder andere Personen ergeben können.
Für die Aufbewahrung von Schwefeldioxid gelten (in Deutschland) insbesondere folgende Vorschriften:
- TRGS 510 Lagerung von Gefahrstoffen in ortsbeweglichen Behältern
- TRBS 3145 / TRGS 745 Ortsbewegliche Druckgasbehälter – Füllen, Bereitstellen, innerbetriebliche Beförderung, Entleeren
- TRBS 3146 / TRGS 726 Ortsfeste Druckanlagen für Gase
Zum Gesundheitsschutz der Mitarbeiter und um den Anforderungen des Arbeitsschutzgesetzes zu entsprechen, sind Schwefeldioxid -Flaschen daher in einer geeigneten Aufbewahrungseinrichtung aufzubewahren. Geeignet dafür ist der entsprechend ausgestattete Sicherheitsgasflaschenschrank, dessen besondere Ausstattung für die Schwefeldioxid-Aufbewahrung aus folgenden wesentlichen Komponenten besteht:
- Der Sicherheitsschrank an sich, für eine oder mehrere Schwefeldioxid-Flasche(n) und eine Stickstoffgas-Flasche. Dabei sind oft zwei Flaschen Schwefeldioxid für den Betrieb und die automatische Umschaltung vorgesehen. Eine Flasche steht im Schrank zum Vortemperieren, aus der zweiten Flasche wird das Gas zur Verwendung entnommen. Die Stickstoffgas-Flasche dient der Versorgung der Spüleinrichtung für den sicheren Flaschenwechsel. Der Sicherheitsschrank wird als feuerhemmender Schrank ausgeführt, da das unter Druck stehende Gas bei Erwärmung explodieren kann und dann schwere Verätzungen der Haut und schwere Augenschäden verursacht. Der Schrank sollte abschließbar sein, da das Sicherheitsdatenblatt für Schwefeldioxid „P405 - Unter Verschluss aufbewahren“ vorgibt.
- Schwefeldioxid -Druckregelstation aus Edelstahl mit automatischer Umschaltung, zur unterbrechungsfreien Medienversorgung. Die Schwefeldioxid -Gasflaschen werden mit Edelstahlwellschlauch angeschlossen. Die verwendeten Armaturen müssen aus Edelstahl sein, da Schwefeldioxid mit Luftfeuchtigkeit zu Schwefelsäure (H2SO4) umgesetzt wird.
- Ein automatisches Absperrmagnetventil ermöglicht die Absperrung der Schwefeldioxid -Prozessleitung zur Verwendungsstelle bei Not-Aus-Betätigung oder bei Gas-Alarm.
- Der Gaswarnsensor im Sicherheitsschrank, ggfs. mit zusätzlichen weiteren Gaswarnsensoren in der Nähe der Verwendungsstellen, erzeugt den Gas-Alarm mit optischem und akustischem Signal.
- Fremdbelüftung mit Ventilator zur manuellen Betätigung durch den Benutzer und automatischen Auslösung bei Ansprache der Gaswarneinrichtung. Meist ist der Lüftungsauslass an ein Lüftungssystem angebunden, damit die Gase nicht in die Produktionsumgebung entweichen.
Mit dieser speziellen Ausstattung des Schwefeldioxid-Schranks werden Beschäftigte sicher vor der Gefahr zu hoher Schwefeldioxid-Konzentration in Atemluft sowie vor Verätzungen bei Unfällen geschützt.[17]
Einsatz in Konzentrationslagern
Bei Experimenten mit Giftgasen, die im kroatischen KZ Stara Gradiška durchgeführt wurden, wurde neben Zyklon B auch Schwefeldioxid an serbischen, jüdischen und Roma-Frauen sowie Kindern eingesetzt.[18]
Umweltverschmutzung
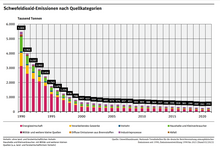
Schwefeldioxid schädigt in hohen Konzentrationen Mensch, Tiere und Pflanzen. Die Oxidationsprodukte führen zu „saurem Regen“, der empfindliche Ökosysteme wie Wald und Seen gefährdet sowie Gebäude und Materialien angreift. Dazu zählt auch die Schwächung von Forstpflanzen, die nach außerordentlichen Wintern stärkere Frostschäden erleiden als vergleichbare Pflanzen in weniger belasteten Gebieten.[19] Die SO2-Emissionen der entwickelten Industriestaaten konnten jedoch in den letzten zwei Jahrzehnten durch die Nutzung schwefelarmer bzw. schwefelfreier Brenn- und Kraftstoffe und mittels Rauchgasentschwefelung stark reduziert werden.
Von allen Verkehrsträgern leistet der internationale Schifffahrtsverkehr den höchsten Emissionsbeitrag. Dort liegt der von der IMO festgelegte maximal zulässige Schwefelgehalt im Brennstoff für Schiffe seit dem 1. Januar 2020 bei 0,5 Prozent. Dabei kann der Grenzwert jedoch auch durch den Einsatz von Scrubbern zur Abgasnachbehandlung eingehalten werden.[20] Diese Grenze gilt auch für kalifornische Küstengewässer.[21] In der Ost- und Nordsee gibt es Schwefelemissions-Überwachungsgebiete (engl. SECA), in denen der Grenzwert seit dem 1. Januar 2015 0,1 Prozent beträgt. Außerhalb dieser Gebiete muss ein Grenzwert von 0,5 Prozent eingehalten werden, wobei auch hier der Einsatz von Scrubbern zulässig ist, um die Emissionen entsprechend zu verringern.[22]

2019 wurde eine Studie von Transport and Environment veröffentlicht, welche zeigt, dass allein die Kreuzfahrtschiffe von Carnival im Jahr 2017 etwa zehnmal so viele Schwefeloxide entlang Europas Küsten ausgestoßen haben wie alle Personenkraftwagen (über 260 Millionen) in Europa zusammen.[23][24] Das Max-Planck-Institut für Meteorologie konnte im Rahmen einer Studie zeigen, dass in der Umgebung der stark frequentierten Seehäfen Rotterdam, Antwerpen und Milford Haven eine erheblich dichtere Wolkendecke herrscht als im Umland. Schwefeldioxid und Stickoxide wirken als Kondensationskeime und regen die Wolkenbildung an. Die durch diese Wolkendecke verstärkte Albedo führte zu einer Verringerung der Sonneneinstrahlung in den darunterliegenden Gebieten.[25]
Auch global kann Schwefeldioxid durch Erhöhung des Aerosolgehalts zur Trübung der Atmosphäre beitragen, etwa nach starken Vulkanausbrüchen und damit zur Kühlung des Planeten führen.
Sicherheitshinweise
Eine Schwefeldioxidkonzentration, die über dem MAK-Wert liegt, kann beim Menschen zu Kopfschmerzen, Übelkeit und Benommenheit führen. In höheren Konzentrationen schädigt das Gas stark die Bronchien und Lungen.[26]
Eine Exposition gegenüber hohen Schwefeldioxidkonzentrationen über einen längeren Zeitraum kann durch die Zerstörung des für die Blutbildung wichtigen B12-Vitamins zu Anämie führen.
2021 hat die Weltgesundheitsorganisation ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Schwefeldioxid liegt bei 40 µg/m3 im 24-Stunden-Mittel.[27]
Weblinks
Einzelnachweise
- ↑ Eintrag zu E 220: Sulphur dioxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ a b c d e f Eintrag zu Schwefeldioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Sicherheitsdatenblatt. 21. Dezember 2021, abgerufen am 28. März 2023.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Gases, S. 10-254.
- ↑ Eintrag zu Sulphur dioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7446-09-5 bzw. Schwefeldioxid), abgerufen am 16. Mai 2020.
- ↑ Eintrag zu Sulfur dioxide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ H. U. Schmincke: Vulkanismus. Wiss. Buchgesellschaft, Darmstadt 2000, S. 224 ff.
- ↑ Giauque, W.F.; Stephenson, C.C.: Sulfur Dioxide. The Heat Capacity of Solid and Liquid. Vapor Pressure. Heat of Vaporization. The Entropy Values from Thermal and Molecular Data. In: Journal of the American Chemical Society. Band 60, Nr. 6, 1938, S. 1389–1394, doi:10.1021/ja01273a034.
- ↑ a b c Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 470.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 238.
- ↑ SCHWEFELDIOXID FLÜSSIG. Grillo-Werke AG, abgerufen am 9. November 2018.
- ↑ H.-D. Belitz, W. Grosch: Food Chemistry. Springer Verlag, Berlin/ Heidelberg 1999.
- ↑ Matthias Bünck: Gießeigenschaften. In: Andreas Bührig-Polaczek, Walter Michaeli, Günter Spur (Hrsg.): Handbuch Spanen. Hanser, München 2014, S. 36.
- ↑ a b SO2 Schrank zum Gesundheitsschutz. In: LT Gasetechnik. 26. Oktober 2016 (lt-gasetechnik.de [abgerufen am 12. April 2017]).
- ↑ Michele Frucht Levy: „The Last Bullet for the Last Serb“ - The Ustasa Genocide against Serbs 1941–1945. In: David M. Crowe (Hrsg.): Crimes of State Past and Present. Routledge, 2011, ISBN 978-0-415-57788-5, S. 71. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Theodor Keller: Frostschäden als Folge einer latenten Immissionsschädigung. In: Staub – Reinhalt. Luft. 38, Nr. 1, 1978, S. 24–26.
- ↑ Neuer Schwefelgrenzwert für Seeschiffskraftstoffe. In: Umweltbundesamt.de. 15. Januar 2020, abgerufen am 20. Juni 2021.
- ↑ wiwo.de: Neuer Antrieb für Schiffe ( vom 21. März 2008 im Internet Archive).
- ↑ Schiffsemissionen. In: bsh.de. Abgerufen am 20. Juni 2021.
- ↑ One corporation to pollute them all. In: transportenvironment.org. 4. Juni 2019, abgerufen am 16. Juni 2019 (englisch).
- ↑ Massive Abgasbelastung in Häfen durch Kreuzfahrtschiffe. In: nabu.de. 5. Juni 2019, abgerufen am 16. Juni 2019.
- ↑ planet-erde.de: Dicke Luft am Meer
- ↑ zusatzstoffe-online.de: Schwefeldioxid E220
- ↑ WHO: WHO global air quality guidelines: particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide.













