Azobenzol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
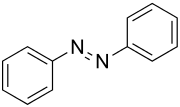
| |||||||||||||||||||
| Strukturformel von (E)-Azobenzol | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Azobenzol | ||||||||||||||||||
| Andere Namen |
Diphenyldiazen (IUPAC) | ||||||||||||||||||
| Summenformel | C12H10N2 | ||||||||||||||||||
| Kurzbeschreibung |
orangerote Blättchen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
293 °C [(E)-Azobenzol, unzersetzt][1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Azobenzol ist die einfachste aromatische Azoverbindung. Sie besteht aus zwei Phenylgruppen, die durch eine Azobrücke (–N=N–) miteinander verbunden sind. Sie ist die Stammsubstanz zahlreicher Azofarbstoffe.
Geschichte
Bereits sechs Jahre nach dem allgemein anerkannten Beginn der „organischen Synthese“ (F. Wöhler, Harnstoff aus Ammoniumcyanat) und 22 Jahre vor W. H. Perkin (Mauvein) berichtet E. Mitscherlich[4][5] über eine rote Verbindung, die er durch Destillation von Nitrobenzol mit Kalilauge erhielt. Er nannte sie Azobenzol.
Lange Zeit wusste man nichts über die Konstitution dieser Verbindung. Mitscherlich selbst schlug als Summenformel C12H5N vor.[6] Aufgrund von Dampfdichtemessungen kamen andere Autoren zur Summenformel C24H10N2.[7][8] Erst im Jahre 1860 wurde die richtige Summenformel postuliert.[9] F. A. Kekulé machte 1866 schließlich den ersten korrekten Strukturvorschlag.[10]
Ungeklärt blieb die Frage der Konfiguration der N=N-Doppelbindung. Für analoge Verbindungen (Diazohydroxide) schlug A. Hantzsch 1921 eine Isomerie vor, damals „syn-/anti-Isomerie“ genannt.[11] Die IUPAC empfiehlt heute die Verwendung der (E/Z)-Nomenklatur.
Isomere
1937 fand S. Hartley durch Belichten von Azobenzol eine zweite, gelbe Modifikation.[12] Das gelbe Isomer konnte er chromatographisch abtrennen. Die genaue Konfiguration der beiden Isomere wurde 1939 durch eine Röntgenstrukturanalyse bewiesen.[13] Azobenzol existiert demnach in Form von zwei Isomeren (siehe cis-trans-Isomerie), die sich in Farbe, Löslichkeit, im chromatographischen Verhalten usw. unterscheiden.[14]
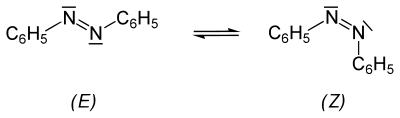
Bei der Bestrahlung einer Lösung von (E)-Azobenzol mit UV-Licht geht dieses in einer Gleichgewichtsreaktion teilweise in die (Z)-Form über, in Abhängigkeit vom Lösungsmittel entstehen dabei 15–40 % (Z)-Azobenzol. Reines (Z)-Azobenzol wandelt sich langsam thermisch im Feststoff[15] bzw. in der Schmelze[15][16] in das stabilere (E)-Isomer um. Die Reaktionsenthalpie der Isomerisierung in der Schmelze beträgt −48,2 kJ·mol−1 bzw. −264,5 J·g−1.[16]
Das stabilere, normalerweise vorliegende (E)-Azobenzol hat kein Dipolmoment (µ = 0 D), im Gegensatz zum metastabilen (Z)-Azobenzol (µ = 3 D).[17]
Darstellung und Gewinnung
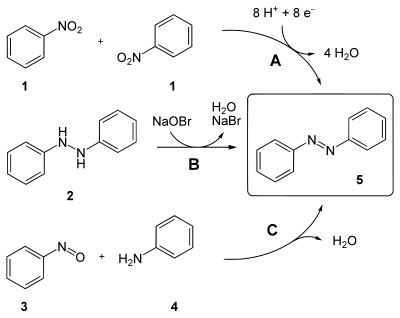
Azobenzol (5) lässt sich auf folgende Arten herstellen (vergleiche auch unteres Bild):
- durch Reduktion von Nitrobenzol (1) mit Natriumamalgam oder Lithiumaluminiumhydrid (Weg A)
- durch Oxidation von Hydrazobenzol (2) mit Natriumhypobromitlösung (Weg B)
- durch Kondensation von Nitrosobenzol (3) mit Anilin (4) in essigsaurer Lösung (Baeyer-Mills-Reaktion, besonders zur Herstellung von asymmetrischen Derivaten) (Weg C)
Verwendung
(E)-Azobenzol findet als Testsubstanz für das Kofler-Heiztischmikroskop bzw. als Kalibriersubstanz für die Kofler-Heizbank Verwendung.[18] Aufgrund der chromophoren Gruppen werden Azobenzole mit funktionellen Gruppen an den Benzol-Ringen auch in Form von Azofarbstoffen in der Färbemittelproduktion oder als Lebensmittelfarbe verwendet.[19] Des Weiteren können durch die Verwendung von pH-sensitiven funktionellen Gruppen an den Benzol-Ringen die Azobenzole als Indikator (Chemie) verwendet werden (z. B. Methylrot, Methylorange, Alizaringelb R, oder Kongorot).[20]
Literatur
- H. Zollinger: Chemie der Azofarbstoffe. (Chemische Reihe, Bd. 13). Birkhäuser-Verlag, Basel, 1958.
- E. Merino: Synthesis of azobenzenes: the coloured pieces of molecular materials. Chem.Soc. Rev., 2011, 40, S. 3835–3853, doi:10.1039/c0cs00183j
Einzelnachweise
- ↑ a b c d e Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, Hirzel, Stuttgart 1984. S. 529.
- ↑ a b c d Eintrag zu Azobenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Azobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ E. Mitscherlich: Annalen der Physik und Chemie XXXII (1834), S. 224.
- ↑ E. Mitscherlich: Annalen der Chemie und Pharmacie XII, S. 311.
- ↑ Otto Linné Erdmann: Journal für praktische Chemie. Band 82. Verlag von Johann Ambrosius Barth, 1861, S. 444 (Online lesen in der Google-Buchsuche).
- ↑ P. Hofmann: Annalen der Chemie und Pharmacie CXV. S. 362.
- ↑ Peter Griefs: Zur Kenntnifs des s. g. Azobenzols und verwandter Verbindungen. In: Justus Liebig, Freiherr von (Hrsg.): Annalen der Chemie und Pharmacie. Bände 131–132. C.F. Winter'sche, 1864 (Online lesen in der Google-Buchsuche).
- ↑ P. Hofmann: Annalen der Chemie und Pharmacie (1860), S. 324.
- ↑ Carl Glaser: Ueber eine neue Bildungsweise des Azobenzols. In: Zeitschrift für Chemie. 1866 (Online lesen in der Google-Buchsuche).
- ↑ A. Hantzsch, G. Reddelien: Die Diazoverbindungen. Springer, Berlin, 1921.
- ↑ G. S. Hartley: Nature 140 (1937). S. 281.
- ↑ Robertson, J.M.: Crystal structure and configuration of the isomeric azobenzenes in J. Chem. Soc. 1939, S. 232–236, doi:10.1039/JR9390000232.
- ↑ Cook, A.H.: The preparation of some cis-azo-compounds in J. Chem. Soc. 1938, S. 876–881, doi:10.1039/JR9380000876.
- ↑ a b Wolf, E.; Cammenga, H.K.: Thermodynamic and Kinetic Investigation of the Thermal Isomerization of Cis-azobenzene in Z. Phys. Chem. 107 (1977) S. 21–38, doi:10.1524/zpch.1977.107.1.021.
- ↑ a b Eckardt, N.; Flammersheim, H.J.; Cammenga, H.K.: The cis-trans isomerization of azobenzene in the molten state in J. Therm. Anal. Calorim. 52 (1998), S. 177–185, doi:10.1023/A:1010178610642.
- ↑ R. J. W. Le Fevre, G. S. Hartley: The dipole moments of cis- and trans-azobenzenes and of some related compounds in J. Chem. Soc. 1939, S. 531–535, doi:10.1039/JR9390000531.
- ↑ M. Kuhnert-Brandstätter: Thermomicroscopy in the Analysis of Pharmaceuticals, Pergamon Press, Oxford (1971).
- ↑ Karl Hunger: Industrial Dyes: Chemistry, Properties, Applications. Wiley-VCH, Weinheim 2003, ISBN 978-3-527-30426-4.
- ↑ Ram Wasudeo Sabnis: Handbook of Acid-Base Indicators. Hrsg.: CRC Press. 2007, ISBN 0-8493-8218-1, S. 18.







