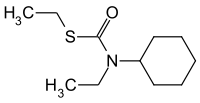
Cycloat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cycloat | ||||||||||||||||||
| Andere Namen | S-Ethyl-N-cyclohexyl-N-ethylthiocarbamat | ||||||||||||||||||
| Summenformel | C11H21NOS | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit aromatischem Geruch.[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 215,36 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[2] | ||||||||||||||||||
| Dichte | 1,016 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | 11,5 °C[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex | 1,5054 (30 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Cycloat ist eine chemische Verbindung aus der Gruppe der Thiocarbamate.
Gewinnung und Darstellung
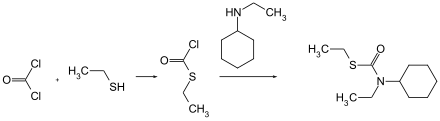
Cycloat kann durch Reaktion von N-Cyclohexyl-N-ethylcarbamoylchlorid mit Ethylmercaptan gewonnen werden.[1]

Alternativ kann es durch die Reaktion von Phosgen mit Ethylmercaptan zu Ethylthiochlorformiat und dessen Reaktion mit N-Ethylcyclohexylamin hergestellt werden.[3]
Eigenschaften
Cycloat ist eine farblose ölige Flüssigkeit mit aromatischem Geruch.[1] Sie ist stabil gegenüber Hydrolyse und Photolyse und wird nach einer Aufnahme bei Säugetieren hauptsächlich als N-Ethylcyclohexylamin als Abbauprodukt über den Urin ausgeschieden.[4] Auch in Pflanzen entsteht diese Verbindung als Abbauprodukt.[5]
Verwendung

Cycloat wird als Herbizid zum Einsatz gegen Gräser und breitblättrige Unkräuter verwendet. Es wurde in den USA erstmals im Juli 1967 (für den Einsatz bei Zuckerrüben und Spinat) zugelassen. Es ist dort nicht für den privaten Einsatz zugelassen. Im Jahr 1999 wurden noch etwa 300 t in den USA eingesetzt, seitdem sank die jährlich eingesetzte Menge stark ab.[1][4]
Zulassung
Cycloat war in der BRD zwischen 1972 und 1994 zugelassen.[6]
Es steht nicht auf der Liste der in der Europäischen Union zulässigen Wirkstoffe von Pflanzenschutzmitteln.[7]
In Deutschland, Österreich und der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[8]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Cycloate in der Hazardous Substances Data Bank (via PubChem), abgerufen am 20. Oktober 2012.
- ↑ a b c d e f g Datenblatt Cycloate, PESTANAL bei Sigma-Aldrich, abgerufen am 16. Oktober 2016 (PDF).
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b EPA: Reregistration Eligibility Decision (RED) for Cycloate (PDF; 415 kB), 30. September 2004.
- ↑ John H. Montgomery: Agrochemicals Desk Reference. CRC Press, 1997, ISBN 1-56670-167-8, S. 117 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Peter Brandt: Berichte zu Pflanzenschutzmitteln 2009: Wirkstoffe in Pflanzenschutzmitteln; Zulassungshistorie und Regelungen der Pflanzenschutz-Anwendungsverordnung. Springer DE, 2010, ISBN 3-0348-0028-2, S. 13 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Verordnung (EG) Nr. 2076/2002 der Kommission vom 20. November 2002 zur Verlängerung der Frist gemäß Artikel 8 Absatz 2 der Richtlinie 91/414/EWG des Rates und über die Nichtaufnahme bestimmter Wirkstoffe in AnhangI dieser Richtlinie sowie den Widerruf der Zulassungen von Pflanzenschutzmitteln mit diesen Wirkstoffen (PDF).
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Cycloate in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 25. Februar 2016.





