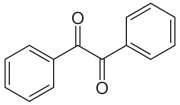
Benzil
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzil | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H10O2 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe Kristalle mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 210,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Benzil ist aromatisch substituierter Vertreter der 1,2-Diketone, die wegen zweier konjugierter Chromophore meist gelb gefärbt sind und somit als eine der einfachsten farbigen Verbindungen gelten.[4]
Gewinnung und Darstellung
Benzil kann durch eine Benzoin-Addition von Benzaldehyd und anschließende Oxidation des Benzoins durch Kupfersulfat gewonnen werden.[2] Eine weitere Herstellvariante ist die Oxidation von Diphenylethin mittels Peroxomonophosphorsäure.[5]

Eigenschaften
Physikalische Eigenschaften

Benzil ist ein kristalliner Feststoff, der in zwei polymorphen Kristallformen auftreten kann. Unterhalb von −189 °C existiert die Kristallform II, oberhalb dieser Temperatur die Kristallform I.[6][7] Die Umwandlungsenthalpie des Festphasenübergangs beträgt 0,0441 kJ·mol−1.[6][7] Die Kristallform I schmilzt bei 95 °C mit einer Schmelzenthalpie von 23,556 kJ·mol−1.[8] Die Verbindung siedet unter einem reduzierten Druck von 16 mbar bei 188 °C.[9] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,79729, B = 2780,085 und C = −39.436 im Temperaturbereich von 401,6 bis 620 K.[10] Die Wärmekapazität des Feststoffes beträgt bei 25 °C 245,7 J·mol−1·K−1 bzw. 1,167 J·g−1·K−1.[6]
Chemische Eigenschaften
Benzil ist Ausgangsstoff für die Benzilsäure-Umlagerung.[2] Eine Reduktion führt unter verschiedenen Versuchsbedingungen zu unterschiedlichen Produkten. Die Reduktion mittels Zinn und Salzsäure führt zum Desoxybenzoin, mittels Zink und Quecksilber zum Stilben. Eine durch Nickel katalysierte Reduktion ergibt 1,2-Diphenylethan.[4]
Verwendung
Benzil wird als Zwischenprodukt bei organischen und pharmazeutischer Synthesen und als Photoinitiator für bestimmte Polymerreaktionen verwendet. Einkristalle der Verbindung werden in der Piezoelektrik und Elektrooptik verwendet.[2]
Sicherheitshinweise
Benzil reizt die Augen, die Haut und die Atemwege. Die Reizung kann bis zur Entzündung führen. Die Dämpfe sind leicht toxisch und sollten nicht eingeatmet werden.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Benzil in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Mai 2024. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu Benzil. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. Mai 2024.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 713.
- ↑ a b S. Hauptmann, J. Graefe, H. Remane: Lehrbuch der organischen Chemie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 347–349.
- ↑ Y. Ogata, Y. Sawaki, T. Ohno: Mechanism for oxidation of phenylacetylenes with peroxymonophosphoric acid. Oxirene as an intermediate inconvertible to ketocarbene. In: J. Am. Chem. Soc. 104, 1982, S. 216–219, doi:10.1021/ja00365a039.
- ↑ a b c A. Dworkin: Heat capacity, phase transition, and thermodynamic properties of benzil. In: J. Chem. Thermodyn. 15, 1983, S. 1029–1035, doi:10.1016/0021-9614(83)90028-9.
- ↑ a b A. Dworkin, A. H. Fuchs: Heat capacity of benzil near its phase transition. In: J. Chem. Phys. 67, 1977, S. 1789–1790, doi:10.1063/1.435050.
- ↑ R. J. L. Andon, J. E. Connett: Calibrants for thermal analysis. Measurement of their enthalpies of fusion by adiabatic calorimetry. In: Thermochim. Acta. 42, 1980, S. 241–247, doi:10.1016/0040-6031(80)87106-1.
- ↑ J. Buckingham, S. M. Donaghy: Dictionary of Organic Compounds. 5. Auflage. Chapman and Hall, New York 1982, 1.
- ↑ D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540, doi:10.1021/ie50448a022.





