Benutzer:Orci/Namensreaktionen/W
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Wacker-Oxidation | |||||
| Jürgen Smidt (Wacker-Chemie) | 1959 | Alkene, Sauerstoff, Palladium(II)-chlorid | Oxidation | Aldehyde | [1] |
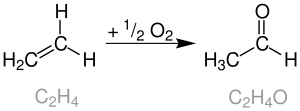 | |||||
| Wagner-Jauregg-Reaktion | |||||
| Theodor Wagner-Jauregg | 1931 | Diarylethene, Maleinsäureanhydrid | doppelte Diels-Alder-Reaktion | Naphthaline | [2] |
 | |||||
| Wagner-Meerwein-Umlagerung | |||||
| Georg Wagner, Hans Meerwein | 1899/1914 | Alkane mit Abgangsgruppe, Säure | intramolekulare [1+2]-Umlagerung am Carbeniumion | stabileres Carbeniumion | [3][4] |
 | |||||
| Walden-Inversion | |||||
| Paul von Walden | 1896 | stereochemische Zentren | Umkehrung der Stereochemie bei nukleophiler Substitution | [5] | |
| Wallach-Umlagerung | |||||
| Otto Wallach | 1880 | Azoxybenzole, Säure | Umlagerung | Hydroxyazabenzole | [6] |
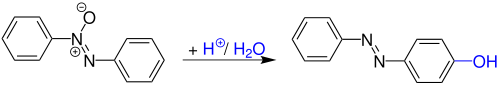 | |||||
| Watanabe-Conlon-Transvinylierung | |||||
| Warren H. Watanabe, Lawrence E. Conlon | 1957 | Alkohole, Ethylvinylether, Quecksilber(II)-acetat | Übertragung der Vinylgruppe auf den Alkohol | Vinylether | [7] |
| Weerman-Abbau | |||||
| Rudolf Adrian Weerman | 1910 | α-Hydroxy-Carbonsäureamide/α,β-ungesättigte Carbonsäureamide, Natriumhypochlorid | Hofmann-Umlagerung | um ein C-Atom verkürzte Aldehyde | [8] |
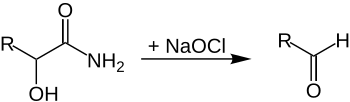 | |||||
| Weidenhagen-Synthese | |||||
| Rudolf Weidenhagen | 1935 | α-Hydroxyketone, Aldehyde, Ammoniak, Kupfer(II)-acetat, Natriumsulfid | Modifikation der Radziszewski-Synthese | Imidazole | [9] |
| Weinreb-Ketonsynthese | |||||
| Steven M. Weinreb | 1981 | Carbonsäurechloride, N,O-Dimethylhydroxylamin, Grignard-Reagenzien/Organolithiumverbindungen | Bildung eines Winreb-Amides, Reduktion | Ketone, Aldehyde | [10] |
| Weiss-Reaktion (Weiss-Cook-Reaktion) | |||||
| Ulrich Weiss | 1968 | 1,2-Dicarbonylverbindungen, 3-Oxoglutarsäurediester | Aldolreaktionen, Michael-Reaktionen | cis-Bicyclo[3.3.0]octan-3,7-dione | [11] |
 | |||||
| Weitz-Scheffer-Epoxidierung | |||||
| Ernst Weitz, Alfred Scheffer | 1921 | elektronenarme Alkene, Wasserstoffperoxid in einer alkalischen Lösung | Oxidation | Epoxide | [12] |
| Wender-Indolsynthese | |||||
| Paul Wender | 1981 | N-Acylanilin, Organolithiumverbindung, α-Halogenketone | ortho-Lithiierung, Cyclisierung, Dehydratisierung | Indole | [13] |
| Wenker-Synthese | |||||
| Henry Wenker | 1935 | β-Aminoalkohole, Schwefelsäure, Natronlauge | Bildung eines Schwefelsäureesters, intramolekularer Ringschluss | Aziridine | [14] |
 | |||||
| Wesseley-Moser-Umlagerung | |||||
| Fritz Wessely, Georg Herbert Moser | 1930 | Flavone/Flavonoide mit ungeschützter Hydroxygruppe in Position 5, Säure | Umlagerung | [15] | |
| Westphalen-Lettré-Umlagerung | |||||
| Theodor Westphalen, Hans Lettré | 1915/1937 | Cholestantriol-diacetat, Säure | Umlagerung einer Methylgruppe mit Abspaltung einer Hydroxygruppe | Bildung einer Doppelbindung | [16][17] |
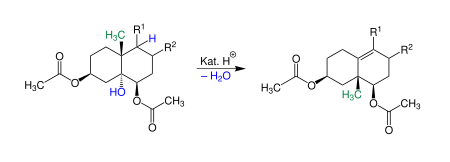 | |||||
| Wharton-Fragmentierung | |||||
| Peter S. Wharton | 1961 | Kohlenstoffketten mit Nukleophilen/Abgangsgruppen, Säure | Fragmentierung in einzelne Moleküle | Alkene, Ketone etc. | [18] |
 | |||||
| Wharton-Olefinsynthese | |||||
| Peter S. Wharton | 1961 | α,β-Epoxyketone, Hydrazin, Essigsäure | Reduktion | Allylalkohole | [19] |
 | |||||
| Whiting-Reaktion | |||||
| M. C. Whiting | 1954 | But-2-in-1,4-diole, Lithiumaluminiumhydrid | Reduktion | Buta-1,3-diene | [20] |
| Wibaut-Arens-Alkylierung | |||||
| J. P. Wibaut, J. F. Arens | 1941 | Pyridin, Essigsäureanhydrid, Zink | Bildung von 4-Acetylpyridin, Reduktion | 4-Ethylpyridin | [21] |
| Wichterle-Reaktion | |||||
| Otto Wichterle | 1948 | Cyclohexanone, 1,3-Dichlor-2-buten, Lithiumdiisopropylamid, Schwefelsäure | Robinson-Anellierung | bicyclische Verbindungen | [22] |
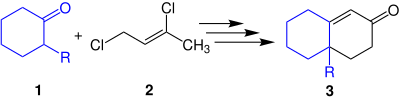 | |||||
| Widman-Stoermer-Synthese | |||||
| Oskar Widman, R. Stoermer | 1884/1909 | diazotierte o-Aminoarylethylene | Cyclisierung | Cinnoline | [23][24] |
| Willgerodt-Kindler-Reaktion | |||||
| Conrad Willgerodt, Karl Kindler | 1887/1923 | Alkylarylketone, Schwefel, Amine | Bildung eines Enamins, Elektrophiler Angriff des Schwefels, Umlagerungen zum Thioamid, Hydrolyse | Arylcarbonsäuren | [25][26] |
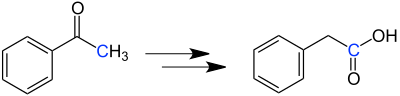 | |||||
| Williamson-Ether-Synthese | |||||
| Alexander William Williamson | 1850 | Alkoholate, Halogenalkylverbindungen | nukleophile Substitution | Ether | [27] |
| Wittig-Horner-Reaktion | |||||
| siehe Horner-Wadsworth-Emmons-Reaktion | |||||
| Wittig-Reaktion | |||||
| Georg Wittig | 1953 | Aldehyde/Ketone, Phosphorylverbindungen | Bildung eines vieratomigen Ringes, Zerfall | Alkene | [28] |
 | |||||
| 1,2-Wittig-Umlagerung | |||||
| Georg Wittig | 1942 | Ether, Alkyllithiumverbindungen | Umlagerung | Alkohole | [29] |
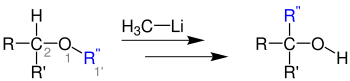 | |||||
| 2,3-Wittig-Umlagerung | |||||
| Georg Wittig | 1949 | Allylether, Base | Umlagerung | Allylalkohole | [30] |
| Wohl-Abbau | |||||
| Alfred Wohl | 1893 | Aldosen, Essigsäureanhydrid, Hydroxylamin, Natriumacetat, Natriummethanolat, Salzsäure | Oximbildung, Acetylierung, Bildung eines Nitrils, Ersetzen des Nitrils durch eine Methoxygruppe, Abspaltung von Essigsäuremethylester unter Aldehydbildung, Desacetylierung | um ein C-Atom verkürzte Aldosen | [31] |
 | |||||
| Wohl-Aue-Reaktion | |||||
| Alfred Wohl, W. Aue | 1901 | aromatische Nitroverbindungen, Aniline, Base | Phenazine | [32] | |
 | |||||
| Wohl-Ziegler-Bromierung | |||||
| Alfred Wohl, Karl Ziegler | 1919/1942 | Alkene, N-Bromsuccinimid, AIBN | radikalische Bromierung | α-Bromalkene | [33][34] |
 | |||||
| Wöhler-Synthese | |||||
| Friedrich Wöhler | 1828 | Cyanate, Ammoniak (oder Ammoniumchlorid) | Bildung von Ammoniumcyanat | Harnstoff | [35] |
| Wolffenstein-Böters-Reaktion | |||||
| Richard Wolffenstein, Oskar Böters | 1906 | Benzol, Quecksilber(II)-nitrat, Salpetersäure | Bildung eines π-Komplexes mit Quecksilber, Addition von Wasser zu Phenol, elektrophile aromatische Nitrierung | Di- und Trinitrophenol | [36] |
 | |||||
| Wolff-Kishner-Reduktion | |||||
| Ludwig Wolff, Nicolai Kishner | 1911/12 | Aldehyde/Ketone, Hydrazin, Base | Reduktion | Alkane | [37][38] |
 | |||||
| Wolff-Umlagerung | |||||
| Ludwig Wolff | 1902 | α-Diazoketone | Stickstoffabspaltung, Umlagerung | Ketene | [39] |
 | |||||
| Woodward-cis-Dihydroxylierung | |||||
| siehe Prévost-Woodward-Hydroxylierung | |||||
| Wurtz-Fittig-Reaktion | |||||
| Adolphe Wurtz, Rudolph Fittig | 1864 | Halogenalkane, Halogenaromaten, Natrium | Kupplung | alkylierte Aromaten | [40] |
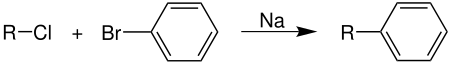 | |||||
| Wurtz-Kupplung | |||||
| Adolphe Wurtz | 1855 | Halogenalkane, Natrium | Kupplung | symmetrische Alkane | [41] |
Quellen
- ↑ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger, H. Kojer: Katalytische Umsetzungen von Olefinen an Platinmetall‐Verbindungen Das Consortium‐Verfahren zur Herstellung von Acetaldehyd. In: Angewandte Chemie. 71, 1959, S. 176-182, doi:10.1002/ange.19590710503.
- ↑ Theodor Wagner-Jauregg: Die Addition von Maleinsäureanhydrid an asymm. Diphenyl-äthylen. In: Justus Liebig's Annalen der Chemie. 491, 1931, S. 1, doi:10.1002/jlac.19314910102.
- ↑ Georg Wagner: J. Russ. Phys. Chem. Soc. 31, 1899, S. 690.
- ↑ Hans Meerwein: Über den Reaktionsmechanismus der Umwandlung von Borneol in Camphen; [Dritte Mitteilung über Pinakolinumlagerungen.]. In: Justus Liebig's Annalen der Chemie. 405, 1914, S. 129, doi:10.1002/jlac.19144050202.
- ↑ P. Walden: Ueber die gegenseitige Umwandlung optischer Antipoden. In: Berichte der deutschen chemischen Gesellschaft. 29, 1896, S. 133, doi:10.1002/cber.18960290127.
- ↑ O. Wallach, L. Belli: Ueber die Umwandlung von Azoxybenzol in Oxyazobenzol. In: Berichte der deutschen chemischen Gesellschaft. 13, 1880, S. 525, doi:10.1002/cber.188001301153.
- ↑ Warren H. Watanabe, Lawrence E. Conlon: Homogeneous Metal Salt Catalysis in Organic Reactions. I. The Preparation of Vinyl Ethers by Vinyl Transetherification. In: Journal of the American Chemical Society. 1957, Band 79, Nummer 11, S. 2828–2833 doi:10.1021/ja01568a044.
- ↑ R. A. Weerman: Sur une synthèse d'aldéhydes et de l'indol. In: Recueil des Travaux Chimiques des Pays-Bas et de la Belgique. 29, 1910, S. 18, doi:10.1002/recl.19100290104.
- ↑ Rudolf Weidenhagen, Roland Herrmann: Eine neue Synthese von Imidazol‐Derivaten. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1935, Band 68, Nummer 10, S. 1953–1961 doi:10.1002/cber.19350681012.
- ↑ Steven Nahm, Steven M. Weinreb: N-methoxy-n-methylamides as effective acylating agents. In: Tetrahedron Letters. 22, 1981, S. 3815, doi:10.1016/s0040-4039(01)91316-4.
- ↑ U. Weiss, J.M. Edwards: A one-step synthesis of ketonic compounds of the pentalane, [3,3,3]- and [4,3,3]-propellane series. In: Tetrahedron Letters. 9, 1968, S. 4885, doi:10.1016/S0040-4039(00)72784-5.
- ↑ Ernst Weitz, Alfred Scheffer: Über die Einwirkung von alkalischem Wasserstoffsuperoxyd auf ungesättigte Verbindungen. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1921, Band 54, Nummer 9, S. 2327–2344 doi:10.1002/cber.19210540922.
- ↑ Paul A. Wender, Alan W. White: Methodology for indole synthesis. In: Tetrahedron letters. 1981, Band 22, Nummer 16, S. 1475–1478 doi:10.1016/S0040-4039(01)90354-5.
- ↑ enry Wenker: The Preparation of Ethylene Imine from Monoethanolamine. In: Journal of the American Chemical Society. 57, 1935, S. 2328, doi:10.1021/ja01314a504.
- ↑ Fritz Wessely, Georg Herbert Moser: Synthese und Konstitution des Skutellareins. In: Monatshefte für Chemie. 56, 1930, S. 97, doi:10.1007/BF02716040.
- ↑ Theodor Westphalen: Über die Einwirkung von Benzopersäure auf Cholesterin. In: Berichte der deutschen chemischen Gesellschaft. 48, 1915, S. 1064, doi:10.1002/cber.191504801149.
- ↑ H. Lettré, M. Müller: Einige Umsetzungen am Cholestantriol. In: Berichte der deutschen chemischen Gesellschaft. 70, 1937, S. 1947, doi:10.1002/cber.19370700918.
- ↑ P. Wharton: Communications- Stereospecific Synthesis of 6-Methyl-trans-5-cyclodecenone. In: The Journal of Organic Chemistry. 26, 1961, S. 4781, doi:10.1021/jo01069a609.
- ↑ P. Wharton, D. Bohlen: Communications- Hydrazine Reduction of α, β-Epoxy Ketones to Allylic Alcohols. In: The Journal of Organic Chemistry. 26, 1961, S. 3615, doi:10.1021/jo01067a117.
- ↑ P. Nayler, M. C. Whiting: Researches on polyenes. Part II. The synthesis of cosmene. In: Journal of the Chemical Society. 1954, S. 4006, doi:10.1039/JR9540004006.
- ↑ J. P. Wibaut, J. F. Arens: Die Bereitung von 4-Äthylpyridin aus Pyridin, Essigsäureanhydrid, Essigsäure und Zinkstaub; über die Hierbei Verlaufenden Chemischen Reaktionen und Gebildeten Zwischenprodukte. In: Recueil des travaux chimiques des Pays-Bas. 1941, Band 60, Nummer 2, S. 119–137 doi:10.1002/recl.19410600210.
- ↑ O. Wichterle, J. Procházka, J. Hofman: L'acétylacétate γ-chlorocrotylé et sa cyclisation par l'acide sulfurique. In: Collection of Czechoslovak Chemical Communications. 13, 1948, S. 300, doi:10.1135/cccc19480300.
- ↑ Oskar Widman: Ueber die Einwirkung von salpetriger Säure auf die Amidooxypropyl- und die Amidopropenylbenzoësäure. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 722, doi:10.1002/cber.188401701196.
- ↑ R. Stoermer, H. Fincke: Eine neue Synthese von Cinnolin-Derivaten. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 3115, doi:10.1002/cber.19090420331.
- ↑ C. Willgerodt: Ueber die Einwirkung von gelbem Schwefelammonium auf Ketone und Chinone. In: Berichte der deutschen chemischen Gesellschaft. 20, 1887, S. 2467, doi:10.1002/cber.18870200278.
- ↑ Karl Kindler: Studien über den Mechanismus chemischer Reaktionen. Erste Abhandlung. Reduktion von Amiden und Oxydation von Aminen. In: Justus Liebig's Annalen der Chemie. 431, 1923, S. 187, doi:10.1002/jlac.19234310111.
- ↑ Alexander Williamson: XLV. Theory of ætherification. In: The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 37, 1850, S. 350, doi:10.1080/14786445008646627.
- ↑ Georg Wittig, Georg Geissler: Zur Reaktionsweise des Pentaphenyl-phosphors und einiger Derivate. In: Justus Liebigs Annalen der Chemie. 580, 1953, S. 44, doi:10.1002/jlac.19535800107.
- ↑ Georg Wittig, Lisa Löhmann: Übe die kationtrope Isomerisation gewisser Benzyläther bei Einwirkung von Phenyl-lithium. In: Justus Liebig's Annalen der Chemie. 550, 1942, S. 260, doi:10.1002/jlac.19425500117.
- ↑ Georg Wittig, Helene Döser, Irene Lorenz: Über die Isomerisierbarkeit metallierter Fluorenyläther. In: Justus Liebigs Annalen der Chemie. 562, 1949, S. 192, doi:10.1002/jlac.19495620305.
- ↑ A. Wohl: Abbau des Traubenzuckers. In: Berichte der deutschen chemischen Gesellschaft. 26, 1893, S. 730, doi:10.1002/cber.189302601150.
- ↑ A. Wohl, W. Aue: Ueber die Einwirkung von Nitrobenzol auf Anilin bei Gegenwart von Alkali. In: Berichte der deutschen chemischen Gesellschaft. 34, 1901, S. 2442, doi:10.1002/cber.190103402183.
- ↑ A. Wohl: Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge. In: Berichte der deutschen chemischen Gesellschaft. 52, 1919, S. 51, doi:10.1002/cber.19190520109.
- ↑ K. Ziegler, A. Späth, E. Schaaf, W. Schumann, E. Winkelmann: Die Halogenierung ungesättigter Substanzen in der Allylstellung. In: Justus Liebig's Annalen der Chemie. 551, 1942, S. 80, doi:10.1002/jlac.19425510103.
- ↑ F. Wöhler: Ueber künstliche Bildung des Harnstoffs. In: Annalen der Physik. 1828, Band 88, Nummer 2, S. 253–256 doi:10.1002/andp.18280880206.
- ↑ Patent DE194883: Verfahren zur Darstellung von hydroxylierten Nitroverbindungen der aromatischen Reihe. Veröffentlicht am 4. August 1906, Erfinder: Richard Wolffenstein, Oskar Böters.
- ↑ Ludwig Wolff: Chemischen Institut der Universität Jena: Methode zum Ersatz des Sauerstoffatoms der Ketone und Aldehyde durch Wasserstoff. [Erste Abhandlung.]. In: Justus Liebig's Annalen der Chemie. 394, 1912, S. 86, doi:10.1002/jlac.19123940107.
- ↑ Nicolai Kishner: J. Russ. Phys. Chem. Soc. 43, 1911, S. 582.
- ↑ Ludwig Wolff: Ueber Diazoanhydride. In: Justus Liebig's Annalen der Chemie. 325, 1902, S. 129, doi:10.1002/jlac.19023250202.
- ↑ Bernhard Tollens, Rudolph Fittig: Ueber die Synthese der Kohlenwasserstoffe der Benzolreihe. In: Annalen der Chemie und Pharmacie. 131, 1864, S. 303, doi:10.1002/jlac.18641310307.
- ↑ Adolphe Wurtz: Sur une nouvelle classe de radicaux organiques. In: Annales de chimie et de physique. 44, 1855, S. 275-312 (Digitalisat auf Gallica).




