Benutzer:Orci/Namensreaktionen/P
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Paal-Knorr-Synthese | |||||
| Carl Paal, Ludwig Knorr | 1884 | 1,4-Diketone; Säurekatalysatoren, Amine oder Phosphor(V)-sulfid | Cyclisierung, Dehydratisierung | fünfgliedrige Heterocyclen (Furane, Pyrrole, Thiophene) | [1][2] |
 | |||||
| Paneth-Technik | |||||
| Fritz Paneth | 1929 | Organobleiverbindungen | thermische Zersetzung | Alkyl- oder Arylradikale | [3] |
| Parham-Cyclisierung | |||||
| William E. Parham | 1975 | Arylhalogenide mit elektrophiler Seitenkette, Lithiumorganyle | Metall-Halogen-Austausch, Cyclisierung | annelierte Verbindungen | [4] |
| Parikh-Doering-Oxidation | |||||
| Jekishan R. Parikh, William v. E. Doering | 1967 | primäre oder sekundäre Alkohole, Dimethylsulfoxid, Schwefeltrioxid, Pyridin, Triethylamin | Oxidation | Aldehyde oder Ketone | [5] |
 | |||||
| Passerini-Reaktion | |||||
| Mario Passerini | 1921 | Carbonylverbindungen, Isocynanide, Carbonsäuren | Mehrkomponentenreaktion | Ester der α-Hydroxycarbonsäureamide | [6] |
 | |||||
| Paternò-Büchi-Reaktion | |||||
| Emanuele Paternò, George Hermann Büchi | 1909 | Carbonylverbindung, Alken | photochemische [2+2]-Cycloaddition | Oxetane | [7][8] |
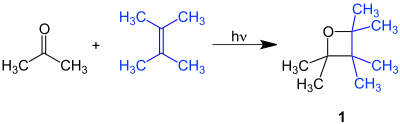 | |||||
| Pauson-Khand-Reaktion | |||||
| Peter Ludwig Pauson, Ihsan U. Khand | 1971 | Alkene, Alkine, Kohlenstoffmonoxid, Dicobaltoctacarbonyl | [2+2+1]-Cycloaddition | substituierte Cyclopentenone | [9] |
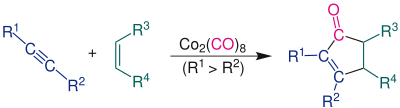 | |||||
| Payne-Umlagerung | |||||
| George B. Payne | 1931/1962 | 2,3-Epoxyalkohole, Base | stereospezifische Umlagerung | isomere Epoxyalkohole | [10][11] |
 | |||||
| Pechmann-Reaktion | |||||
| Hans von Pechmann | 1884 | β-Ketoester, Phenole, Säure | Umesterung, Ringschluss unter Kondensation | Cumarine | [12] |
 | |||||
| Pechmann-Pyrazolsynthese | |||||
| Hans von Pechmann | 1898 | Diazomethan, Acetylen | 1,3-Dipolare Cycloaddition | Pyrazol | [13] |
 | |||||
| Pellizzari-Reaktion | |||||
| Guido Pellizzari | 1911 | Amide, Hydrazide | Cyclisierung | Triazole | [14] |
 | |||||
| Pelouze-Synthese | |||||
| J. Pelouze | 1834 | Kaliumcyanid, Alkylsulfate | Alkylierung | Nitrile | [15] |
| Perkin-Reaktion | |||||
| William Henry Perkin | 1868 | aromatische Aldehyde, Acetanhydrid, Natriumacetat | Aldolkondensation | α,β-ungesättigte Carbonsäuren | [16] |
 | |||||
| Perkin-Umlagerung | |||||
| William Henry Perkin | 1870 | 2-Halogencoumarine, Hydroxid | Umlagerung, Decarboxylierung | Benzofurane | [17] |
| Perkow-Reaktion | |||||
| Werner Perkow | 1952 | α-substituierte Ketone, Phosphorigsäureester | Angriff des Phosphites, Umlagerung der Phosphorgruppe | Vinylphosphate | [18] |
 | |||||
| Petasis-Alkenylierung | |||||
| siehe Tebbe-Olefinierung | |||||
| Petasis-Ferrier-Umlagerung | |||||
| Nicos A. Petasis, Robert J. Ferrier | 1995 | cyclische Enolacetale, Lewis-Säure | Umlagerung | Tetrahydrofurane/-pyrane | [19] |
| Petasis-Reaktion | |||||
| Nicos A. Petasis | 1993 | Amine, Boronsäuren, Carbonylverbindungen | Mehrkomponentenreaktion | allylische Amine | [20] |
 | |||||
| Peterson-Olefinierung | |||||
| Donald John Peterson | 1968 | Ketone, α-silylierte-Carbanionen | Eliminierung | Alkene | [21] |
 | |||||
| Petrenko-Krittschenko-Piperidonsynthese | |||||
| P. Petrenko-Kritschenko | 1912 | Acetoncarbonsäuren, Aldehyde, Ammoniak | Multikomponentenreaktion | Piperidone | [22] |
| Pfau-Plattner-Azulensynthese | |||||
| Alexander Pfau, Pl. Plattner | 1939 | Indane, Diazoessigester | Addition eines Cyclopropanes, Dehydrogenierung, Decarboxylierung | Azulene | [23] |
| Pfitzinger-Reaktion | |||||
| Wilhelm Pfitzinger | 1886 | Isatin, Carbonylverbindungen, Base | Ringöffnung, Kondensation, Ringschluss | Chinolin-4-carbonsäuren | [24] |
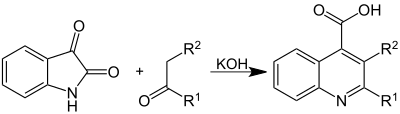 | |||||
| Pfitzner-Moffatt-Oxidation | |||||
| K. E. Pfitzner, J. G. Moffatt | 1963 | Alkohole, N,N′-Dicyclohexylcarbodiimid (DCC), Dimethylsulfoxid (DMSO) | Oxidation | Aldehyde/Ketone | [25] |
 | |||||
| Phillips-Ladenburg-Benzimidazolsynthese | |||||
| Montague A. Phillips, Albert Ladenburg | 1875/1928 | 1,2-Diaminobenzol, Carbonsäuren | Kondensation mit Cyclisierung | Benzimidazole | [26][27] |
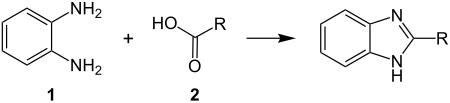 | |||||
| Photo-Fries-Umlagerung | |||||
| J. C. Anderson, C. B. Reese (benannt nach Karl Fries) | 1960 | Arylester | photolytische Umlagerung | Arylketone | [28] |
| Pictet-Gams-Isochinolinsynthese | |||||
| Amé Pictet, Alfons Gams | 1909 | β-Hydroxy-β-phenylethylamine, Phosphor(V)-oxid | Kondensation, Cyclisierung | Isochinoline | [29] |
| Pictet-Hubert-Reaktion | |||||
| Amé Pictet, A. Hubert | 1896 | N-Acyl-2-aminobiphenyle, Zinkchlorid | intramolekulare Cyclisierung | Phenathridine | [30] |
| Pictet-Spengler-Reaktion | |||||
| Amé Pictet, Theodor Spengler | 1911 | β-Arylethylamine, Aldehyde | ringschließende Kondensation | 6-Ring-Aminoheterocyclen | [31] |
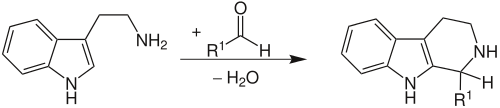 | |||||
| Piloty-Robinson-Synthese | |||||
| Oskar Piloty, Robert Robinson | 1910/18 | Azine, Säure | Protonierung, Umlagerung zum Diimiin, Ringschluss mit Ammoniakabspaltung | Pyrrole | [32][33] |
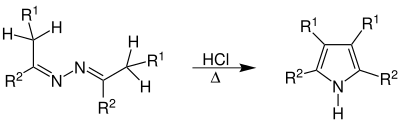 | |||||
| Pinner-Kondensation | |||||
| Adolf Pinner | 1884 | Amidine, β-Ketoester/β-Diketone, Base | Kondensation | Pyrimidine | [34] |
 | |||||
| Pinner-Reaktion | |||||
| Adolf Pinner | 1877 | Nitrile, Alkohole, Salzsäure | Bildung des Pinner-Salzes, unterschiedliche Aufarbeitung | Carbonsäuren/Ester/Amide | [35] |
 | |||||
| Pinner-Triazinsynthese | |||||
| Adolf Pinner | 1890 | Arylamidine, Phosgen | Kondensation, Ringschluss, Abspaltung von Ammoniak | Triazine | [36] |
 | |||||
| Pinnick-Oxidation | |||||
| Harold W. Pinnick | 1983 | Aldehyde, Natriumchlorit | Oxidation | Carbonsäuren | [37] |
 | |||||
| Piria-Reaktion | |||||
| Raffaele Piria | 1851 | Nitroaromaten, Natriumhydrogensulfit, Säure | Reduktion, Sulfonierung | aromatische Aminosulfonsäuren | [38] |
| Plancher-Umlagerung (Ciamician-Plancher-Umlagerung) | |||||
| Giuseppe Plancher | 1896 | disubistituierte Indolin-3-ole, Säure | Umlagerung | Indole | [39] |
 | |||||
| Polonovski-Reaktion | |||||
| Max Polonovski | 1927 | Aminoxide, Acetanhydrid/Acetylhalogenide | Umlagerung | Amide | [40] |
 | |||||
| Polonovski-Potier-Reaktion | |||||
| Pierre Potier | 1968 | Aminoxide, Trifluoressigsäureanhydrid | Eliminierung | Iminium-Ionen | [41] |
| Pomeranz-Fritsch-Reaktion | |||||
| Cäsar Pomeranz, Paul Fritsch | 1893 | Benzaldehyd, 2,2-Dialkoxyethylamin, Säure | Cyclisierung | Isochinolin | [42][43] |
 | |||||
| Ponzio-Reaktion | |||||
| Giacomo Ponzio | 1897 | Benzaldoxime, Distickstofftetroxid | Oxidation | Dinitrophenylmethane | [44] |
 | |||||
| Povarov-Reaktion (Pavarov-Reaktion) | |||||
| L.S. Povarov | 1963 | aromatische Imine, Alkene | Cyclokondensation | Chinoline | [45] |
| Prévost-Hydroxylierung | |||||
| Charles Prévost | 1933 | Alkene, Iod, Silberbenzoat (2 äq), Base | Bildung von Iodonium-Ion, Addition von zwei Benzoat-Molekülen unter Silberiodidabspaltung, Hydrolyse | anti-stehende Dihydroxyverbindungen | [46] |
 | |||||
| Prévost-Woodward-Hydroxylierung | |||||
| Charles Prévost, Robert Burns Woodward | 1958 | Alkene, Iod, Silberbenzoat (1 äq), Wasser | Bildung von Iodonium-Ion, Addition von einem Benzoat-Molekül unter Silberiodidabspaltung, Hydrolyse | syn-stehende Dihydroxyverbindungen | [47] |
 | |||||
| Prey-Etherspaltung | |||||
| Vinzenz Prey | 1941 | Aliphatisch-aromatische Ether, Pyridiniumchlorid | Phenole | [48] | |
| Prileschajew-Reaktion | |||||
| Nikolai Prileschajew | 1909 | Alkene, Peroxycarbonsäuren | Oxidation | Epoxide | [49] |
 | |||||
| Prins-Pinakolumlagerung | |||||
| Hendrik Jacobus Prins | 1969 | allylische Diole/Acetale, Lewis-Säure | Prins-Reaktion, Pinacol-Umlagerung | Tetrahydrofurane | [50] |
| Prins-Reaktion | |||||
| Hendrik Jacobus Prins | 1919 | Aldehyde/Ketone, Alkene/Alkine, Nucleophil | elektrophile Addition, nukleophile Addition | 1,3-Diole/Allylalkohole/Acetale/Carbonsäureester | [51] |
 | |||||
| Pschorr-Cyclisierung | |||||
| Robert Pschorr | 1896 | aromatische Verbindungen, Salpetrige Säure, Kupfer | Intramolekularer Ringschluss | aromatische Verbindung | [52] |
 | |||||
| Pudovik-Reaktion | |||||
| A. N. Pudovik | 1950 | Dialkylphosphonate, Alkene/Alkine, Base | nucleophile Addition | α-Hydroxyphosphonate | [53] |
| Pummerer-Umlagerung | |||||
| Rudolf Pummerer | 1909 | Sulfoxide, Anhydride | α-Acyloxysulfide | [54] | |
Quellen
- ↑ C. Paal: Synthese von Thiophen- und Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 367, doi:10.1002/cber.18850180175.
- ↑ Ludwig Knorr: Einwirkung des Diacetbernsteinsäureesters auf Ammoniak und primäre Aminbasen. In: Berichte der deutschen chemischen Gesellschaft. 18, 1885, S. 299, doi:10.1002/cber.18850180154.
- ↑ Fritz Paneth, Wilhelm Hofeditz: Über die Darstellung von freiem Methyl. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1929, Band 62, Nummer 5, S. 1335–1347 doi:10.1002/cber.19290620537.
- ↑ William E. Parham, Lawrence D. Jones, Yousry Sayed: Selective lithiation of bromoarylalkanoic acids and amides at low temperature. Preparation of substituted arylalkanoic acids and indanones. In: The Journal of Organic Chemistry. 40, 1975, S. 2394, doi:10.1021/jo00904a029.
- ↑ Jekishan R. Parikh, William v. E. Doering: Sulfur trioxide in the oxidation of alcohols by dimethyl sulfoxide. In: Journal of the American Chemical Society. 89, 1967, S. 5505, doi:10.1021/ja00997a067.
- ↑ M. Passerini: In: Gazzetta Chimica Italiana. Band 51, 1921, S. 126.
- ↑ E. Paternò, G. Chieffi: Sintesi in chimica organica per mezzo della luce. Nota II. Composti degli idrocarburi non saturi con aldeidi e chetoni. In: Gazz. Chim. Ital., 39, 1909, S. 341-361.
- ↑ G. Büchi, Charles G. Inman, E. S. Lipinsky: Light-catalyzed Organic Reactions. I. The Reaction of Carbonyl Compounds with 2-Methyl-2-butene in the Presence of Ultraviolet Light. In: Journal of the American Chemical Society. 76, 1954, S. 4327, doi:10.1021/ja01646a024.
- ↑ I. U. Khand, G. R. Knox, P. L. Pauson, W. E. Watts: A cobalt induced cleavage reaction and a new series of arenecobalt carbonyl complexes. In: Journal of the Chemical Society D: Chemical Communications. 1971, S. 36a, doi:10.1039/C2971000036A.
- ↑ E. P. Kohler, N. K. Richtmyer, W. F. Hester: The action of organic magnesium compounds on alpha oxido ketones and esters. In: Journal of the American Chemical Society. 53, 1931, S. 205, doi:10.1021/ja01352a028.
- ↑ George B. Payne: Epoxide Migrations with α,β-Epoxy Alcohols. In: The Journal of Organic Chemistry. 27, 1962, S. 3819, doi:10.1021/jo01058a015.
- ↑ H. v. Pechmann: Neue Bildungsweise der Cumarine. Synthese des Daphnetins. I. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 929, doi:10.1002/cber.188401701248.
- ↑ H. v. Pechmann: Pyrazol aus Acetylen und Diazomethan. In: Berichte der deutschen chemischen Gesellschaft. 31, 1898, S. 2950, doi:10.1002/cber.18980310363.
- ↑ Guido Pellizzari: In: Gazz. Chim. Ital. 1911, 41, S. 20.
- ↑ J. Pelouze: Notiz über einen neuen Cyanäther. In: Annalen der Pharmacie. 10, 1834, S. 249, doi:10.1002/jlac.18340100302.
- ↑ W. H. Perkin: XXIII.—On the hydride of aceto-salicyl. In: J. Chem. Soc.. 21, 1868, S. 181, doi:10.1039/JS8682100181.
- ↑ W. H. Perkin: XXIX.—On some new bromine derivatives of coumarin. In: Journal of the Chemical Society. 1870, Band 23, S. 368–371 doi:10.1039/JS8702300368.
- ↑ W. Perkow, K. Ullerich, Fr. Meyer: Neue Phosphorsäureester mit pupillenverengender Wirkung. In: Die Naturwissenschaften. 39, 1952, S. 353, doi:10.1007/BF00589945.
- ↑ Nicos A. Petasis, Shao-Po Lu: New Stereocontrolled Synthesis of Substituted Tetrahydrofurans from 1,3-Dioxolan-4-ones. In: Journal of the American Chemical Society. 117, 1995, S. 6394, doi:10.1021/ja00128a044.
- ↑ Nicos A. Petasis, Irini Akritopoulou: The boronic acid mannich reaction: A new method for the synthesis of geometrically pure allylamines. In: Tetrahedron Letters. 34, 1993, S. 583, doi:10.1016/s0040-4039(00)61625-8.
- ↑ Donald John Peterson: Carbonyl olefination reaction using silyl-substituted organometallic compounds. In: The Journal of Organic Chemistry. 33, 1968, S. 780, doi:10.1021/jo01266a061.
- ↑ P. Petrenko-Kritschenko: Über die Kondensation des Acetondicarbonsäureesters mit Aldehyden. Ammoniak und Aminen. In: Journal für Praktische Chemie. 85, 1912, S. 1, doi:10.1002/prac.19110850101.
- ↑ Alexander St. Pfau, Pl. A. Plattner: Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens. In: Helvetica Chimica Acta. 22, 1939, S. 202, doi:10.1002/hlca.19390220126.
- ↑ W. Pfitzinger: Chinolinderivate aus Isatinsäure. In: Journal für Praktische Chemie. 33, 1886, S. 100, doi:10.1002/prac.18850330110.
- ↑ K. E. Pfitzner, J. G. Moffatt: The Synthesis of Nucleoside-5″ Aldehydes. In: Journal of the American Chemical Society. 85, 1963, S. 3027, doi:10.1021/ja00902a035.
- ↑ A. Ladenburg: Derivate von Diaminen. In: Berichte der Deutschen Chemischen Gesellschaft. 1875, Band 8, Nummer 1, S. 677–678 doi:10.1002/cber.187500801209.
- ↑ Montague Alexandra Phillips: XXV.—The formation of 2-methylbenziminazoles. In: Journal of the Chemical Society. 1928, S. 172–177 doi:10.1039/JR9280000172.
- ↑ J.C. Anderson, C. B. Reese: In: Proc. Chem. Soc., 1960, S. 217.
- ↑ Amé Pictet, Alfons Gams: Synthese des Papaverins. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 2943, doi:10.1002/cber.19090420311.
- ↑ Amé Pictet, A. Hubert: Ueber eine neue Synthese der Phenanthridinbasen. In: Berichte der deutschen chemischen Gesellschaft. 29, 1896, S. 1182, doi:10.1002/cber.18960290206.
- ↑ Amé Pictet, Theod. Spengler: Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin. In: Berichte der deutschen chemischen Gesellschaft. 44, 1911, S. 2030, doi:10.1002/cber.19110440309.
- ↑ O. Piloty: Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 489, doi:10.1002/cber.19100430182.
- ↑ Gertrude Maud Robinson, Robert Robinson: LIV.—A new synthesis of tetraphenylpyrrole. In: J. Chem. Soc., Trans.. 113, 1918, S. 639, doi:10.1039/CT9181300639.
- ↑ A. Pinner: Ueber die Einwirkung von Acetessigäther auf die Amidine. In: Berichte der Deutschen Chemischen Gesellschaft. 1884, Band 17, Nummer 2, S. 2519–2520 doi:10.1002/cber.188401702173.
- ↑ A. Pinner, Fr. Klein: Umwandlung der Nitrile in Imide. In: Berichte der deutschen chemischen Gesellschaft. 10, 1877, S. 1889, doi:10.1002/cber.187701002154.
- ↑ A. Pinner: Ueber Diphenyloxykyanidin. In: Berichte der deutschen chemischen Gesellschaft. 23, 1890, S. 2919, doi:10.1002/cber.189002302208.
- ↑ Balkrishna S. Bal, Wayne E. Childers, Harold W. Pinnick: Oxidation of α,β-un saturated aldehydes. In: Tetrahedron. 37, 1981, S. 2091, doi:10.1016/S0040-4020(01)97963-3.
- ↑ R. von Piria: Ueber einige Produkte der Einwirkung des schwefligsauren Ammoniaks auf Nitronaphtalin. In: Annalen der Chemie und Pharmacie. 78, 1851, S. 31, doi:10.1002/jlac.18510780103.
- ↑ G. Ciamician, G. Plancher: Ueber die Einwirkung von Jodäthyl auf α‐Methylindol (Methylketol). In: Berichte der Deutschen Chemischen Gesellschaft. 1896, Band 29, Nummer 3, S. 2475–2482 doi:10.1002/cber.18960290318.
- ↑ M. Polonovski, M, Polonovski: Amine oxides of the alkaloids. III. Action of organic acid chlorides and anhydrides. Preparation of the nor bases. In: Bull. soc. chim. 1927, S. 1190-1208.
- ↑ A. Ahond, A. Cavé, Christiane Kan‐Fan, H.‐P. Husson, J. De Rostolan, Pierre Potìer: Facile N-O bond cleavages of amine oxides. In: Journal of the American Chemical Society. 1968, Band 90, Nummer 20, S. 5622–5623 doi:10.1021/ja01022a063.
- ↑ C. Pomeranz: Über eine neue Isochinolinsynthese. In: Monatshefte für Chemie. 14, 1893, S. 116, doi:10.1007/BF01517862.
- ↑ Paul Fritsch: Synthesen in der Isocumarin- und Isochinolinreihe. In: Berichte der deutschen chemischen Gesellschaft. 26, 1893, S. 419, doi:10.1002/cber.18930260191.
- ↑ G. Ponzio: In: Gazz. Chim. Ital. 27, 1897, S. 171.
- ↑ L.S. Povarov, B.M. Mikhailov: In: Izv. Akad. Nauk SSR, Ser. Khim. 1963, S. 953–956.
- ↑ Charles Prévost: Sur un complexe iodo-argento-benzoïque et son application à l'oxydation des combinaisons éthyléniques en α-glycols. In: Comptes Rendus. 1933, 196, S. 1129 (Digitalisat auf Gallica).
- ↑ R. B. Woodward, F. V. Brutcher: cis-Hydroxylation of a Synthetic Steroid Intermediate with Iodine, Silver Acetate and Wet Acetic Acid. In: Journal of the American Chemical Society. 80, 1958, S. 209, doi:10.1021/ja01534a053.
- ↑ V. Prey: Die Spaltung von Phenoläthern mit Pyridinhydrochlorid. In: Berichte der Deutschen Chemischen Gesellschaft. Abteilung B, Abhandlungen. 1941, Band 74, Nummer 7, S. 1219–1225 doi:10.1002/cber.19410740715.
- ↑ Nikolaus Prileschajew: Oxydation ungesättigter Verbindungen mittels organischer Superoxyde. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 4811, doi:10.1002/cber.190904204100.
- ↑ P. Martinet, G. Mousset, M. Colineau: Utilisation d'une montmorillonite activée comme catalyseur dans la synthèse d'acétales cyclique. Mise en évidence de réactions secondaires. In: Comtes Rendus Seances Acad. Sci. C. 1969, 268, S. 1303-1306 (Digitalisat auf Gallica).
- ↑ H. J. Prins: Condensation of formaldehyde with some unsaturated compounds. In: Chemisch Weekblad. 1919, 16, 64, 1072, 1510.
- ↑ Robert Pschorr: Neue Synthese des Phenanthrens und seiner Derivate. In: Berichte der deutschen chemischen Gesellschaft. Band 29, Nr. 1, 1896, S. 496–501, doi:10.1002/cber.18960290198.
- ↑ A. N. Pudovik: Addition of dialkyl phosphites to unsaturated compounds. A new method of synthesis of β-keto phosphonic and unsaturated α-hydroxyphosphonic esters. In: Doklady Akad. Nauk. SSSR. 1950, 73, S. 499.
- ↑ R. Pummerer: Über Phenyl-sulfoxyessigsäure. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 2282, doi:10.1002/cber.190904202126.




