Benutzer:Orci/Namensreaktionen/B
| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Babler-Oxidation | |||||
| James Babler | 1976 | tertiäre Alkohole, Pyridiniumchlorochromat | Oxidation | Enone | [1] |
 | |||||
| Baddeley-Isomerisierung | |||||
| George Baddeley | 1933 | Polyalkylbenzole, protische Säure, Lewis-Säure | Umlagerung | energetisch günstige Polyalkylbenzole | [2] |
 | |||||
| Baer-Fischer-Aminozuckersynthese | |||||
| Hans Helmut Baer, Hermann Fischer | 1958 | zuckerartige Dialdehyde, Nitroalkane, Wasserstoff | Aldolkondensation, Hydrierung | 3-Aminozucker | [3] |
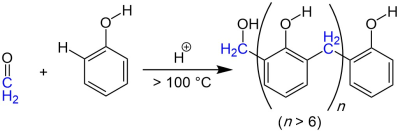
| Baekeland-Manasse-Lederer-Reaktion (Bakelit-Prozess) | |||||
| Leo Hendrik Baekeland, O. Manasse, L. Lederer | 1894 | Phenol, Formaldehyd | Polykondensation | Phenol-Formaldehyd-Harze | [4][5][6] |
 | |||||
| Baeyer-Diarylmethan-Synthese | |||||
| Adolf von Baeyer | 1872 | Aromaten, Formaldehyd | Kondensation | Diarylmethane | [7] |
 | |||||
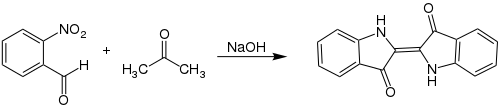
| Baeyer-Drewson-Indigosynthese | |||||
| Adolf von Baeyer, Viggo Drewsen | 1882 | o-Nitrobenzaldehyd, Aceton | Aldolkondensation | Indigo | [8] |
 | |||||
| Baeyer-Emmerling-Indolsynthese | |||||
| Adolf von Baeyer, Adolph Emmerling | 1869 | ortho-Nitrozimtsäure, Eisen, Base | Bildung einer Nitrosoverbindung, Kondensation unter Ringschluss, Decarboxylierung | Indol | [9] |
 | |||||
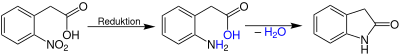
| Baeyer-Oxindol-Synthese | |||||
| Adolf von Baeyer | 1878 | ortho-Nitrophenolessigsäure, Wasserstoff | Reduktion unter Ringschluss | Oxindol | [10] |
 | |||||
| Baeyer-Probe | |||||
| Adolf von Baeyer | Alkene, Kaliumpermanganat, Natriumcarbonat | Redoxreaktion unter Bildung von Diolen, Natriummanganat und Braunstein | Nachweisreaktion für Alkene | ||
 | |||||
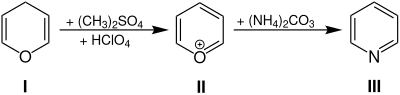
| Baeyer-Pyridinsynthese | |||||
| Adolf von Baeyer | 1910 | Pyrane, Dimethylsulfat, Perchlorsäure, Ammoniumcarbonat | Bildung eines Oxoniumsalzes, Anlagerung des Amins, Ringöffnung, Abspaltung von Wasser, Ringschluss | Pyridine | [11] |
 | |||||
| Baeyer-Villiger-Oxidation | |||||
| Adolf von Baeyer, Victor Villiger | 1899 | Ketone, Peroxide wie meta-Chlorperbenzoesäure | Oxidation | Carbonsäureester | [12] |
 | |||||
| Baeyer-Villiger-Tritylierung | |||||
| Adolf von Baeyer, Victor Villiger | 1902 | Phenole, Triphenylmethanol, Säure | Friedel-Craft-Reaktion | Einführung einer Triphenylgruppe an den aromatischen Ring | [13] |
| Bailey-Criss-Cross-Cycloaddition | |||||
| James R. Bailey | 1917 | Aldazine, Alkene/Alkine/Nitrile | [2+3]-Cycloaddition | Diazabicycloctane | [14] |
| Bailey-Peptidsynthese | |||||
| J. L. Bailey | 1949 | α-Aminosäure-N-carbonsäureanhydriden (NCAs), Aminosäuren/Peptid-Ester | Peptidsynthese | Peptide | [15] |
 | |||||
| Baizer-Prozess | |||||
| Manuel M. Baizer | 1964 | Acrylnitril, Tetraethylammonium-p‐toluolsulfonat | Elektrolytische Reduktion | Adiponitril | [16] |
| Baker-Ollis-Sydnon-Synthese | |||||
| John Campbell Earl, Alan W. Mackney / Wilson Baker, William David Ollis | 1935/1957 | N-Substituierte α-Aminosäuren, Essigsäureanhydrid | nukleophiler Angriff, Abspaltung von Essigsäure, Cyclisierung | Sydnone | [17][18] |
 | |||||
| Baker-Venkataraman-Umlagerung | |||||
| Wilson Baker, Krishnasami Venkataraman | 1933 | α-Acyloxyketone, Basen | Umlagerung | 1,3-Diketon-substituierte Phenole | [19] |
 | |||||
| Balaban-Pyryliumsalz-Synthese (Balaban-Nenitzescu-Praill-Reaktion) | |||||
| Alexandru Balaban, Costin Nenitzescu, P. F. G. Praill | 1959 | Säurechloride, Alkene, Aluminiumtrichlorid | Pyryliumsalze | [20] | |
 | |||||
| Ball-Goodwin-Morton-Oxidation | |||||
| S. Ball, T. W. Goodwin, R. A. Morton | 1948 | Allylalkohole, Mangan(IV)-oxid | Oxidation | Allylketone/-aldehyde | [21] |
| Bally-Scholl-Synthese | |||||
| Oscar Bally, Roland Scholl | 1905 | Anthrachinone, Glycerin, Schwefelsäure | Benzanthrone | [22] | |
 | |||||
| Balsohn-Alkylierung | |||||
| M. Balsohn | 1879 | Aromaten, Alkene | Alkylierung | alkylsubstituierte Aromaten | [23] |
 | |||||
| Balz-Schiemann-Reaktion | |||||
| Günther Balz, Günther Schiemann | 1927 | aromatisches Amin, salpetriger Säure, Tetrafluoroborsäure | Einführung eines Fluorsubstituenten | aromatische Fluorverbindungen | [24] |
 | |||||
| Bamberger-Imidazolspaltung | |||||
| Eugen Bamberger | 1893 | Imidazole, Säurechlorid, Base | Bildung eines Amides, Ringspaltung | bis-N-substituierte cis-Alkene | [25] |
| Bamberger-Umlagerung | |||||
| Eugen Bamberger | 1894 | N-Phenylhydroxyamine, Säuren | Umlagerung | 4-Aminophenole | [26] |
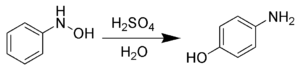 | |||||
| Bamberger-Triazinsynthese | |||||
| Eugen Bamberger | 1892 | Aniline, Natriumnitrit, Brenztraubensäurehydrazon | Bildung eines Diazoniumsalzes, Kondensation mit Ringschluss | Triazine | [27] |
| Bamford-Stevens-Reaktion | |||||
| William R. Bamford, Thomas S. Stevens | 1952 | Ketone, Arylsulfonhydrazid, Alkoholate | Bildung einer Diazoverbindung, Abspaltung von Stickstoff, Eliminierung | Alkene | [28] |
 | |||||
| Barbas-List-Michael-Reaktion | |||||
| Carlos Barbas, Benjamin List | 2001 | Aldehyde/Ketone, α,β-ungesättigte Nitroalkene oder Malonate, Prolin-Katalysatoren | assymetrische Michael-Addition | Michael-Addukt | [29][30] |
| Barbier-Kupplung | |||||
| Philippe Barbier | 1899 | Ketone, Halogenalkane, Magnesium oder ein anderes Metall | in-situ-Grignard-Reaktion | tertiäre Alkohole | [31] |
 | |||||
| Barbier-Wieland-Abbau | |||||
| Philippe Barbier, Heinrich Wieland | 1913 | Carbonsäureester, Phenylmagnesiumchlorid, Säure, Chrom(IV)-oxid | Gringnard-Reaktion, Eliminierung von H2O unter Alkenbildung, Oxidative Bildung von Carbonsäure und Benzophenon | Carbonsäuren | [32][33] |
 | |||||
| Bardhan-Sengupta-Synthese | |||||
| Jogendra C. Bardhan, Suresh C. Sengupta | 1932 | 2-β-Arylethylcyclohexan-2-ole, Phosphor(V)-oxid, Palladium (Katalysator) | Cyclisierung, Dehydrogenierung | Phenanthrene | [34] |
 | |||||
| Bargellini-Reaktion | |||||
| G. Bargellini | 1906 | Ketone, 2-Amino-2-methyl-1-propanol oder 1,2-Diaminopropane, Natriumhydroxid, Chloroform | Bildung eines Dichlorepoxides, Ringschluss unter Abspaltung der Chloratome | Morpholinone oder Piperazinone | [35] |
 | |||||
| Barluenga-Reaktion | |||||
| José Barluenga | 2007 | Hydrazone, Bromaromaten, Pd(0)-Komplex als Katalysator (z.B. [Pd2(dba)3]) | Kupplungsreaktion | Bildung einer C-C-Bindung | [36] |
| Barry-Reaktion | |||||
| Vincent Barry | 1943 | aromatische Hydrazine, Ketone | Kondensation | Hydrazone | [37] |
| Bartoli-Indolsynthese | |||||
| Giuseppe Bartoli | 1978 | ortho-substituierte Nitrobenzole, Vinyl-Grignard-Verbindungen | Reaktion des Grignard-Reagenzes mit der Nitrogruppe, [3,3]-sigmatrope Umlagerung | Indole | [38] |
 | |||||
| Barton-Arylierung | |||||
| Derek H. R. Barton | 1985 | Phenole/Enole/Azole/Amine, Organobismutverbindungen | Arylierung | Arylether oder O-Phenole | [39] |
 | |||||
| Barton-Desaminierung | |||||
| Derek H. R. Barton | 1980 | primäre Amine, p-Toluolsulfonsäurechlorid, Tributylzinnchlorid, AIBN | Bildung eines Isonitrils, radikalische Defunktionalisierung | Alkane | [40] |
| Barton-Decarboxylierung | |||||
| Derek H. R. Barton | 1983 | Carbonsäurechloride,N-Hydroxypyridin-2-thion, Tributylstannan, AIBN | Bildung eines Barton-Esters, radikalische Decarboxylierung | Alkane | [41] |
 | |||||
| Barton-McCombie-Desoxygenierung | |||||
| Derek H. R. Barton, Stuart W. McCombie | 1962 | Alkohole, Thiocarbonsäurechlorid, Tributylstannan, AIBN | Bildung eines Thioxoesters, radikalische Desoxygenierung | Alkane | [42] |
 | |||||
| Barton-Olefinsynthese (Barton-Kellog-Reaktion) | |||||
| Derek H. R. Barton | 1970 | Thioketone, Diazoverbindungen, Triphenylphosphin | 1,3-dipolare Cycloaddition, Wittig-artige Reaktion | Alkene | [43][44] |
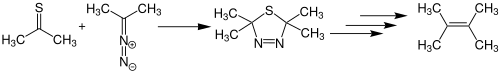 | |||||
| Barton-Reaktion | |||||
| Derek H. R. Barton | 1960 | Salpetrigsäureester | Photolyse | δ-Nitrosoalkoholen | [45] |
 | |||||
| Barton-Zard-Reaktion | |||||
| Derek H. R. Barton, Samir Z. Zard | 1985 | Nitroalkene, Alkyl-α-isocyanoacetate, Base | Pyrrole | [46] | |
 | |||||
| Bart-Reaktion (Bart-Scheller-Reaktion) | |||||
| Heinrich Bart | 1910 | aromatische Azide, Natriumarsenit, Kupfersalze (Katalysator) | aromatische Arsonsäuren | [47] | |
 | |||||
| Bart-Schmidt-Reaktion | |||||
| Heinrich Bart | 1911 | aromatische Azide, Natriumantimonit | aromatische Antimonsäuren | [48] | |
| Bashkirov-Oxidation | |||||
| Andrei Nikolajewitsch Bashkirov | 1959 | höhermolekulare Alkane, Borsäure, Sauerstoff | Oxidation | Fettalkohole | [49] |
| Batcho-Leimgruber-Indolsynthese | |||||
| Andrew D. Batcho, Willy Leimgruber | 1971 | ortho-Nitrotoluole, Formamid-Acetale, Palladium, Wasserstoff | Kondensation von Nitrotoluol und Amid, Reduktion | Indole | [50] |
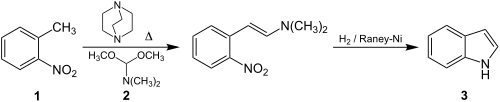 | |||||
| Baudisch-Reaktion | |||||
| Otto Baudisch | 1939 | Benzol/Phenole, Hydroxylamin, Wasserstoffperoxid, Kupfer(II)-Ionen | radikalische Oxidation, Komplexbildung | o-Nitrosophenole | [51] |
 | |||||
| Baumann-Fromm-Thiophensynthese | |||||
| Eugen Baumann, Emil Fromm | 1895 | Styrolderivate, Schwefel | radikalische Cyclisierung | Thiophene | [52] |
 | |||||
| Baumgarten-α-Amino-Keton-Synthese | |||||
| Henry Baumgarten | 1954 | N,N-Dichloroalkylamine, Natriummethanoat, Säure | Umlagerung | α‐Aminoketone | [53] |
| Baylis-Hillman-Reaktion | |||||
| Anthony B. Baylis, Melville E. D. Hillman | 1968 | Ketone, Aldehyde oder Aldimide; elektronenarme Alkene; tertiäre Amine (Katalysator) | katalysierte Aldol-Reaktion | Bildung einer C-C-Bindung | [54] |
 | |||||
| Béchamp-Reduktion | |||||
| Antoine Béchamp | 1854 | Nitroaromaten, Eisen, Säure | Reduktion | Aminobenzole | [55] |
 | |||||
| Beckmann-Umlagerung | |||||
| Ernst Otto Beckmann | 1886 | Oxime, Säure | Umlagerung | Amide | [56] |
 | |||||
| Beckmann-Fragmentierung | |||||
| Ernst Otto Beckmann (entdeckt von A. Werner, A. Piguet) | 1904 | bestimmte Oxime, Säure | (Konkurrenzreaktion zur Beckmann-Umlagerung) Fragmentierung | Nitrile und Carbokationen | [57] |
| Bedoukian-Halogenierung | |||||
| Paul Z. Bedoukian | 1944 | Aldehyde/Ketone, Kaliumacetat, Acetanhydrid, Brom, Säure | Bildung der Enolacetats, Bromierung, Hydrolyse | α-Bromaldehyde/-ketone | [58] |
| Béhal-Sommelet-Umlagerung | |||||
| Auguste Béhal, Marcel Sommelet | 1904 | β-Hydroxyalkylether, Säure | Umlagerung | Aldehyde | [59] |
 | |||||
| Bellus-Claisen-Umlagerung | |||||
| Daniel Belluš | 1978 | Allylether/Allylamine/Allylthioether, Ketene | Claisen-Umlagerung | Ester/Thioster/Amide/Ringerweiterungen | [60] |
| Belousov-Zhabotinsky-Reaktion | |||||
| Boris Beloussow, Anatoli Schabotinski | 1959/64 | Kaliumbromat, Malonsäure, Kaliumbromid, Schwefelsäure, Ferroin | oszillierende Reaktion | [61][62] | |
| Beirut-Reaktion | |||||
| Makhluf J. Haddadin, Costas H. Issidorides (benannt nach Beirut) | 1976 | Benzofurazanoxid, β-Ketoester | Chinoxalin-1,4-dioxide | [63] | |
 | |||||
| Beller-Synthese | |||||
| Matthias Beller | 1997 | Aldehyde, Amide, CO/Alkene/Alkine, Palladium-Katalysator | Multikomponentenreaktion | Aminosäuren | [64] |
| Bénary-Reaktion | |||||
| Erich Bénary | 1909 | Enaminoketone, Grignard-Verbindungen | Additions-Eliminierungsreaktion | α,β-ungesättigte Ketone, Aldehyde oder Ester | [65] |
 | |||||
| Benkeser-Reduktion | |||||
| Robert A. Benkeser | 1952 | Aromaten, Lithium/Calcium, aliphatische Amine | Reduktion | Cycloalkene | [66] |
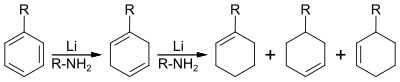 | |||||
| Berchthold-Homologisierung | |||||
| Glenn Berchtold | 1961 | cyclische Enamine, Alkinester | [2+2]-Cycloaddition, Umlagerung unter Ringerweiterung, Hydrolyse | cyclische Ketone | [67] |
| Bergius-Pier-Verfahren (Bergius-Prozess) | |||||
| Friedrich Bergius, Matthias Pier | 1913 | Kohle, Wasserstoff | Hydrierung | flüssige Kohlenwasserstoffe | [68] |
 | |||||
| Beringer-Kang-Reaktion | |||||
| Marshall Beringer, Suk-Ku Kang | 1953/2000 | Amine, Diaryliodoniumsalze, Kupfer(II)-salze | Ullmann-Kupplung | Arylamine | [69][70] |
| Bernthsen-Acridin-Synthese | |||||
| August Bernthsen | 1884 | Diarylamine, Carbonsäuren, Zinkchlorid | Aciridine | [71] | |
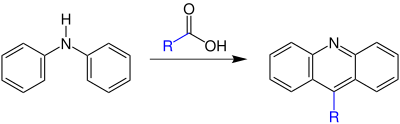 | |||||
| Bergman-Cyclisierung | |||||
| Robert George Bergman | 1972 | Endiine | Umlagerung | Benzolderivate | [72] |
 | |||||
| Bergmann-Abbau | |||||
| Max Bergmann | 1934 | Polyaminosäuren, Benzylalkohol, Wasserstoff | Bildung eines Azides, Curtius-Umlagerung, Abspaltung von Toluol, CO2, Ammoniak | verkürzte Aminosäure + Aldehyd | [73] |
 | |||||
| Bergmann-Stern-Azlactonsynthese (Bergmann-Azlacton-Peptid-Synthese) | |||||
| Max Bergmann, Ferdinand Stern | 1926 | acetylierte Aminosäure, Aldehyde, Aminosäure, Wasserstoff, Säure | Bildung eines Azlactons, Ringöffnung, Hydrogenierung | Dipeptide | [74] |
 | |||||
| Bergmann-Zervas-Carbobenzoxy-Methode | |||||
| Max Bergmann, Leonidas Zervas | 1932 | Chlorameisensäurebenzylester, Aminosäuren, Wasserstoff | Aufbau einer Peptidkette, Abspaltung von Toluol, CO2 | Pepidsequenz | [75] |
| Bertrand-Stephan-Bindungsaktivierung | |||||
| Guy Bertrand, Douglas W. Stephan | 2004/06 | Aminocarbene/Phosphorylborane | Bindung von Wasserstoff/Alkenen | aktivierte σ-Bindungen, die hydriert werden können oder mit Alkenen reagieren | [76][77] |
| Berti-Olefinierung | |||||
| Giancarlo Berti | 1954 | Methylalkylsulfite | Pyrolyse | Alkene | [78] |
| Bertram-Walbaum-Reaktion | |||||
| J. Bertram, H. Walbaum | 1894 | Camphen, Schwefelsäure | Oxidation, Verseifung | Isoborneol | [79] |
| Betti-Reaktion | |||||
| Mario Betti | 1900 | Amine, aromatische Aldehyde, Phenole | α-Aminobenzylphenole | [80] | |
 | |||||
| Beyer-Methode für Chinoline | |||||
| siehe Doebner-Miller-Reaktion | |||||
| Biellmann-Alkylierung | |||||
| J.F. Biellmann | 1971 | Allylhalogenide, Allylthiocarbanionen | Kupplung | Dialkene | [81] |
| Biginelli-Reaktion | |||||
| Pietro Biginelli | 1891 | aromatische Aldehyde, Harnstoff, Ethylacetoacetat | Eintopfreaktion | Pyrimidone | [82] |
 | |||||
| Bingel-Reaktion | |||||
| Carsten Bingel | 1993 | Fullerene, stabilisierte Halogencarbanionen, Base | Cyclopropanierung | funktionalisierte Fullerene | [83] |
| Bingel-Hirsch-Reaktion | |||||
| Carsten Bingel, Andreas Hirsch | 1993 | Fullerene, Malonate, Tetrabrommethan, Diazabicycloundecen | Cyclopropanierung | funktionalisierte Fullerene | [84][85] |
| Birch-Reduktion | |||||
| Arthur Birch | 1944 | Aromaten, Alkalimetalle, fl. Ammoniak | Reduktion | 1,4-Cyclohexadiene | [86] |
 | |||||
| Birckenbach-Goubeau-Halogenierung | |||||
| Lothar Birckenbach, Josef Goubeau | 1932 | Aromaten, Halogene, Silberperchlorat | Bildung eines Halogen-Kations, Halogenierung | Halogenaromaten | [87] |
| Birnbaum-Simonini-Reaktion | |||||
| K. Birnbaum, Angelo Simonini | 1892 | Silbersalze von Carbonsäuren, Iod | ähnlich der Hunsdiecker-Reaktion | Carbonsäureester | [88][89] |
| Bischler-Benzotriazinsynthese | |||||
| August Bischler | 1889 | o-Nitrophenylhydrazine, Ameisensäure, Wasserstoff | Bildung eines Carbonsäurehydrazides, Ringschluss, Hydrierung | Benzotriazine | [90] |
| Bischler-Möhlau-Indolsynthese | |||||
| August Bischler, Richard Möhlau | ω-Arylamino-ketone, Aniline | 3-Arylindole | [91] | ||
 | |||||
| Bischler-Napieralski-Reaktion | |||||
| August Bischler, Bernard Napieralski | 1893 | β-Phenethylamide, Phosphoroxychlorid | Dihydroisochinoline | [92] | |
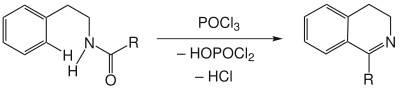 | |||||
| Black-Umlagerung | |||||
| T. Howard Black | 1987 | O-acylierte Enole, 4-(Dimethylamino)pyridin | Umlagerung | C-acylierte Ester | [93] |
| Blaise-Ketonsynthese | |||||
| Edmond Blaise | 1910 | Carbonsäurehalogenide, Organozinkhalogenide | Ketone | [94] | |
 | |||||
| Blaise-Maire-Reaktion | |||||
| Edmond Blaise, M. Maire | 1907 | β-Hydroxysäurechloride, Organozinkhalogenide, Schwefelsäure | Blaise-Ketonsynthese, Abspaltung von Wasser | α,β-ungesättigte Ketone | [95] |
| Blaise-Reaktion | |||||
| Edmond Blaise | 1901 | Nitrile, α-Halogenester, Zink | Bildung einer Zinkorganischen Verbindung, nukleophile Addition, saure Aufarbeitung | β-Ketoester | [96] |
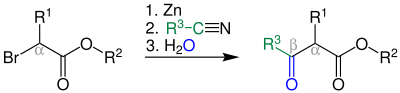 | |||||
| Blanc-Chlormethylierung | |||||
| Gustave Louis Blanc | 1923 | Aromaten, 1,3,5-Trioxan, Salzsäure, Zinkchlorid (Katalysator) | Elektrophile aromatische Substitution, nukleophile Substitution durch Chlorid | Chlormethylierte Aromaten | [97] |
 | |||||
| Blanc-Cyclisierung | |||||
| H. G. Blanc | 1907 | Dicarbonsäuren, Essigsäureanhydrid | Cyclisierung | cyclische Anhydride oder Ketone | [98] |
| Blanc-Quelet-Rektion | |||||
| siehe Quelet-Reaktion | |||||
| Blaser-Heck-Reaktion | |||||
| Hans-Ulrich Blaser | 1982 | Alkene, Aroylchloride, Palladiumacetat (Katalysator) | Decarboxylierung, Heck-Reaktion | Arylierte Alkene | [99] |
| Blicke–Pachter-Pteridin-Synthese | |||||
| Frederick F. Blicke, Irwin J. Pachter | 1954/63 | Aminopyrimidine, Aldehyde, Cyanid, Natriummethanolat | Kondensation, Cyclisierung | Pteridine | [100][101] |
| Blomquist-Cycloketonsynthese | |||||
| A. T. Blomquist | 1947 | aliphatische Disäurechloride, Triethanolamin, Kaliumhydroxid | Bildung von Diketenen, Ringschluss | makrocyclische Ketone | [102] |
| Blum-Aziridinsynthese | |||||
| Jochanan Blum | 1978 | Epoxide, Natriumazid, Triphenylphosphin | Ringöffnung des Epoxides, Staudinger-Reduktion, Sn2-Substitution, Ringschluss | Aziridine | [103] |
| Bobbitt-Reaktion | |||||
| James M. Bobbitt | 1965 | Benzaldehyd, 2,2-Diethoxyethylamin, Wasserstoff | nukleophiler Angriff, Wasserabspaltung, Hydrierung, Cyclokondensation, Wasserabspaltung, Hydrierung | 1,2,3,4-Tetrahydroisochinolin | [104] |
 | |||||
| Bodroux-Reaktion | |||||
| Fernand Bodroux | 1904 | Carbonsäureester, Aminomagnesiumhalogenide | Grignard-Ester-Reaktion | Amide | [105] |
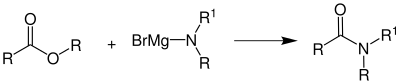 | |||||
| Bodroux-Tschitschibabin-Aldehydsynthese | |||||
| Fernand Bodroux, Alexei Tschitschibabin | 1904 | Grignard-Verbindung, Orthoameisensäuretriethylester | Acetalbildung, Eliminierung | Aldehyde | [106][107] |
 | |||||
| Boekelheide-Reaktion | |||||
| Virgil Boekelheide | 1954 | 2-Methylpyridin-N-oxid, Trifluoressigsäureanhydrid | 2-Hydroxymethylpyridin | [108] | |
 | |||||
| Boekelheide-Dipol-Ringerweiterung (Boekelheide-Fedoruk-Ringerweiterung) | |||||
| Virgil Boekelheide | 1968 | N-Dicyanomethyltriazole, DMAD | Cycloaddition | Imidazopyridine | [109] |
| Böseken-Ballio-Reaktion | |||||
| J. Böseken | 1936 | Arylaldehyde, Peressigsäure, p-Toluolsulfonsäure | Baeyer-Villiger-Oxidation | Arylacetate | [110] |
| Boger-Cycloaddition | |||||
| Dale Boger | 1984 | Cyclopropenonketale, Alkene | [2+3]-Cycloaddition | Cyclopentenone | [111] |
| Boger-Pyridinsynthese | |||||
| Dale Boger | 1981 | 1,2,4-Triazin, Dienophil | Hetero-Diels-Alder-Reaktion, Retro-Diels-Alder-Reaktion unter Stickstofffreisetzung | Pyridine | [112] |
 | |||||
| Bogert-Cook-Synthese | |||||
| Marston Taylor Bogert, J. W. Cook | 1933 | β-Phenylethylmagnesiumbromid, Cyclohexanone, konz. Schwefelsäure | Grignard-Reaktion, Cyclodehydrierung | Octahydrophenanthrene | [113] |
| Bohlmann-Rahtz-Pyridinsynthese | |||||
| Ferdinand Bohlmann, Dieter Rahtz | 1957 | Enamine, Alkinylketone | Michael-Addition, Ringschluss | Pyridine | [114] |
 | |||||
| Bohn-Schmidt-Reaktion | |||||
| René Bohn, Robert Emanuel Schmidt | 1889 | mono-Hydroxyanthrachinone, Schwefelsäure, Borsäure | oxidative Sulfatierung, Hydrolyse | Polyhydroxyanthrachinone | |
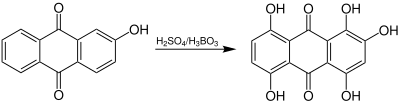 | |||||
| Boord-Olefinsynthese | |||||
| Cecil E. Boord | 1930 | Aldehyde, Säure, Ethanol, Brom, Grignard-Reagenzien, Zink | Bildung eines Enols, Bromierung, Grignard-Reaktion, reduktive Elimineriung | Alkene | [115] |
 | |||||
| Borch-reduktive Aminierung | |||||
| Richard F. Borch | 1969 | Carbonylverbindung, Amin, Natriumcyanoborhydrid | Bidung eine Imins, Reduktion | Amine | [116] |
| Borodin-Reaktion | |||||
| siehe Hunsdiecker-Reaktion | |||||
| Borsche-Beech-Aldehydsynthese | |||||
| W. Borsche, W. F. Beech | 1907/54 | aromatische Diazoniumsalze, Aldoxime | aromatische Aldehyde, Ketone | [117][118] | |
| Borsche-Berkhout-Reaktion | |||||
| Walther Borsche, A. D. Berkhout | 1904 | Phenole, Aldehyde, Säure | intramolekulare Kondensation | 1,3-Benzodioxane | [119] |
 | |||||
| Borsche-Drechsel-Cyclisierung | |||||
| E. Drechsel, Walther Borsche | 1888, 1908 | Cyclohexanon-phenylhydrazon | [3,3]-sigmatrope Umlagerung, Cyclisierung | Tetrahydrocarbazole | [120][121] |
 | |||||
| Borsche-Koelsch-Cinnolinsynthese | |||||
| Walther Borsche, C. F. Koelsch | 1941 | ortho-Aminoarylketone, salpetrige Säure | Diazotierung, Cyclisierung | 4-Hydroxycinnonline | [122][123] |
 | |||||
| Bougault-Reaktion | |||||
| J. Bougault | 1914 | β-Arylpropionsäureessigester, Diethyloxalat, Schwefelsäure | Kondensation, Ringschluss | Indene | [124] |
 | |||||
| Boulton-Katritzky-Umlagerung | |||||
| A. J. Boulton, Alan Katritzky | 1967 | Fünfring-Heterocyclen | thermische Umlagerung | Fünfring-Heterocyclen | [125] |
 | |||||
| Bouveault-Aldehyd-Synthese | |||||
| Louis Bouveault | 1904 | Alkyl-/Arylhalogenide, Lithium, Dimethylformamid | Bildung eine metallorganischen Verbindung, Addition an DMF, saure Aufarbeitung | Aldehyde | [126][127] |
 | |||||
| Bourguel-Alkinsynthese | |||||
| Maurice Bourguel | 1925 | 2,3-Dibrom-1-propen, Grignard-Reagenzien, Natriumamid | Grignard-Reaktion, Eliminierung von HBr | Alkine | [128] |
 | |||||
| Bouveault-Blanc-Reduktion | |||||
| Louis Bouveault, Gustave Louis Blanc | 1903 | Carbonsäureester, Natrium, Ethanol | Reduktion | Alkohole | [129] |
 | |||||
| Bouveault-Hansley-Prelog-Stoll-Acyloinsynthese | |||||
| siehe Hansley-Prelog-Acyloin-Kondensation | |||||
| Bouveault-Locquin-Aminosäuresynthese | |||||
| Louis Bouveault, R. Loquin | 1902 | Malonsäureester, Ethylnitrit, Wasserstoff/Raney-Nickel | Bildung eines Oxims, Reduktion | Aminosäuren | [130] |
| Boyer-Reaktion | |||||
| J. H. Boyer | 1955 | Alkylazide, Carbonylverbindungen, Säure | Schmidt-Reaktion | Amide | [131] |
| Boyland-Sims-Oxidation | |||||
| Eric Boyland, Peter Sims | 1953 | Aniline, Kaliumperoxidisulfat | Oxidation in Ortho-Position | ortho-Aminophenole | [132] |
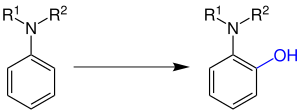 | |||||
| Brackeen-Imidazolsynthese | |||||
| Marcus Brackeen | 1994 | vicinale Tricarbonylverbindungen, Aldehyde, Ammoniumacetat | Kondensation | Imidazole | [133] |
| Bradsher-Cycloaddition | |||||
| Charles K. Bradsher | 1958 | kationische Azadiene, Dienophile | Diels-Alder-Reaktion | [134] | |
| Bradsher-Pyridiniumsalzsynthese | |||||
| Charles K. Bradsher | 1955/67 | 1-Acetonyl- oder 1-Phenacyl-2-pyridone, Säure | Cyclisierung | Oxazol[3,2-a]pyridinium, Thiooxazol[3,2-a]pyridinium oder Acridiziniumsalze | [135][136] |
| Bradsher-Reaktion | |||||
| Charles K. Bradsher | 1940 | ortho-Acyl-Diarylmethane, Säuren | säurekatalysierte Cyclodehydrierung | Anthracene | [137] |
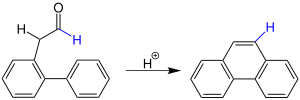 | |||||
| Brandi-Guarna-Reaktion | |||||
| Alberto Brandi, Antonio Guarna | 1986 | Alkylidencyclopropane, Nitrone bzw. Nitriloxide | Umlagerung | Tetrahydro-4-pyridone bzw. Dihydro-4-pyridone | [138][139] |
 | |||||
| Bredereck-Imidazol-Synthese | |||||
| Hellmut Bredereck | 1953 | α-Hydroxyketone, Formamid | Bildung eines Carbonsäureamides, Ringschluss unter Abspaltung von Ameisensäure | Imidazole | [140] |
 | |||||
| Breckpot-β-Lactamsynthese | |||||
| Raymond Breckpot | 1923 | β-Aminosäureester, Grignard-Reagenz | Cyclisierung | β-Lactame | [141] |
 | |||||
| Brook-Umlagerung | |||||
| Adrian G. Brook | 1958 | α-silyloxy-Carbanionen | reversible Umlagerung über ein fünffach koordiniertes Siliciumatom als Intermediat | α-silyl-Oxyanionen | [142] |
 | |||||
| Brown-Alkin-Tandemreaktion | |||||
| Charles A. Brown | 1975 | nicht-terminale Alkine, Diamin, starke Base | Isomerisierung | terminale Alkine | [143] |
| Brown-Hydroborierung | |||||
| Herbert C. Brown | 1958 | Alkene, Borane, Wasserstoffperoxid, Natriumhydroxid | Addition des Boranes, Oxidation | Alkohole | [144] |
  | |||||
| Brown-Asymmetrische-Keton-Reduktion | |||||
| Herbert C. Brown | 1985 | Ketone, Glucofuranose-9-BBN | Reduktion | Alkohole | [145] |
| Bruckner-Isochinolinsynthese | |||||
| Victor Bruckner | 1935 | 1-Allylphenylether, Distickstofftrioxid | Isochinoline | [146] | |
| Bruylants-Aminoalkylierung | |||||
| P. Bruylant | 1924 | Aldehyde, Amine, Kaliumcyanid, Grignard-Reagenz | Bildung eines α-Cyanoamins, Grignard-Reaktion | Aminoalkylverbindungen | [147] |
| Bucherer-Bergs-Reaktion | |||||
| Hans Theodor Bucherer, Hermann Bergs | 1929 | Carbonylverbindungen, Kaliumcyanid, Ammoniumcarbonat | Multikomponentenreaktion | Hydantoine | [148] |
 | |||||
| Bucherer-Carbazol-Synthese | |||||
| Hans Theodor Bucherer | 1904 | Naphthole, Arylhydrazine, Natriumhydrogensulfit | Sulfonierierung, nukleophile Substitution durch Amin, Desulfonierung, [3+3]-sigmatrope Umlagerung, Ringschluss unter Ammoniak-Abspaltung | Carbazole | [149] |
| Bucherer-Reaktion | |||||
| Hans Theodor Bucherer | 1904 | β-Naphthole, Ammoniumsulfit | β-Naphthylamine | [150] | |
 | |||||
| Buchner-Reaktion (Buchner-Ringerweiterung) | |||||
| Eduard Buchner | 1885 | Diazoessigsäureethylester, Aromaten | Bildung eines Carbens, Anlagerung eines Cylopropanringes, elektrocyclische Reaktion | Cycloheptatriene | [151] |
 | |||||
| Buchwald-Indolinsynthese | |||||
| Stephen L. Buchwald | 1991 | N-Allyl-o-haloaniline, Zirconocenmethylchlorid, Elektrophile | Bildung eines Zirconocen-Benzyl-Komplexes, Insertion der Methylgruppe, Ringschluss | Indoline, Indole | [152] |
| Buchwald-Hartwig-Kupplung | |||||
| Stephen L. Buchwald, John F. Hartwig | 1994 | Arylhalogenide, Amine, Base, Palladiumkomplex (Katalysator) | Kupplung | Aniline | [153][154] |
 | |||||
| Büchner-Curtius-Schlotterbeck-Reaktion | |||||
| Eduard Büchner, Theodor Curtius, Fritz Schlotterbeck | 1885 | Carbonnylverbindungen, aliphat. Diazoverbindungen | nukleophile Addition, Umlagerung unter N2-Abspaltung | Ketone | [155] |
 | |||||
| Burgess-Wasserabspaltung | |||||
| Edward M. Burgess | 1968 | Alkohole, Burgess-Reagenz | Eliminierung | Alkene | [156] |
 | |||||
| Burton-Trifluoromethylierung | |||||
| Donald J. Burton | 1985 | Trifluormethylcadmium/-zink, Kupfer(I)-salze, Arylhalogenide | Metathese, Kupplung | Trifluormethylaromaten | [157] |
| Butlerow-Reaktion | |||||
| Alexander Butlerow | 1861 | Formaldehyd, Calcium-Barium-Thallium-Blei-Oxide | Selbstkondensation | Zucker | [158] |
Quellen
- ↑ James H. Babler, Michael J. Coghlan: A Facile Method for the Bishomologation of Ketones to α,β-Unsaturated Aldehydes: Application to the Synthesis of the Cyclohexanoid Components of the Boll Weevil Sex Attractant. In: Synthetic Communications. 1976, Band 6, Nummer 7, S. 469–474 doi:10.1080/00397917608082626.
- ↑ George Baddeley, G. Macdonald Bennett: 72. The influence of the sulphur atom on the reactivity of adjacent atoms or groups. Part VI. Aromatic side-chain and nuclear reactivity. In: Journal of the Chemical Society. 1933, S. 261, doi:10.1039/JR9330000261.
- ↑ Hans Helmut Baer, Hermann O. L. Fischer: A new way for the synthesis of 3-amino sugars. In: Proceedings of the National Academy of Sciences of the United States of America. 1958, 44, S. 991-993 (Volltext).
- ↑ L. H. Baekeland: The Synthesis, Constitution, and Uses of Bakelite.. In: Journal of Industrial & Engineering Chemistry. 1, 1909, S. 149, doi:10.1021/ie50003a004.
- ↑ O. Manasse: Ueber eine Synthese aromatischer Oxyalkohole. In: Berichte der deutschen chemischen Gesellschaft. 27, 1894, S. 2409, doi:10.1002/cber.189402702239.
- ↑ L. Lederer: Eine neue Synthese von Phenolalkoholen. In: Journal für Praktische Chemie. 50, 1894, S. 223, doi:10.1002/prac.18940500119.
- ↑ A. Baeyer: Ueber die Verbindungen der Aldehyde mit den Phenolen. In: Berichte der deutschen chemischen Gesellschaft. 5, 1872, S. 280, doi:10.1002/cber.18720050186.
- ↑ Adolf Baeyer, Viggo Drewsen: Darstellung von Indigblau aus Orthonitrobenzaldehyd. In: Berichte der deutschen chemischen Gesellschaft. 1882, 15, S. 2856-2864, doi:10.1002/cber.188201502274.
- ↑ A. Baeyer, A. Emmerling: Synthese des Indols. In: Berichte der deutschen chemischen Gesellschaft. 2, 1869, S. 679, doi:10.1002/cber.186900201268.
- ↑ Adolf Baeyer: Synthese des Oxindols. In: Berichte der deutschen chemischen Gesellschaft. 11, 1878, S. 582, doi:10.1002/cber.187801101153.
- ↑ Adolf Baeyer: Über die Einwirkung von Dimethylsulfat auf Dimethyl-pyron. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 2337, doi:10.1002/cber.191004302198.
- ↑ Adolf Baeyer, Victor Villiger: Einwirkung des Caro'schen Reagens auf Ketone. In: Berichte der deutschen chemischen Gesellschaft. 1899, 32, 3, S. 3625-3633, doi:10.1002/cber.189903203151.
- ↑ Adolf Baeyer, Victor Villiger: Dibenzalaceton und Triphenylmethan. In: Berichte der deutschen chemischen Gesellschaft. 35, 1902, S. 3013, doi:10.1002/cber.19020350395.
- ↑ J. R. Bailey, N. H. Moore: THE USE OF CYANIC ACID IN GLACIAL ACETIC ACID. II. THE ADDITION OF CYANIC ACID ON BENZALAZINE.. In: Journal of the American Chemical Society. 39, 1917, S. 279, doi:10.1021/ja02247a011.
- ↑ J. L. Bailey: A new peptide synthesis. In: Nature. Band 164, Nummer 4177, November 1949, S. 889, PMID 15407090.
- ↑ Manuel M. Baizer: Electrolytic Reductive Coupling. In: Journal of the Electrochemical Society. 1964, Band 111, Nummer 2, S. 215 doi:10.1149/1.2426086.
- ↑ J. Campbell Earl, Alan W. Mackney: 204. The action of acetic anhydride on N-nitrosophenylglycine and some of its derivatives. In: Journal of the Chemical Society. 1935, S. 899, doi:10.1039/jr9350000899.
- ↑ Wilson Baker, W. D. Ollis: Meso-ionic compounds. In: Quarterly Reviews, Chemical Society. 11, 1957, S. 15, doi:10.1039/qr9571100015.
- ↑ Wilson Baker: Molecular rearrangement of some o-acyloxyacetophenones and the mechanism of the production of 3-acylchromones. In: Journal of the Chemical Society. 1933, S. 1381–1389, doi:10.1039/JR9330001381; H. S. Mahal, K. Venkataraman: Synthetical experiments in the chromone. group. XIV. Action of sodamide on 1-acyloxy-2-acetonaphthones. In: Journal of the Chemical Society. 1934, S. 1767–1769, doi:10.1039/JR9340001767.
- ↑ Alexandru T. Balaban, Costin D. Nenitzescu: Aluminiumchlorid-Katalysen, XXVII Eine Synthese von Pyryliumsalzen aus Säurechloriden und Olefinen. In: Justus Liebigs Annalen der Chemie. 625, 1959, S. 74, doi:10.1002/jlac.19596250110.
- ↑ S. Ball, T. W. Goodwin, R. A. Morton: Studies on vitamin A. In: Biochemical Journal. 42, 1948, S. 516, doi:10.1042/bj0420516.
- ↑ Oscar Bally: Ueber eine neue Synthese in der Anthracenreihe und über neue Küpenfarbstoffe. In: Berichte der deutschen chemischen Gesellschaft. 1905, 38, 1, S. 194-196, doi:10.1002/cber.19050380137.
- ↑ M. Balsohn: Bull. Soc. Chim. France., 1879, 31, S. 539.
- ↑ Günther Balz, Günther Schiemann: In Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung, Chemische Berichte 1927, 5, 1186–1190, doi:10.1002/cber.19270600539.
- ↑ E. Bamberger, B. Berlé: Aufspaltung des Imidazolrings. In: Justus Liebig's Annalen der Chemie. 273, 1893, S. 342, doi:10.1002/jlac.18932730216.
- ↑ Eugen Bamberger: Ueber das Phenylhydroxylamin. In: Berichte der deutschen chemischen Gesellschaft. 1894, 27, 2, S. 1548-1557, doi:10.1002/cber.18940270276.
- ↑ Eug. Bamberger, E. Wheelwright: Ueber die Einwirkung von Diazobenzol auf Acetessigäther. In: Berichte der deutschen chemischen Gesellschaft. 25, 1892, S. 3201, doi:10.1002/cber.189202502175.
- ↑ W. R. Bamford, T. S. Stevens: The decomposition of toluene-p-sulphonylhydrazones by alkali. In: Journal of the Chemical Society. 1952, S. 4735-4740, doi:10.1039/JR9520004735.
- ↑ Juan M Betancort, Kandasamy Sakthivel, Rajeswari Thayumanavan, Carlos F Barbas: Catalytic enantioselective direct Michael additions of ketones to alkylidene malonates. In: Tetrahedron Letters. 42, 2001, S. 4441, doi:10.1016/S0040-4039(01)00793-6.
- ↑ Benjamin List, Peter Pojarliev, Harry J. Martin: Efficient Proline-Catalyzed Michael Additions of Unmodified Ketones to Nitro Olefins. In: Organic Letters. 3, 2001, S. 2423, doi:10.1021/ol015799d.
- ↑ Philippe Barbier: Synthèse du diméthylhéptenol. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1899, 128, S. 110-111 (Text bei Gallica).
- ↑ Heinrich Wieland: Über Hydrierung und Dehydrierung. In: Berichte der deutschen chemischen Gesellschaft. 45, 1912, S. 484–493, doi:10.1002/cber.19120450171.
- ↑ Philippe Barbier, R. Locquin: Dégradation méthodique de divers acides saturés mono et bibasiques. In: Comptes rendus. 1913, 156, S. 1443-1446 (Volltext bei Gallica).
- ↑ Jogendra C. Bardhan, Suresh C. Sengupta: 374. Resin acids. Part I. Synthesis of phenanthrene hydrocarbons derived from d-pimaric acid, and a new route to phenanthrene. In: Journal of the Chemical Society. 1932, S. 2520, doi:10.1039/JR9320002520.
- ↑ G. Bargellini. In: Gazz. Chim. Ital. 1906, 36, 329.
- ↑ José Barluenga, Patrícia Moriel, Carlos Valdés, Fernando Aznar: N‐Tosylhydrazones as Reagents for Cross‐Coupling Reactions: A Route to Polysubstituted Olefins. In: Angewandte Chemie. 2007, Band 119, Nummer 29, S. 5683–5686 doi:10.1002/ange.200701815.
- ↑ Vincent C. Barry: Regulated Degradation of 1.3 Polysaccharides. In: Nature. 152, 1943, S. 537, doi:10.1038/152537b0.
- ↑ Giuseppe Bartoli, Rino Leardini, Alessandro Medici, Goffredo Rosini: Reactions of nitroarenes with Grignard reagents. General method of synthesis of alkyl-nitroso-substituted bicyclic aromatic systems. In: J. Chem. Soc., Perkin Trans. 1. 1978, S. 692-696, doi:10.1039/P19780000692.
- ↑ Derek H. R. Barton, Neerja Yadav Bhatnagar, Jean-Claude Blazejewski, Brigitte Charpiot, Jean-Pierre Finet, David J. Lester, William B. Motherwell, M. Teresa Barros Papoula, Stephen P. Stanforth: Pentavalent organobismuth reagents. Part 2. The phenylation of phenols. In: Journal of the Chemical Society, Perkin Transactions 1. 1985, S. 2657, doi:10.1039/P19850002657.
- ↑ Derek H. R. Barton, Gerhard Bringmann, Geneviève Lamotte, William B. Motherwell, Robyn S. Hay Motherwell, Alexander E. A. Porter: Reactions of relevance to the chemistry of aminoglycoside antibiotics. Part 14. A useful radical-deamination reaction. In: Journal of the Chemical Society, Perkin Transactions 1. 1980, S. 2657, doi:10.1039/P19800002657.
- ↑ Derek H. R. Barton, David Crich, William B. Motherwell: New and improved methods for the radical decarboxylation of acids. In: J. Chem. Soc., Chem. Commun. 1983, S. 939-941, doi:10.1039/C39830000939.
- ↑ Derek H. R. Barton, Stuart W. McCombie: A new method for the deoxygenation of secondary alcohols. In: J. Chem. Soc., Perkin Trans. 1. 1975, S. 1574-1585, doi:10.1039/P19750001574.
- ↑ D. H. R. Barton, B. J. Willis: Olefin synthesis by twofold extrusion processes. In: Journal of the Chemical Society D: Chemical Communications. 1970, S. 1225, doi:10.1039/C29700001225.
- ↑ Richard M. Kellogg, Siek Wassenaar: Thiocarbonyl ylides. An approach to "tetravalent sulfur" compounds. In: Tetrahedron Letters. 11, 1970, S. 1987–1990, doi:10.1016/S0040-4039(01)98134-1.
- ↑ D. H. R. Barton, J. M. Beaton, L. E. Geller, M. M. Pechet: A new photochemical reaction. In: J. Am. Chem. Soc. 1960, 82, 10, S. 2640–2641, doi:10.1021/ja01495a061.
- ↑ Derek H. R. Barton, Samir Z. Zard: A new synthesis of pyrroles from nitroalkenes. In: J. Chem. Soc., Chem. Commun. 1985, S. 1098-1100, doi:10.1039/C39850001098.
- ↑ Patent DE250264: Verfahren zur Datstellung von organischen Arsenverbindungen. Veröffentlicht am 8. Januar 1910, Erfinder: Heinrich Bart.
- ↑ Patent DE254421: Verfahren zur Darstellung von aromatischen Stibinsäuren. Veröffentlicht am 11. August 1911, Erfinder: Heinrich Bart.
- ↑ A. N. Bashkirov, V. Kamzolkin: Synthesis of Higher Aliphatic Alcohols by Direct Oxidation of Paraffinic Hydrocarbons. In: Proc. World Pet. Cong., 4, 1959, S. 175–183 (Abstract).
- ↑ Andrew D. Batcho, Willy Leimgruber: Third International Congress of Heterocyclic Chemistry. Japan, 1971, S. 462.
- ↑ Oskar Baudisch: Einfache Bildung von o-Nitrosophenol aus Benzol und Hydroxylamin durch Luftoxydation. Präparative Darstellung von o-Nitrosophenol und Nitrosocresol aus Benzol bzw. Toluol durch H2O2 Oxydation. In: Die Naturwissenschaften. 27, 1939, S. 768–769, doi:10.1007/BF01498121.
- ↑ E. Baumann, E. Fromm: Ueber einige Derivate des Thiophens. In: Berichte der deutschen chemischen Gesellschaft. 28, 1895, S. 890, doi:10.1002/cber.189502801195.
- ↑ Henry E. Baumgarten, Frank A. Bower: Reactions of Amines. I. A Novel Rearrangement of N,N-Dichloro-sec-alkylamines. In: Journal of the American Chemical Society. 76, 1954, S. 4561, doi:10.1021/ja01647a016.
- ↑ K. Morita, Z. Suzuki und H. Hiros: Bull. Chem. Soc. Jpn.,1968, 41, S. 2815; Anthony B. Baylis, Melville E. D. Hillman, Deutsches Patent 2155113, 1972.
- ↑ Antoine Béchamp: De l'action des protosels de fer sur la nitronaphtaline et la nitrobenzine. nouvelle méthode de formation des bases organiques artificielles de Zinin. In: Annales de chimie et de physique. 1854, 42, S. 186-196 (Volltext).
- ↑ Ernst Beckmann: Zur Kenntniss der Isonitrosoverbindungen. In: Berichte der deutschen chemischen Gesellschaft. 1886, 19, 1, S. 988-993, doi:10.1002/cber.188601901222.
- ↑ A. Werner, A. Piguet: 660. Beckmann'sche Umlagerung durch Benzolsulfonsäurechlorid bei Gegenwart von Alkali oder Pyridin. In: Berichte der Deutschen Chemischen Gesellschaft. 1904, Band 37, Nummer 4, S. 4295–4315 doi:10.1002/cber.19040370407.
- ↑ Paul Z. Bedoukian: A New Synthesis of α-Bromoaldehydes. In: Journal of the American Chemical Society. 66, 1944, S. 1325, doi:10.1021/ja01236a037.
- ↑ Auguste Béhal, Marcel Sommelet: Méthode de synthèse des aldéhydes. In: Bull. Soc. chim. France. 1904, 31, S. 300 (Digitalisat auf Gallica).
- ↑ Roger Malherbe, Daniel Belluš: A New Type of Claisen Rearrangement Involving 1,3-Dipolar Intermediates. Preliminary communication. In: Helvetica Chimica Acta. 61, 1978, S. 3096, doi:10.1002/hlca.19780610836.
- ↑ B. P. Belousov: Периодически действующая реакция и ее механизм. [Periodically acting reaction and its mechanism]. In: Сборник рефератов по радиационной медицине. 1959 147, S. 145.
- ↑ A. M. Zhabotinsky: Периодический процесс окисления малоновой кислоты растворе [Periodical process of oxidation of malonic acid solution]. In: Биофизика. 1964 9, S. 306–311.
- ↑ Makhluf J. Haddadin, Costas H. Issidorides: Application of Benzofurazan Oxide to the Synthesis of Heteroaromatic N-Oxides. In: Heterocycles. 1976, 4, S. 767-816, doi:10.3987/R-1976-04-0767.
- ↑ Matthias Beller, Markus Eckert, Frank Vollmüller, Sandra Bogdanovic, Holger Geissler: Die palladiumkatalysierte Amidocarbonylierung — eine neue effiziente Synthese von N-Acylaminosäuren. In: Angewandte Chemie. 109, 1997, S. 1534, doi:10.1002/ange.19971091320.
- ↑ Erich Bénary: Über die Acylierung des β-Amino-crotonsäureesters und verwandter Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 3912, doi:10.1002/cber.190904203147.
- ↑ Robert A. Benkeser, Robert E. Robinson, Herbert Landesman: The True Identity of the Solvated Free Radical “Triphenylsilicyl Ethylammine.” The Multiple Addition of Lithium to an Aromatic System in Ethylamine. In: J. Am. Chem. Soc. 1952, 74, 22, S. 5699–5701, doi:10.1021/ja01142a041.
- ↑ Glenn Berchtold: Communications- The Reaction of Enamines of Cyclic Ketones with Isocyanates. In: The Journal of Organic Chemistry. 26, 1961, S. 3043, doi:10.1021/jo01066a647.
- ↑ Patent DE301231: Verfahren zur Herstellung von flüssigen oder löslichen organischen Verbindungen aus Steinkohle u. dgl.. Angemeldet am 9. August 1913, veröffentlicht am 26. November 1919, Anmelder: Friedrich Bergius und John Billwiller, Erfinder: Friedrich Bergius und John Billwiller.
- ↑ F. Marshall Beringer, Arthur Brierley, Milton Drexler, E. Melvin Gindler, Charles C. Lumpkin: Diaryliodonium Salts. II. The Phenylation of Organic and Inorganic Bases1,2. In: Journal of the American Chemical Society. 1953, Band 75, Nummer 11, S. 2708–2712 doi:10.1021/ja01107a047.
- ↑ Suk-Ku Kang, Sang-Ho Lee, Duckhee Lee: Copper-Catalyzed 'N-Arylation of Amines with Hypervalent Iodonium Salts. In: Synlett. 2000, Band 2000, Nummer 07, S. 1022–1024 doi:10.1055/s-2000-6673.
- ↑ August Bernthsen: Die Acridine. In: Justus Liebigs Annalen der Chemie. 1884, 224, 1, S. 1-56, doi:10.1002/jlac.18842240102.
- ↑ Richard R. Jones, Robert G. Bergman: p-Benzyne. Generation as an intermediate in a thermal isomerization reaction and trapping evidence for the 1,4-benzenediyl structure. In: Journal of the American Chemical Society. Band 94, Nr. 2, 1972, S. 660–661
- ↑ M. Bergmann: Synthesis and degradation of proteins in the laboratory and in metabolism. In: Science. 79, 1934, S. 439, doi:10.1126/science.79.2055.439.
- ↑ Max Bergmann, Ferdinand Stern, Charlotte Witte: Über neue Verfahren der Synthese von Dipeptiden und Dipeptid-Anhydriden. In: Justus Liebig's Annalen der Chemie. 449, 1926, S. 277, doi:10.1002/jlac.19264490116.
- ↑ Max Bergmann, Leonidas Zervas: Über ein allgemeines Verfahren der Peptid-Synthese. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 65, 1932, S. 1192–1201, doi:10.1002/cber.19320650722.
- ↑ Vincent Lavallo, John Mafhouz, Yves Canac, Bruno Donnadieu, Wolfgand W. Schoeller, Guy Bertrand: Synthesis, Reactivity, and Ligand Properties of a Stable Alkyl Carbene. In: Journal of the American Chemical Society. 126, 2004, S. 8670, doi:10.1021/ja047503f.
- ↑ G. C. Welch, R. R. S. Juan, J. D. Masuda, D. W. Stephan: Reversible, Metal-Free Hydrogen Activation. In: Science. 314, 2006, S. 1124, doi:10.1126/science.1134230.
- ↑ Giancarlo Berti: The Pyrolysis of Sulfites. III. Methyl Alkyl Sulfites. A New Method for the Preparation of Olefins. In: Journal of the American Chemical Society. 76, 1954, S. 1213, doi:10.1021/ja01634a003.
- ↑ J. Bertram, H. Walbaum: Uber Isoborneol. In: Journal für Praktische Chemie. 49, 1894, S. 1, doi:10.1002/prac.18940490101.
- ↑ M. Betti: In: Gazz. Chim. Ital. 30 II, 199, S. 301.
- ↑ J.F. Biellmann, J.B. Ducep: Synthèse du squalène et d'analogues. In: Tetrahedron. 27, 1971, S. 5861, doi:10.1016/S0040-4020(01)91751-X.
- ↑ Pietro Biginelli: Ueber Aldehyduramide des Acetessigäthers. In: Berichte der deutschen chemischen Gesellschaft. 1891, 24, 1, S. 1317-1319, doi:10.1002/cber.189102401228.
- ↑ Carsten Bingel: Cyclopropanierung von Fullerenen. In: Chemische Berichte. 1993, Band 126, Nummer 8, S. 1957–1959 doi:10.1002/cber.19931260829.
- ↑ Carsten Bingel: Cyclopropanierung von Fullerenen. In: Chemische Berichte. 1993, Band 126, Nummer 8, S. 1957–1959 doi:10.1002/cber.19931260829.
- ↑ Xavier Camps, Andreas Hirsch: Efficient cyclopropanation of C60 starting from malonates. In: Journal of the Chemical Society. Perkin transactions I/Journal of the Chemical Society. Perkin transactions. I. 1997, Nummer 11, S. 1595–1596 doi:10.1039/A702055D.
- ↑ Arthur J. Birch: Reduction by dissolving metals. Part I. In: Journal of the Chemical Society (Resumed). 1944, S. 430-436, doi:10.1039/JR9440000430.
- ↑ Lothar Birckenbach, Josef Goubeau: Pseudohalogene, XVIII. Mitteil.: Die Reaktion Silberperchlorat und Jod in organischen Medien: Eine neue Methode der Jod-Substitution. In: Berichte der deutschen chemischen Gesellschaft. 65, 1932, S. 395, doi:10.1002/cber.19320650307.
- ↑ K. Birnbaum: Ueber die Zersetzung des Silberacetats durch Jod und durch höhere Temperatur. In: Annalen der Chemie und Pharmacie. 152, 1869, S. 111, doi:10.1002/jlac.18691520111.
- ↑ Angelo Simonini: Über den Abbau der fetten Säuren zu kohlenstoffärmeren Alkoholen. In: Monatshefte für Chemie. 13, 1892, S. 320, doi:10.1007/BF01523646.
- ↑ Aug. Bischler: Ueber Orthonitrophenylhydrazin. In: Berichte der deutschen chemischen Gesellschaft. 22, 1889, S. 2801, doi:10.1002/cber.188902202183.
- ↑ Richard Möhlau: Ueber die Einwirkung primärer aromatischer Aminbasen auf Acetophenonbromid. In: Berichte der deutschen chemischen Gesellschaft. 1881, 14, 1, S. 171-175, doi:10.1002/cber.18810140146; August Bischler, P. Fireman: Zur Kenntniss einiger α-β-Diphenylindole. In: Berichte der deutschen chemischen Gesellschaft. 1893, 26, 2, S. 1336-1349, doi:10.1002/cber.18930260232.
- ↑ August Bischler, Bernard Napieralski: Zur Kenntniss einer neuen Isochinolinsynthese. In: Berichte der deutschen chemischen Gesellschaft. 1893, 26, 2, S. 1903-1908, doi:10.1002/cber.189302602143.
- ↑ T. Howard Black, Steven M. Arrivo, Jeffry S. Schumm, John M. Knobeloch: 4-(Dimethylamino)pyridine as a catalyst for carbon acylation. 2. Control of carbon vs. oxygen acylation in benzofuranones. In: The Journal of Organic Chemistry. 52, 1987, S. 5425, doi:10.1021/jo00233a022.
- ↑ E. E. Blaise; A. Koehler: Synthèse au moyen des dérivés organo-métalliques mixtes du zinc (II). In: Bulletin de la Société chimique de France. 1910, 41, S. 215 –227 (Digitalisat auf Gallica).
- ↑ E. E. Blaise, M. Maire: Synthèses au moyen des dèrivès organo-métalliques mixtes du zinc. Cétones non saturées αβ-acycliques. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1907, 145, S. 73 (Digitalisat auf Gallica).
- ↑ E.E. Blaise: Nouvelles réactions des dérivés organo-métalliques (II) - Éthers α-alcoyl-β-cetonique. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1901, 132, S. 478-480 (Volltext).
- ↑ Gustave Louis Blanc in: Bull. Soc. Chim. France. 33, 1923, S. 313.
- ↑ H. G. Blanc: Sur une nouvelle méthode de la cyclisation des acides adipiques et pímeliques substitués. In: Comptes rendu. 144, 1907, S. 1356 (Digitalisat auf Gallica).
- ↑ Hans‐Ulrich Blaser, Alwyn Spencer: The palladium-catalysed arylation of activated alkenes with aroyl chlorides. In: Journal of organometallic chemistry. 1982, Band 233, Nummer 2, S. 267–274 doi:10.1016/S0022-328X(00)82707-2.
- ↑ F. F. Blicke, H. C. Godt: Reactions of 1,3-Dimethyl-5,6-diaminouracil. In: Journal of the American Chemical Society. 1954, Band 76, Nummer 10, S. 2798–2800 doi:10.1021/ja01639a058.
- ↑ Irwin J. Pachter: Pteridines. II. Synthesis of 6-Substituted 7-Aminopteridines from Aldehydes. In: Journal of organic chemistry. 1963, Band 28, Nummer 5, S. 1191–1196 doi:10.1021/jo01040a007.
- ↑ A. T. Blomquist, R. D. Spencer: A new synthetic method for many-membered carbon rings. In: Journal of the American Chemical Society. 69, 1947, S. 472, doi:10.1021/ja01194a516.
- ↑ Ytzhak Ittah, Yoel Sasson, Israel Shahak, Shalom Tsaroom, Jochanan Blum: A new aziridine synthesis from 2-azido alcohols and tertiary phosphines. Preparation of phenanthrene 9,10-imine. In: J. Org. Chem. 1978, 43 22, S. 4271–4273, doi:10.1021/jo00416a003.
- ↑ J. M. Bobbitt, Judith McNew Kiely, K. L. Khanna, R. Ebermann: Synthesis of Isoquinolines. III. A New Synthesis of 1,2,3,4-Tetrahydroisoquinolines. In: The Journal of Organic Chemistry. 30, 1965, S. 2247, doi:10.1021/jo01018a030.
- ↑ F. Bodroux: Nouvelle methode de preparation des anilides. In: Comptes Rendus. Band 138, 1904, S. 1427–1429 (Digitalisat auf Gallica).
- ↑ F. Boudroux: Synthése d'aldehydes aromatiques. In: Comptes Rendus. 138, 1904, S. 92-94 (Digitalisat auf Gallica)
- ↑ A. E. Tschitschibabin: Eine neue allgemeine Darstellungsmethode der Aldehyde. In: Berichte der deutschen chemischen Gesellschaft. 37, 1904, S. 186, doi:10.1002/cber.19040370133.
- ↑ V. Boekelheide, W. J. Linn: Rearrangements of N-Oxides. A Novel Synthesis of Pyridyl Carbinols and Aldehydes. In: J. Am. Chem. Soc. 1954, 76, 5, S. 1286–1291, doi:10.1021/ja01634a026.
- ↑ V. Boekelheide, N. A. Fedoruk: Syntheses of fused aromatic heterocycles by 1,3-dipolar addition reactions. 1,3a-Diazapentalenes. In: Journal of the American Chemical Society. 1968, Band 90, Nummer 14, S. 3830–3834 doi:10.1021/ja01016a042.
- ↑ J. Böeseken, Jeroen Jacobs: L'oxydation par les Peracides de la Double Liaison à Côté D'un Groupe Carbonyle. In: Recueil des travaux chimiques des Pays-Bas. 1936, Band 55, Nummer 9, S. 786–790 doi:10.1002/recl.19360550909.
- ↑ Dale L. Boger, Christine E. Brotherton: An effective, thermal three-carbon + two-carbon cycloaddition for cyclopentenone formation: formal 1,3-dipolar cycloaddition of cyclopropenone ketals. In: Journal of the American Chemical Society. 1984, Band 106, Nummer 3, S. 805–807 doi:10.1021/ja00315a065.
- ↑ Dale L. Boger, James S. Panek: Diels-Alder reaction of heterocyclic azadienes. I. Thermal cycloaddition of 1,2,4-triazine with enamines: simple preparation of substituted pyridines. In: J. Org. Chem. 1981, 46, 10, S. 2179–2182, doi:10.1021/jo00323a044.
- ↑ Marston Taylor Bogert: A new process for the synthesis of phenanthrene and of phenanthrene derivates. In: Science. 1933, 77, S. 289, doi:10.1126/science.77.1994.289; J. W. Cook, C. L. Hewett: The synthesis of compounds related to the sterols, bile acids, and oestrus-producing hormones. Part I. 1 : 2-cycloPentenophenanthrene. In: Journal of the Chemical Society (Resumed). 1933, S. 1098-1112, doi:10.1039/JR9330001098.
- ↑ Ferdinand Bohlmann, Dieter Rahtz: Über eine neue Pyridinsynthese. In: Chemische Berichte. 90, 1957, S. 2265, doi:10.1002/cber.19570901021.
- ↑ Lloyd C. Swallen, Cecil E. Boord: The synthesis of beta-bromo-alkyl ethers and their use in further synthesis. In: J. Am. Chem. Soc. 1930, 52, 2, S. 651–660, doi:10.1021/ja01365a033.
- ↑ Richard F. Borch, H. Dupont Durst: Lithium cyanohydridoborate, a versatile new reagent. In: Journal of the American Chemical Society. 91, 1969, S. 3996, doi:10.1021/ja01042a078.
- ↑ W. Borsche: α-Diketone aus α-Ketoaldoximen, eine neue Synthese mit Hilfe der Diazoverbindungen. In: Berichte der deutschen chemischen Gesellschaft. 40, 1907, S. 737, doi:10.1002/cber.190704001109.
- ↑ W. F. Beech: Preparation of aromatic aldehydes and ketones from diazonium salts. In: Journal of the Chemical Society. 1954, S. 1297, doi:10.1039/JR9540001297.
- ↑ W. Borsche, A. D. Berkhout: Ueber die Einwirkung von Formaldehyd auf p-Nitrophenole. In: Justus Liebig's Annalen der Chemie. 330, 1904, S. 82, doi:10.1002/jlac.19043300107.
- ↑ E. Drechsel: Ueber Elektrolyse des Phenols mit Wechselströmen. In: Journal für Praktische Chemie. 38, 1888, S. 65, doi:10.1002/prac.18880380105.
- ↑ W. Borsche: Ueber Tetra- und Hexahydrocarbazolverbindungen und eine neue Carbazolsynthese. (Mitbearbeitet von. A. Witte und W. Bothe.). In: Justus Liebig's Annalen der Chemie. 359, 1908, S. 49, doi:10.1002/jlac.19083590103.
- ↑ Walther Borsche, Alfred Herbert: Synthesen mit 5-Nitro-2-brom-acetophenon. In: Justus Liebig's Annalen der Chemie. 546, 1941, S. 293, doi:10.1002/jlac.19415460306.
- ↑ C. F. Koelsch: An indole aynthesis from a m-carboxyphenylhydrazone. In: The Journal of Organic Chemistry. 08, 1943, S. 295, doi:10.1021/jo01192a001.
- ↑ J. Bougault: Sur les acides indène-carbonique et hydrindène-dicarbonique. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1914, 159, S. 745 (Digitalisat auf Gallica).
- ↑ A.J. Boulton, A.R. Katritzky: N-Oxides and related compounds. Part XXII*). The rearrangement of 4-nitrobenzofuroxans to 7-nitrobenzofuroxans. In: Rev. Roum. Chim., 1962, 7, S. 691-697.
- ↑ L. Bouveault: Modes de formation et de préparation des aldéhydes saturées de la série grasse. In: Bulletin de la Société chimique de Paris. XXXI, 1904, S. 1306–1322 (Digitalisat auf Gallica).
- ↑ L. Bouveault: Nouvelle méthode générale synthétique de préparation des aldéhydes. In: Bulletin de la Société chimique de Paris. XXXI, 1904, S. 1322–1327 (Digitalisat auf Gallica).
- ↑ Maurice Bourguel: In: Annales de chemie. 3, 1925, S. 325.
- ↑ Louis Bouveault, Gustave Louis Blanc: Préparation des alcools primaires au moyen des acides correspondants. In: Comptes rendus de l’Académie des sciences. 1903, 136, S. 1676-1678, Digitalisat auf Gallica.
- ↑ Louis Bouveault, R. Loquin: Action de l'acide nitreux, en solution acide, sur les éthers β-cétoníques α substitués; synthèse des homologues de l'acide pyruvique. In: Comptes rendus de l’Académie des sciences. 135, 1902, S. 179 (Digitalisat auf Gallica)
- ↑ J. H. Boyer, Jan Hamer: The Acid-catalyzed Reaction of Alkyl Azides upon Carbonyl Compounds1. In: Journal of the American Chemical Society. 1955, Band 77, Nummer 4, S. 951–954 doi:10.1021/ja01609a045.
- ↑ E. Boyland, D. Manson, Peter Sims: 729. The preparation of o-aminophenyl sulphates. In: Journal of the Chemical Society. 1953, S. 3623, doi:10.1039/jr9530003623.
- ↑ Marcus Brackeen, Jeffrey A. Stafford, Paul L. Feldman, Donald S. Karanewsky: An efficient and mild synthesis of highly substituted imidazoles. In: Tetrahedron letters. 1994, Band 35, Nummer 11, S. 1635–1638 doi:10.1016/0040-4039(94)88306-8.
- ↑ C. K. Bradsher, T. W. G. Solomons: Acridizinium Ion Chemistry. II. The Diels-Alder Reaction. In: Journal of the American Chemical Society. 80, 1958, S. 933, doi:10.1021/ja01537a045.
- ↑ Charles K. Bradsher, Leo E. Beavers: Aromatic Cyclodehydration. XXX. Acridizinium Salts1. In: Journal of the American Chemical Society. 1955, Band 77, Nummer 18, S. 4812–4813 doi:10.1021/ja01623a036.
- ↑ Charles K. Bradsher, Mary F. Zinn: Oxazolo[3,2-a]pyridinium salts. In: Journal of heterocyclic chemistry. 1967, Band 4, Nummer 1, S. 66–70 doi:10.1002/jhet.5570040111.
- ↑ Charles K. Bradsher: A New Route to 9-Alkyl- and 9-Arylanthracenes. In: J. Am. Chem. Soc. 1940, 62, 3, S. 486–488, doi:10.1021/ja01860a006.
- ↑ A. Brandi, A. Guarna, A. Goti, F. De Sarlo: Rearrangement of nitrone cycloadducts to methylene cyclopropane. Synthesis of indolizidine and quinolizidine derivatives.. In: Tetrahedron Letters. 27, 1986, S. 1727, doi:10.1016/S0040-4039(00)84358-0.
- ↑ Antonio Guarna, Alberto Brandi, Francesco De Sarlo, Andrea Goti, Fabio Pericciuoli: Rearrangement of isoxazoline-5-spiro derivatives. 1. Synthesis of 4,5-dihydroisoxazole-5-spirocyclopropanes and their rearrangement to 5,6-dihydro-4-pyridones. In: The Journal of Organic Chemistry. 53, 1988, S. 2426, doi:10.1021/jo00246a007.
- ↑ Hellmut Bredereck, Gerhard Theilig: Imidazolsynthesen mit Formamid (Formamid‐Reaktionen, I. Mitteil.). In: Chemische Berichte. 1953, Band 86, Nummer 1, S. 88–96 doi:10.1002/cber.19530860117.
- ↑ R. Breckpot: Bull. Soc. Chim. Belg. 1923, 32, S. 412.
- ↑ A. G. Brook: Isomerism of Some α-Hydroxysilanes to Silyl Ethers. In: J. Am. Chem. Soc. 1958, 80, 8, S. 1886–1889, doi:10.1021/ja01541a026.
- ↑ Charles A. Brown, Ayako Yamashita: Saline hydrides and superbases in organic reactions. IX. Acetylene zipper. Exceptionally facile contrathermodynamic multipositional isomeriazation of alkynes with potassium 3-aminopropylamide. In: Journal of the American Chemical Society. 1975, Band 97, Nummer 4, S. 891–892 doi:10.1021/ja00837a034.
- ↑ Herbert C. Brown, Paul A. Tierney: The Reaction of Lewis Acids of Boron with Sodium Hydride and Borohydride. In: J. Am. Chem. Soc. 1958, 80, 7, S. 1552–1558, doi:10.1021/ja01540a011.
- ↑ Herbert C. Brown, Ganesh G. Pai: Selective reductions. 37. Asymmetric reduction of prochiral ketones with B-(3-pinanyl)-9-borabicyclo[3.3.1]nonane. In: Journal of organic chemistry. 1985, Band 50, Nummer 9, S. 1384–1394 doi:10.1021/jo00209a008.
- ↑ Viktor Bruckner: Über die Verwendung der Pseudo-nitrosite propenyl-haltiger Phenol-äther zur Synthese von α-arylierten β-Hydroxylamino-und β-Amino-propanolen. Neue Beiträge zur Kenntnis der Acylwanderungen. Methyl-isoeugenol- und Isosafrol-Derivate. In: Justus Liebig's Annalen der Chemie. 518, 1935, S. 226, doi:10.1002/jlac.19355180114.
- ↑ P. Bruylants: In: Bull. Soc. Chim. Belg. 1924, 33, S. 467-478.
- ↑ Patent DE566094: Verfahren zur Darstellung von Hydantoinen. Angemeldet am 26. Mai 1929, Erfinder: Hermann Bergs (Bergs war Chemiker bei I.G.Farben).
- ↑ Hans Th. Bucherer: Über die Einwirkung schwefligsaurer Salze auf aromatische Amido- und Hydroxylverbindungen. In: Journal für Praktische Chemie. 69, 1904, S. 49, doi:10.1002/prac.19040690105.
- ↑ Hans Th. Bucherer: Über die Einwirkung schwefligsaurer Salze auf aromatische Amido- und Hydroxylverbindungen. In: Journal für Praktische Chemie. 1904, 69, S. 49-91, doi:10.1002/prac.19040690105.
- ↑ Eduard Buchner: Ueber Pseudophenylessigsäure. In: Berichte der deutschen chemischen Gesellschaft. 29, 1896, S. 106–109, doi:10.1002/cber.18960290121.
- ↑ Jeffrey H. Tidwell, Dwayne R. Senn, Stephen L. Buchwald: Synthesis of 3,4-disubstituted indoles via a sequential olefin-insertion/ene route. In: Journal of the American Chemical Society. 113, 1991, S. 4685, doi:10.1021/ja00012a050.
- ↑ Frederic Paul, Joe Patt, John F. Hartwig: Palladium-catalyzed formation of carbon-nitrogen bonds. Reaction intermediates and catalyst improvements in the hetero cross-coupling of aryl halides and tin amides. In: Journal of the American Chemical Society. 116, 1994, S. 5969–5970, doi:10.1021/ja00092a058.
- ↑ Anil S. Guram, Stephen L. Buchwald: Palladium-Catalyzed Aromatic Aminations with in situ Generated Aminostannanes. In: Journal of the American Chemical Society. 116, 1994, S. 7901–7902, doi:10.1021/ja00096a059.
- ↑ E. Buchner, Th. Curtius: Synthese von Ketonsäureäthern aus Aldehyden und Diazoessigäther. In: Berichte der deutschen chemischen Gesellschaft. 1885, 18, 2, S. 2371-2377, doi:10.1002/cber.188501802118; Fritz Schlotterbeck: Umwandlung von Aldehyden in Ketone durch Diazomethan. In: Berichte der deutschen chemischen Gesellschaft. 1907, 40, 1, S. 779-783, doi:10.1002/cber.19070400179.
- ↑ George M. Atkins, Edward M. Burgess: The reactions of an N-sulfonylamine inner salt. In: Journal of the American Chemical Society. 90, 1968, S. 4744, doi:10.1021/ja01019a052.
- ↑ Donald J. Burton, Denise M. Wiemers: A remarkably simple preparation of (trifluoromethyl)cadmium and -zinc reagents directly from difluorodihalomethanes. In: Journal of the American Chemical Society. 1985, Band 107, Nummer 17, S. 5014–5015 doi:10.1021/ja00303a042.
- ↑ A. Butlerow: Bildung einer zuckerartigen Substanz durch Synthese. In: Justus Liebigs Annalen der Chemie. 1861, Band 120, Nummer 3, S. 295–298 doi:10.1002/jlac.18611200308.




