„Uran(VI)-fluorid“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
JWBE (Diskussion | Beiträge) →Eigenschaften: nichtzutreffendes entfernt | JWBE (Diskussion | Beiträge) erweitert | ||
| (4 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie | {{Infobox Chemikalie | ||
| Strukturformel = [[Datei:Uranium-hexafluoride-2D.png|125px|Struktur von Uranhexafluorid]] | | Strukturformel = [[Datei:Uranium-hexafluoride-2D.png|125px|Struktur von Uranhexafluorid]] | ||
| Kristallstruktur = | |||
| Kristallsystem = orthorhombisch | |||
| Raumgruppe = Pnma | |||
| Gitterkonstanten = ''a'' = 990,0 pm<br/>''b'' = 896,2 pm<br/>''c'' = 520,7 pm<ref name="Levy"/> | |||
| Koordinationszahlen = | |||
| Andere Namen = | | Andere Namen = | ||
| Summenformel = UF<sub>6</sub> | | Summenformel = UF<sub>6</sub> | ||
| Zeile 8: | Zeile 13: | ||
| Molare Masse = 351,99 g·[[mol]]<sup>−1</sup> | | Molare Masse = 351,99 g·[[mol]]<sup>−1</sup> | ||
| Aggregat = fest | | Aggregat = fest | ||
| Dichte = 5,09 g·cm<sup>−3</sup> ( | | Dichte = 5,09 g·cm<sup>−3</sup> (20,7 °C)<ref name="GMELIN_97"/> | ||
| Schmelzpunkt = 64,1 [[Grad Celsius|°C]] ( | | Schmelzpunkt = 64,1 [[Grad Celsius|°C]] (1530 hPa)<ref name="GESTIS"/> | ||
| Siedepunkt = Sublimation: 56,5 °C<ref name="GESTIS"/> | | Siedepunkt = Sublimation: 56,5 °C<ref name="GESTIS"/> | ||
| Dampfdruck = 153 h[[Pascal (Einheit)|Pa]] (25 °C)<ref name="GESTIS"/> | | Dampfdruck = 153 h[[Pascal (Einheit)|Pa]] (25 °C)<ref name="GESTIS"/> | ||
| Löslichkeit = heftige Zersetzung mit Wasser<ref name="GESTIS"/> | | Löslichkeit = heftige Zersetzung mit Wasser<ref name="GESTIS"/> | ||
| Standardbildungsenthalpie = *fest: −(2197,7 ± 1,8) kJ·mol<sup>−1</sup><ref name="Enthalpie">Gerald K. Johnson: "The Enthalpy of Formation of Uranium Hexafluoride", in: ''[[The Journal of Chemical Thermodynamics]]'', '''1979''', ''11 (5)'', S. 483–490; {{DOI|10.1016/0021-9614(79)90126-5}}.</ref><ref name="GMELIN_102"/> | |||
* gasförmig: −(2148,1 ± 1,8) kJ·mol<sup>−1</sup><ref name="Enthalpie"/><ref name="GMELIN_102"/> | |||
| Quelle GefStKz = {{RL|Sammelbegriff=Uranverbindungen|ZVG=82950|Datum=30. März 2009}} | | Quelle GefStKz = {{RL|Sammelbegriff=Uranverbindungen|ZVG=82950|Datum=30. März 2009}} | ||
| Gefahrensymbole = {{Gefahrensymbole|T+|N}} | | Gefahrensymbole = {{Gefahrensymbole|T+|N}} | ||
| Zeile 20: | Zeile 27: | ||
| Radioaktiv = Ja | | Radioaktiv = Ja | ||
}} | }} | ||
'''Uranhexafluorid''' (UF<sub>6</sub>) ist eine leicht flüchtige, äußerst giftige, radioaktive und [[Korrosion|korrosive]] Verbindung aus [[Uran]] und [[Fluor]], die in der [[Uran-Anreicherung]] eingesetzt wird. Uranhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es reagiert | '''Uranhexafluorid''' (UF<sub>6</sub>) ist ein farbloser kristalliner Feststoff; es ist eine leicht flüchtige, äußerst giftige, radioaktive und [[Korrosion|korrosive]] Verbindung aus den Elementen [[Uran]] und [[Fluor]], die in der [[Uran-Anreicherung]] eingesetzt wird. Uranhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es reagiert jedoch sehr heftig mit [[Wasser]] (beispielsweise Luftfeuchtigkeit). Zusammen mit [[Neptuniumhexafluorid]] und [[Plutoniumhexafluorid]] gehört es zu den drei bisher bekannten [[Hexafluoride]]n der [[Actinoide]]nelemente, die diese besondere Eigenschaft der leichten [[Flüchtigkeit]] besitzen. | ||
== Darstellung == | |||
| ⚫ | Uranerz, bestehend aus [[Uraninit]] (Pechblende U<sub>3</sub>O<sub>8</sub>) und [[Carnotit]] (KUO<sub>2</sub>VO<sub>4</sub> · 1,5 H<sub>2</sub>O), oder sog. „[[Yellowcake]]“ wird mit [[Schwefelsäure]] oder [[Soda]] aufgeschlossen. Die jeweiligen Lösungen werden über Anionenaustauscherharze geschickt und dann mit [[Ammoniak]] versetzt, so dass das Uran als Polyuranatgemisch ausfällt. Der entstehende gelbe Feststoff [[Uranylnitrat]] (UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub>) wird in [[Salpetersäure]] gelöst und mit [[Tributylphosphat]] (TBP) im [[PUREX-Prozess]] extrahiert. Nach dem Eindampfen erhält man reines Uranylnitrat, welches durch Erhitzen zu UO<sub>3</sub> reagiert. | ||
<gallery> | |||
Datei:Uranium conversion 1.jpg| [[Yellowcake]] + [[Uranylnitrat]]-Lösung<br />UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub> | |||
Datei:Uranium conversion 2.jpg| + [[Ammoniumdiuranat]]<br />(NH<sub>4</sub>)<sub>2</sub>U<sub>2</sub>O<sub>7</sub> | |||
Datei:Uranium conversion 3.jpg| + [[Urandioxid]]<br />UO<sub>2</sub> | |||
Datei:Uranium conversion 4.jpg| + [[Urantetrafluorid]]<br />UF<sub>4</sub> | |||
</gallery> | |||
Durch Reduktion mit [[Wasserstoff]] erhält man dann [[Uran(IV)-oxid]] (UO<sub>2</sub>), | |||
:<math>\mathrm{UO_3\ +\ H_2\ \longrightarrow \ UO_2\ +\ H_2O}</math> | |||
das mit [[Fluorwasserstoff]] (HF) in [[Uran(IV)-fluorid]] (UF<sub>4</sub>) umgewandelt wird. | |||
:<math>\mathrm{UO_2\ +\ 4\ HF\ \longrightarrow \ UF_4\ +\ 2\ H_2O}</math> | |||
Dieses wird mit elementarem [[Fluor]] zu UF<sub>6</sub> weiter oxidiert. | |||
:<math>\mathrm{UF_4\ +\ F_2\ \longrightarrow \ UF_6}</math> | |||
== Eigenschaften == | == Eigenschaften == | ||
[[Datei:UF6.jpg|miniatur|links|Uranhexafluoridkristalle in einer Glasampulle]] | [[Datei:UF6.jpg|miniatur|links|Uranhexafluoridkristalle in einer Glasampulle]] | ||
[[Datei:Uranium hexafluoride phase diagram.gif|miniatur|links|[[Phasendiagramm]] von UF<sub>6</sub>]] | |||
Uranhexafluorid bildet farblose, orthorhombische, leicht hydrolysierbare Kristalle, die unter einem Druck von 1.530 [[hPa]] bei 64,1 °C schmelzen<ref name="GESTIS"/>. Unter Normaldruck (1.013,25 hPa) sublimiert UF<sub>6</sub> bei 56,5 °C<ref name="GESTIS"/>. Der Dampfdruck bei 25 °C beträgt 153 hPa<ref name="GESTIS"/>. Die [[Kritischer Punkt (Thermodynamik)|kritische Temperatur]] liegt bei 230,2 °C<ref name="GESTIS"/>, der kritische Druck beträgt 60,6 bar<ref name="GESTIS"/> und das kritische Volumen 250,0 cm<sup>3</sup>/mol. Die Dichte am kritischen Punkt beträgt 1,328 g/cm<sup>3</sup> und der kritische [[Realgasfaktor]] Z<sub>c</sub> = 0,277 und der [[azentrischer Faktor|Azentrizitätsfaktor]] 0,318. | |||
=== Physikalische Eigenschaften === | |||
Uranhexafluorid bildet farblose, orthorhombische, leicht hydrolysierbare Kristalle, die unter Normaldruck (1.013,25 hPa) bei 56,5 °C sublimieren.<ref name="GESTIS"/><ref>http://nuclearweaponarchive.org/Library/Glossary</ref> Der Dampfdruck bei 25 °C beträgt 153 hPa.<ref name="GESTIS"/> Der [[Tripelpunkt]] liegt bei einer Temperatur von 64,1 °C, der Druck bei 1,5 bar.<ref name="GESTIS"/><ref>[http://web.ead.anl.gov/uranium/guide/ucompound/propertiesu/hexafluoride.cfm Uranium Hexafluoride: Source: Appendix A of the PEIS (DOE/EIS-0269): Physical Properties]</ref> | |||
Die [[Kritischer Punkt (Thermodynamik)|kritische Temperatur]] liegt bei 230,2 °C, der kritische Druck beträgt 45,5 [[Physikalische Atmosphäre|atm]] (46,1 bar), das kritische Volumen 256,0 cm<sup>3</sup>/mol und die kritische Dichte 1,375 g/cm<sup>3</sup>.<ref name="GMELIN_97">''[[Gmelins Handbuch der anorganischen Chemie]]'', System Nr. 55, Uran, Teil C 8, S. 97.</ref><!-- und der kritische [[Realgasfaktor]] Z<sub>c</sub> = 0,277 und der [[azentrischer Faktor|Azentrizitätsfaktor]] 0,318.--> | |||
| ⚫ | Das nicht salzartige Uranhexafluorid besteht | ||
| ⚫ | Das nicht salzartige Uranhexafluorid besteht im gasförmigen Zustand aus regulär oktaedrischen Molekülen mit einheitlicher U–F-Bindungslänge von 199,6 [[Picometer|pm]]. Hingegen zeigen Untersuchungen an kristallinem UF<sub>6</sub> mittels [[Neutronenstreuung]] eine leichte Abweichung von der regulär oktaedrischen Koordination. Dies wird auf die unsymmetrische Umgebung der Moleküle in der Kristallstruktur zurückgeführt.<ref name="Levy">John H. Levy, John C. Taylor, Paul W. Wilson: "Structure of fluorides. Part XII. Single-crystal neutron diffraction study of uranium hexafluoride at 293 K", in: ''[[J. Chem. Soc., Dalton Trans.]]'', '''1976''', S. 219–224; {{DOI|10.1039/DT9760000219}}.</ref><ref>J. H. Levy, J. C Taylor, A. B. Waugh: "Neutron powder structural studies of UF<sub>6</sub>, MoF<sub>6</sub> and WF<sub>6</sub> at 77 K", in: ''[[Journal of Fluorine Chemistry]]'', '''1983''', ''23 (1)'', S. 29–36; {{DOI|10.1016/S0022-1139(00)81276-2}}.</ref> | ||
UF<sub>6</sub> ist ein kräftiges Fluorierungsmittel. Es bildet Fluoridokomplexe UF<sub>7</sub><sup>−</sup> und UF<sub>8</sub><sup>2−</sup>. | |||
<center><gallery> | |||
== Herstellung == | |||
Datei:UF6solid.jpg|Einzelnes UF<sub>6</sub>-Molekül | |||
| ⚫ | Uranerz, bestehend aus [[Uraninit]] (Pechblende U<sub>3</sub>O<sub>8</sub>) und [[Carnotit]] (KUO<sub>2</sub>VO<sub>4</sub> · 1,5 H<sub>2</sub>O), oder sog. „[[Yellowcake]]“ wird mit [[Schwefelsäure]] oder [[Soda]] aufgeschlossen. Die jeweiligen Lösungen werden über Anionenaustauscherharze geschickt und dann mit [[Ammoniak]] versetzt, so dass das Uran als Polyuranatgemisch ausfällt. Der entstehende gelbe Feststoff [[Uranylnitrat]] (UO<sub>2</sub>(NO<sub>3</sub>)<sub>2</sub>) wird in [[Salpetersäure]] gelöst und mit [[Tributylphosphat]] (TBP) im [[PUREX-Prozess]] extrahiert. Nach dem Eindampfen erhält man reines Uranylnitrat, welches durch Erhitzen zu UO<sub>3</sub> reagiert | ||
Datei:Uranium-hexafluoride-crystal-3D-vdW.png|Kristallstruktur von Uranhexafluorid | |||
</gallery></center> | |||
=== Chemische Eigenschaften === | |||
Uranhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es kann unbegrenzt bei Raumtemperatur in [[Quarzglas|Quarz-]] oder [[Pyrex|PYREX-Ampullen]] aufbewahrt werden, wenn sichergestellt ist, dass weder Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und dass das HF restlos entfernt wird.<ref name="NPF6_PREPARATION"/> | |||
Es reagiert hingegen sehr heftig mit [[Wasser]] (beispielsweise Luftfeuchtigkeit), wobei das wasserlösliche [[Uranylfluorid]] (UO<sub>2</sub>F<sub>2</sub>) und [[Fluorwasserstoff]] (HF) entstehen.<ref>R. W. Kessie: "Plutonium and Uranium Hexafluoride Hydrolysis Kinetics", in: ''[[Ind. Eng. Chem. Proc. Des. Dev.]]'', '''1967''', ''6 (1)'', S. 105–111; {{DOI|10.1021/i260021a018}}.</ref> | |||
:<math>\mathrm{UF_6\ +\ 2\ H_2O\ \longrightarrow \ UO_2F_2\ +\ 4\ HF}</math> | |||
HF bildet im überschüssigen Wasser Flusssäure und ist stark ätzend. | |||
Uranhexafluorid kann mit Natrium direkt zu Uranmetall reduziert werden.<ref>C. D. Scott: "Direct Reduction of Uranium Hexafluoride to Uranium Metal with Sodium", in: ''[[Ind. Eng. Chem. Proc. Des. Dev.]]'', '''1963''', ''2 (2)'', S. 117–121; {{DOI|10.1021/i260006a006}}.</ref> | |||
=== Vergleich der Actinoidenhexafluoride === | |||
Uranhexafluorid (UF<sub>6</sub>) entsteht relativ zügig bei 300 °C aus Urantetrafluorid (UF<sub>4</sub>) und Fluor (F<sub>2</sub>), in gleicher Weise entsteht NpF<sub>6</sub> bei 500 °C aus Neptuniumtetrafluorid (NpF<sub>4</sub>) und F<sub>2</sub> und PuF<sub>6</sub> bei 750 °C aus Plutoniumtetrafluorid (PuF<sub>4</sub>) und F<sub>2</sub>. [[Americiumhexafluorid]] (AmF<sub>6</sub>) kann unter diesen Bedingungen nicht dargestellt werden.<ref name="NPF6_PREPARATION"/> NpF<sub>6</sub> und PuF<sub>6</sub> sind lichtempfindlich und zersetzen sich zu den Tetrafluoriden und Fluor.<ref name="NPF6_PREPARATION"/> | |||
== Verwendung == | == Verwendung == | ||
Uranhexafluorid dient zur Trennung der [[Isotope|Uranisotope]] nach dem [[Gasdiffusionsverfahren]] oder mittels [[Ultrazentrifuge]]n. Es ist hierzu ideal geeignet, da es sich im Gegensatz zu den meisten anderen Uranverbindungen leicht in die Gasphase überführen ([[Dampfdruck]] etwa 100 hPa bei Raumtemperatur) lässt und da von [[Fluor]] nur ein [[Isotop]] in der Natur vorkommt. Alle natürlichen Fluor-Atome haben exakt die gleiche [[Atommasse]], daher sind die Massenunterschiede der Uranhexafluorid-Moleküle, die bei der Isotopentrennung ausgenutzt werden, wie erwünscht nur auf die Massenunterschiede der Uran-Atome zurückzuführen. | Uranhexafluorid dient zur Trennung der [[Isotope|Uranisotope]] nach dem [[Gasdiffusionsverfahren]] oder mittels [[Ultrazentrifuge]]n. Es ist hierzu ideal geeignet, da es sich im Gegensatz zu den meisten anderen Uranverbindungen leicht in die Gasphase überführen ([[Dampfdruck]] etwa 100 hPa bei Raumtemperatur) lässt und da von [[Fluor]] nur ein [[Isotop]] in der Natur vorkommt. Alle natürlichen Fluor-Atome haben exakt die gleiche [[Atommasse]], daher sind die Massenunterschiede der Uranhexafluorid-Moleküle, die bei der Isotopentrennung ausgenutzt werden, wie erwünscht nur auf die Massenunterschiede der Uran-Atome zurückzuführen. | ||
Die direkte Fluorierung von pulverförmigen abgebrannten Brennelementen mit Fluor-Gas hat das Ziel, die flüchtigen Fluoride (hauptsächlich UF<sub>6</sub>, teilweise NpF<sub>6</sub>) von den nichtflüchtigen Vertretern (z. B. [[Plutonium(IV)-fluorid|PuF<sub>4</sub>]], [[Americium(III)-fluorid|AmF<sub>3</sub>]], [[Curium(III)-fluorid|CmF<sub>3</sub>]], und den Fluoriden der meisten Spaltprodukte) zu trennen. Damit soll ein Großteil der Uranverbindungen von Plutonium, [[Minore Actinoide|minoren Actinoiden]] und Spaltprodukten getrennt werden.<ref>Jan Uhlíř, Martin Marečeka: "Fluoride Volatility Method for Reprocessing of LWR and FR Fuels", in: ''[[Journal of Fluorine Chemistry]]'', '''2009''', ''130 (1)'', S. 89–93; {{DOI|10.1016/j.jfluchem.2008.07.002}}.</ref> | |||
== Transport == | |||
[[Datei:DUF6PH38.jpg|miniatur|UF<sub>6</sub>-Tank]] | |||
Das bei der Isotopentrennung als Abfallprodukt anfallende abgereicherte Uran („[[Tails]]“) wird größtenteils als Uranhexafluorid in Tanks eingelagert. | Das bei der Isotopentrennung als Abfallprodukt anfallende abgereicherte Uran („[[Tails]]“) wird größtenteils als Uranhexafluorid in Tanks eingelagert. | ||
== Einzelnachweise == | == Einzelnachweise == | ||
<references | <references> | ||
<ref name="GESTIS">{{GESTIS|Name=Uranhexafluorid |ZVG= |CAS=7783-81-5 |Datum=30. Januar 2010}}.</ref> | |||
<ref name="GMELIN_97">''[[Gmelins Handbuch der anorganischen Chemie]]'', System Nr. 55, Uran, Teil C 8, S. 97.</ref> | |||
<ref name="GMELIN_102">''[[Gmelins Handbuch der anorganischen Chemie]]'', System Nr. 55, Uran, Teil C 8, S. 102.</ref> | |||
<ref name="NPF6_PREPARATION">John G. Malm, Bernard Weinstock, E. Eugene Weaver: "The Preparation and Properties of NpF<sub>6</sub>; a Comparison with PuF<sub>6</sub>", in: ''[[J. Phys. Chem.]]'', '''1958''', ''62 (12)'', S. 1506–1508; {{DOI|10.1021/j150570a009}}.</ref> | |||
</references> | |||
== Literatur == | == Literatur == | ||
* ''[[Gmelins Handbuch der anorganischen Chemie]]'', System Nr. 55, Uran, Teil C 8, S. 71–163. | |||
* {{cite journal| author= John H. Levy, John C. Taylor, Paul W. Wilson | title= Structure of fluorides. Part XII. Single-crystal neutron diffraction study of uranium hexafluoride at 293 K | journal= [[J. Chem. Soc., Dalton Trans.]] | year= 1976 | pages= 219–224 | doi=10.1039/DT9760000219}}. | |||
* Arnold F. Holleman, Nils Wiberg: ''Lehrbuch der Anorganischen Chemie'', 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969. | |||
* {{cite journal| author= George A. Olah, John Welch | title= Synthetic methods and reactions. 46. Oxidation of organic compounds with uranium hexafluoride in haloalkane solutions | journal=[[J. Am. Chem. Soc.]] | year= 1978 | pages= 5396–5402 | volume= 100 | issue= 17 | doi=10.1021/ja00485a024}}. | |||
* Norman N. Greenwood, Alan Earnshaw: ''Chemie der Elemente'', 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 1628. | |||
== Siehe auch == | |||
* [[Uran-Anreicherung]] | |||
* [[Neptuniumhexafluorid]] | |||
* [[Plutoniumhexafluorid]] | |||
== Weblinks == | == Weblinks == | ||
{{commons|Category:Uranium hexafluoride|Uranhexafluorid}} | |||
* [http://www.webelements.com/compounds/uranium/uranium_hexafluoride.html Uranhexafluorid bei www.webelements.com.] | |||
* Gerhard Piper: [http://www.heise.de/tp/r4/artikel/25/25602/1.html ''Internationaler Uranhexafluorid-Tourismus durch Deutschland'']; Telepolis, 30. Juni 2007. | * Gerhard Piper: [http://www.heise.de/tp/r4/artikel/25/25602/1.html ''Internationaler Uranhexafluorid-Tourismus durch Deutschland'']; Telepolis, 30. Juni 2007. | ||
{{Schreibwettbewerb}} | |||
[[Kategorie:Uranverbindung]] | [[Kategorie:Uranverbindung]] | ||
Version vom 30. März 2010, 10:44 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Kristallsystem | orthorhombisch | |||||||||
| Raumgruppe | Pnma | |||||||||
| Gitterparameter | a = 990,0 pm | |||||||||
| Allgemeines | ||||||||||
| Name | Uran(VI)-fluorid | |||||||||
| Summenformel | UF6 | |||||||||
| Kurzbeschreibung | farblose Kristalle[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 351,99 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Dichte | 5,09 g·cm−3 (20,7 °C)[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | Sublimation: 56,5 °C[4] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | heftige Zersetzung mit Wasser[4] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| MAK | 1 mg·m−3[4] | |||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Uranhexafluorid (UF6) ist ein farbloser kristalliner Feststoff; es ist eine leicht flüchtige, äußerst giftige, radioaktive und korrosive Verbindung aus den Elementen Uran und Fluor, die in der Uran-Anreicherung eingesetzt wird. Uranhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es reagiert jedoch sehr heftig mit Wasser (beispielsweise Luftfeuchtigkeit). Zusammen mit Neptuniumhexafluorid und Plutoniumhexafluorid gehört es zu den drei bisher bekannten Hexafluoriden der Actinoidenelemente, die diese besondere Eigenschaft der leichten Flüchtigkeit besitzen.
Darstellung
Uranerz, bestehend aus Uraninit (Pechblende U3O8) und Carnotit (KUO2VO4 · 1,5 H2O), oder sog. „Yellowcake“ wird mit Schwefelsäure oder Soda aufgeschlossen. Die jeweiligen Lösungen werden über Anionenaustauscherharze geschickt und dann mit Ammoniak versetzt, so dass das Uran als Polyuranatgemisch ausfällt. Der entstehende gelbe Feststoff Uranylnitrat (UO2(NO3)2) wird in Salpetersäure gelöst und mit Tributylphosphat (TBP) im PUREX-Prozess extrahiert. Nach dem Eindampfen erhält man reines Uranylnitrat, welches durch Erhitzen zu UO3 reagiert.
- + Ammoniumdiuranat
(NH4)2U2O7 - + Urandioxid
UO2 - + Urantetrafluorid
UF4
Durch Reduktion mit Wasserstoff erhält man dann Uran(IV)-oxid (UO2),
das mit Fluorwasserstoff (HF) in Uran(IV)-fluorid (UF4) umgewandelt wird.
Dieses wird mit elementarem Fluor zu UF6 weiter oxidiert.
Eigenschaften


Physikalische Eigenschaften
Uranhexafluorid bildet farblose, orthorhombische, leicht hydrolysierbare Kristalle, die unter Normaldruck (1.013,25 hPa) bei 56,5 °C sublimieren.[4][8] Der Dampfdruck bei 25 °C beträgt 153 hPa.[4] Der Tripelpunkt liegt bei einer Temperatur von 64,1 °C, der Druck bei 1,5 bar.[4][9]
Die kritische Temperatur liegt bei 230,2 °C, der kritische Druck beträgt 45,5 atm (46,1 bar), das kritische Volumen 256,0 cm3/mol und die kritische Dichte 1,375 g/cm3.[3]
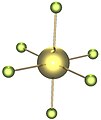
Das nicht salzartige Uranhexafluorid besteht im gasförmigen Zustand aus regulär oktaedrischen Molekülen mit einheitlicher U–F-Bindungslänge von 199,6 pm. Hingegen zeigen Untersuchungen an kristallinem UF6 mittels Neutronenstreuung eine leichte Abweichung von der regulär oktaedrischen Koordination. Dies wird auf die unsymmetrische Umgebung der Moleküle in der Kristallstruktur zurückgeführt.[1][10]
- Einzelnes UF6-Molekül
- Kristallstruktur von Uranhexafluorid
Chemische Eigenschaften
Uranhexafluorid ist nicht brennbar, nicht explosiv und beständig gegen trockene Luft. Es kann unbegrenzt bei Raumtemperatur in Quarz- oder PYREX-Ampullen aufbewahrt werden, wenn sichergestellt ist, dass weder Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und dass das HF restlos entfernt wird.[11]
Es reagiert hingegen sehr heftig mit Wasser (beispielsweise Luftfeuchtigkeit), wobei das wasserlösliche Uranylfluorid (UO2F2) und Fluorwasserstoff (HF) entstehen.[12]
HF bildet im überschüssigen Wasser Flusssäure und ist stark ätzend.
Uranhexafluorid kann mit Natrium direkt zu Uranmetall reduziert werden.[13]
Vergleich der Actinoidenhexafluoride
Uranhexafluorid (UF6) entsteht relativ zügig bei 300 °C aus Urantetrafluorid (UF4) und Fluor (F2), in gleicher Weise entsteht NpF6 bei 500 °C aus Neptuniumtetrafluorid (NpF4) und F2 und PuF6 bei 750 °C aus Plutoniumtetrafluorid (PuF4) und F2. Americiumhexafluorid (AmF6) kann unter diesen Bedingungen nicht dargestellt werden.[11] NpF6 und PuF6 sind lichtempfindlich und zersetzen sich zu den Tetrafluoriden und Fluor.[11]
Verwendung
Uranhexafluorid dient zur Trennung der Uranisotope nach dem Gasdiffusionsverfahren oder mittels Ultrazentrifugen. Es ist hierzu ideal geeignet, da es sich im Gegensatz zu den meisten anderen Uranverbindungen leicht in die Gasphase überführen (Dampfdruck etwa 100 hPa bei Raumtemperatur) lässt und da von Fluor nur ein Isotop in der Natur vorkommt. Alle natürlichen Fluor-Atome haben exakt die gleiche Atommasse, daher sind die Massenunterschiede der Uranhexafluorid-Moleküle, die bei der Isotopentrennung ausgenutzt werden, wie erwünscht nur auf die Massenunterschiede der Uran-Atome zurückzuführen.
Die direkte Fluorierung von pulverförmigen abgebrannten Brennelementen mit Fluor-Gas hat das Ziel, die flüchtigen Fluoride (hauptsächlich UF6, teilweise NpF6) von den nichtflüchtigen Vertretern (z. B. PuF4, AmF3, CmF3, und den Fluoriden der meisten Spaltprodukte) zu trennen. Damit soll ein Großteil der Uranverbindungen von Plutonium, minoren Actinoiden und Spaltprodukten getrennt werden.[14]
Transport

Das bei der Isotopentrennung als Abfallprodukt anfallende abgereicherte Uran („Tails“) wird größtenteils als Uranhexafluorid in Tanks eingelagert.
Einzelnachweise
- ↑ a b John H. Levy, John C. Taylor, Paul W. Wilson: "Structure of fluorides. Part XII. Single-crystal neutron diffraction study of uranium hexafluoride at 293 K", in: J. Chem. Soc., Dalton Trans., 1976, S. 219–224; doi:10.1039/DT9760000219.
- ↑ Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 97. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „GMELIN_97“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ a b c d e f g h Eintrag zu Uranhexafluorid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- ↑ a b Gerald K. Johnson: "The Enthalpy of Formation of Uranium Hexafluoride", in: The Journal of Chemical Thermodynamics, 1979, 11 (5), S. 483–490; doi:10.1016/0021-9614(79)90126-5.
- ↑ a b Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 102.
- ↑ http://nuclearweaponarchive.org/Library/Glossary
- ↑ Uranium Hexafluoride: Source: Appendix A of the PEIS (DOE/EIS-0269): Physical Properties
- ↑ J. H. Levy, J. C Taylor, A. B. Waugh: "Neutron powder structural studies of UF6, MoF6 and WF6 at 77 K", in: Journal of Fluorine Chemistry, 1983, 23 (1), S. 29–36; doi:10.1016/S0022-1139(00)81276-2.
- ↑ a b c John G. Malm, Bernard Weinstock, E. Eugene Weaver: "The Preparation and Properties of NpF6; a Comparison with PuF6", in: J. Phys. Chem., 1958, 62 (12), S. 1506–1508; doi:10.1021/j150570a009.
- ↑ R. W. Kessie: "Plutonium and Uranium Hexafluoride Hydrolysis Kinetics", in: Ind. Eng. Chem. Proc. Des. Dev., 1967, 6 (1), S. 105–111; doi:10.1021/i260021a018.
- ↑ C. D. Scott: "Direct Reduction of Uranium Hexafluoride to Uranium Metal with Sodium", in: Ind. Eng. Chem. Proc. Des. Dev., 1963, 2 (2), S. 117–121; doi:10.1021/i260006a006.
- ↑ Jan Uhlíř, Martin Marečeka: "Fluoride Volatility Method for Reprocessing of LWR and FR Fuels", in: Journal of Fluorine Chemistry, 2009, 130 (1), S. 89–93; doi:10.1016/j.jfluchem.2008.07.002.
Literatur
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 71–163.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1969.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 1628.
Weblinks
- Uranhexafluorid bei www.webelements.com.
- Gerhard Piper: Internationaler Uranhexafluorid-Tourismus durch Deutschland; Telepolis, 30. Juni 2007.