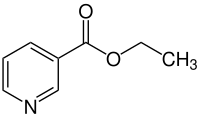
Ethylnicotinat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylnicotinat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H9NO2 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 151,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,107 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
223–224 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (56 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,504 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Ethylnicotinat ist ein Carbonsäureester aus Ethanol und Nicotinsäure. Es handelt sich außerdem um ein Pyridin.
Synthese
Durch Oxidation von Chinolin mit Schwefelsäure in Gegenwart von Selen bei 300 °C entsteht Nicotinsäure. Durch Kochen des so entstandenen Reaktionsgemisches mit Ethanol kann die Säure direkt zu Ethylnicotinat verestert werden.[3]
Eigenschaften
Im menschlichen Körper wird Ethylnicotinat zu Nicotinsäure metabolisiert.[4][5] Auf einige Insekten wirkt es als Lockstoff, beispielsweise Franliniella occidentalis.[6][7]
Verwendung
Ethylnicotinat ist in der EU unter der FL-Nummer 14.110 als Aromastoff für Lebensmittel zugelassen.[8] Es eignet sich auch als Edukt für die Synthese von racemischem Nicotin.[9]
Einzelnachweise
- ↑ Eintrag zu ETHYL NICOTINATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. Juli 2024.
- ↑ a b c d e f g h i j Datenblatt Ethylnikotinat, 99% bei Sigma-Aldrich, abgerufen am 3. Juli 2024 (PDF).
- ↑ Jerome G. Kaufman: Nicotinic Acid Esters. In: Journal of the American Chemical Society. Band 67, Nr. 3, März 1945, S. 497–498, doi:10.1021/ja01219a507.
- ↑ Vivian Ojogun, Sandhya M. Vyas, Hans-Joachim Lehmler, Barbara L. Knutson: Partitioning of homologous nicotinic acid ester prodrugs (nicotinates) into dipalmitoylphosphatidylcholine (DPPC) membrane bilayers. In: Colloids and Surfaces B: Biointerfaces. Band 78, Nr. 1, Juni 2010, S. 75–84, doi:10.1016/j.colsurfb.2010.02.015, PMID 20227859, PMC 2873030 (freier Volltext).
- ↑ Tanasait Ngawhirunpat, Praneet Opanasopit, Sompol Prakongpan: Comparison of skin transport and metabolism of ethyl nicotinate in various species. In: European Journal of Pharmaceutics and Biopharmaceutics. Band 58, Nr. 3, November 2004, S. 645–651, doi:10.1016/j.ejpb.2004.05.002.
- ↑ HouJun Tian, YiXin Chen, Yong Chen, XiuQin Chen, Shuo Lin, Jie Zhang, Guang Yang, Hui Wei: A mixture of p ‐anisaldehyde and ethyl nicotinate elicits positive antennal and behavioral responses in Frankliniella occidentalis. In: Entomologia Experimentalis et Applicata. Band 170, Nr. 7, Juli 2022, S. 603–611, doi:10.1111/eea.13177.
- ↑ D. R. Penman, G. O. Osborne, S. P. Worner, R. B. Chapman, G. F. McLaren: Ethyl nicotinate: A chemical attractant forThrips obscuratus (Thysanoptera: Thripidae) in stonefruit in New Zealand. In: Journal of Chemical Ecology. Band 8, Nr. 10, Oktober 1982, S. 1299–1303, doi:10.1007/BF00987763.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 3. Juli 2024.
- ↑ Shigehiko Sugasawa, Takashi Tatsuno, Takashi Kamiya: A New Synthesis of rac-Nicotine. In: Pharmaceutical Bulletin. Band 2, Nr. 1, 1954, S. 39–41, doi:10.1248/cpb1953.2.39.






