„Schutzgruppe“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Formulierung(en) |
Codc (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 1: | Zeile 1: | ||
Eine '''Schutzgruppe''' ist ein organischer (selten auch anorganischer) Rest der eine [[Funktionelle Gruppe]] während einem oder mehrere Syntheseschritte vor unerwünschten Angriffen schützt. Jede Funktionelle Gruppe hat ihren eigenen Satz an Schutzgruppen. Diese unterscheiden sich innerhalb einer Funktionellen Gruppe aber auch generell in ihrer Stabilität und den Bedingungen ihrer Abspaltung. Bei der Synthese vom speziellen Verbindungsklassen mit sich wiederholenden Funktionellen Gruppen, in der Regel sind dies [[Biomolekül]]e wie [[Peptide]], [[Oligosaccharide]] oder [[Nucleotid]]e, haben sich Standardsätze an Schutzgruppen etabliert. Schutzgruppen sind heute ein wichtiges Werkzeug in der modernen Synthese von komplexen Verbindungen geworden. |
|||
{{Lückenhaft}} |
|||
Die Anforderungen an eine Schutzgruppe ist recht hoch. Dazu gehören dass sie sich mit sehr guten [[Ausbeute (Chemie) | Ausbeuten]] und spezifisch an einer Funktionelle Gruppen einführen lassen muss und ebenso wieder abzuspalten sein muss. Für beide Schritte sollten die Reaktionsbedingungen sehr standardisierbar sein. Sie muss unter möglichst vielen Reaktionsbedingungen stabil sein. Nach Möglichkeit müssen der Reaktionsabfall leicht abtrennbar sein. Eine optimales Schutzgruppen-Reagenz ist auch zusätzlich noch preiswert. Je breiter der Erfahrungsschatz mit einer Schutzgruppe ist um so besser ist eine Vorhersagbarkeit der Reaktivitäten der Schutzgruppe. |
|||
'''Schutzgruppe''' ist eine Sammelbezeichnung für organisch-chemische Reste, mit der eine bestimmte von mehreren funktionellen Gruppen eines Moleküls (Edukt) ''vorübergehend'' gegen den Angriff von Reagenzien geschützt werden kann. Das ist notwendig, wenn man chemische Reaktionen – wie Oxidationen, Reduktionen, Substitutionsreaktionen usw. – an der geschüzten Stelle vermeiden will, die man an einer anderen (nicht geschützten) Stelle erreichen möchte. Anschließend wird die Schutzgruppe wieder entfernt, möglichst selektiv und unter milden Reaktionsbedingungen, z. B. [[Hydrogenolyse|hydrogenolytisch]], [[Photolyse|photolytisch]], [[Säurekatalyse|säurekatalytisch]] oder mit anderen Methoden, wobei diese Gruppe wieder in ihren ursprünglichen Zustand verwandelt wird. |
|||
== |
== Geschichte == |
||
[[Datei:E.J.Coreyx240.jpg|miniatur|Elias James Corey Jr.]] |
|||
[[Datei:Acetal-protection-example.png|right|400px|Acetalbildung zum Schutz einer Carbonylgruppe]] |
|||
Die Geschichte der Schutzgruppentechnik ist nicht genau belegbar da sie fließend einher geht mit der Verwendung von Ausgangsverbindungen einer Synthese. Die frühen Schutzgruppen beruhten in der Regel darauf dass man die Ausgangsverbindung so wählte dass eine Funktionelle Gruppe möglichst lange blockiert war. So wurden z. B. [[Anisol]]e anstatt [[Phenol]]e gewählt oder [[Carbonsäureester | Ester]] anstelle von freien [[Hydroxyl-Gruppe | Alkoholgruppen]]. Erst mit der, langsam Anfang des 20. Jahrhunderts aufkommenden, gezielte Synthese von immer komplexer werdenden Verbindungen wurde die Schutzgruppentechnik wirklich bedeutsam. Im großen Stil und auch mit einem Forschungsaufwand den man in die Chemie der Schutzgruppen investierte wurde etwa ab 1960 begonnen. Während dieser Zeit begannen Chemiker immer komplexerere [[Naturstoffe]] zu synthetisieren. Hervor zuheben während dieser Zeit sind vor allem Arbeiten von den [[Nobelpreis | Nobelpreisträgern]] [[Robert B. Woodward]] und [[Elias James Corey Jr. | Elias J. Corey]] sowie [[Albert Eschenmoser]] die bei der Synthese von komplexen Naturstoffen Pionierarbeit geleistet haben.<ref>K.C. Nicolaou, E.J. Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods, 1996, ISBN 3-527-29284-5.</ref><ref>K.C. Nicolaou, S.A. Snyder: Classics in Total Synthesis II, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003, ISBN 3-527-30684-6.</ref> |
|||
Zum Beispiel ist [[Lithiumaluminiumhydrid]] eine hoch reaktives und nützliches [[Reagenz]], um [[Ester]] zu Alkoholen zu reduzieren. Es reagiert allerdings auch in jedem Fall mit [[Carbonylgruppe]]n, so dass diese ''geschützt'' werden müssen, wenn sie nicht mit reduziert werden sollen. In dem nebenstehenden Beispiel wird die Carbonylgruppe in ein [[Acetale|Acetal]] umgewandelt, welches nicht von Hydriden angegriffen werden kann. Das Acetal dient als Schutzgruppe für die Carbonylgruppe.<ref name=Bruice>Paula Yurkanis Bruice: ''Organische Chemie'', Pearson Education Inc., 2007, 5. Auflage, S. 938−939, ISBN 978-3-8273-7190-4.</ref> Nachdem der Ester durch das Hydrid reduziert wurde, kann das Acetal wieder entfernt bzw. ''entschützt'' werden (durch Reaktion mit einer wässrigen Säure), wodurch die Carbonylfunktion wider hergestellt wird. Wird die Carboniylgruppe nicht geschützt, wird sie ebenso wie die Estergruppe reduziert und es entstehen zwei Hydroxylgruppen. |
|||
Heute hat man eine Vielzahl an Schutzgruppen zur Verfügung welche in Monographien bezüglich ihrer Eigenschaften zusammen gefasst sind.<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4.</ref><ref>Peter G.M. Wuts, Theodora W. Greene: Green's Protective Groups in Organic Synthesis, Fourth Ed. John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0.</ref> Dabei gibt es sehr etablierte Schutzgruppen und sehr viele ''exotische'' Schutzgruppen die nur für eine Synthese oder ein recht spezielles Gebiet entwickelt wurden. |
|||
== Häufig verwendete Schutzgruppen == |
|||
== Anforderungen an eine Schutzgruppe == |
|||
=== Alkohol-Schutzgruppen === |
|||
Da Schutzgruppen-Operationen keine produktiven Schritte in einer Synthesesequenz sind, da sie lediglich ein [[Derivat (Chemie) | Derivatisierungsschritt]] darstellen, liegen die Anforderungen an eine gute Schutzgruppe recht hoch. Hinzu kommt noch dass jeder Syntheseschritt in der Regel Entwicklungsarbeit bedarf den es gilt möglichst gering zu halten. |
|||
Folgende Gruppen schützen [[Alkohole]] |
|||
Als Grundanforderungen für eine gute Schutzgruppe haben sich folgende Merkmale heraus gebildet: |
|||
*[[(Chlormethyl)methylether#MOM-Schutzgruppe|Methoxymethylether]] (MOM) - kann durch Säure entfernt werden. |
|||
*[[Silylether]] - können durch Säure oder Fluoridionen wieder abgespalten werden. |
|||
:* Das [[Reagenz]] muss käuflich und preiswert oder leicht herstellbar sein. |
|||
Alkohole reagieren mit anderen Alkoholen unter Wasserabspaltung zu [[Ether]]n. Die [[Merrifield-Synthese]] ist ein Verfahren zur Peptiderzeugung, das auf Schutzgruppenchemie beruht. |
|||
:* Die Schutzgruppe muss einfach, spezifisch und in hohen Ausbeuten einführbar sein. |
|||
:* Sie muss stabil gegenüber einer möglichst großen Anzahl an Reaktionbedingungen und Aufarbeitungs- und Reinigungsmethoden sein. |
|||
:* Sie muss spezifisch, hoch selektiv und in hohen Ausbeuten abspaltbar sein. Dabei sollten die Bedingungen standardisierbar sein. |
|||
Ein sehr wichtiger Aspekt stellt die hohe Selektivität der Abspaltung dar. Denn im Idealfall ist immer nur eine von vielen Schutzgruppen vom Abspaltungsprozess betroffen. Leider verhalten sich Schutzgruppen in der Praxis nicht immer so, wie man anhand der Literatur erwarten würde und es gibt Fälle da musste trotz großem Erfahrungsschatz sowohl für das Einführen als auch für das Abspalten Entwicklungsarbeit geleistet werden.<ref>Kocieński: Protecting Groups, S. 245-250</ref><ref>Spitzner, D.; Oesterreich, K.; European Journal of Organic Chemistry, '''2001''', ''10''; 1883-1886</ref> |
|||
=== Carbonyl-Schutzgruppen === |
|||
== Orthogonalität von Schutzgruppen == |
|||
*[[Aldehyde]] können mit [[Diole]]n zu Acetalen umgesetzt werden |
|||
*analog zu den Aldehyden werden [[Ketone]] zu [[Ketale]]n umgesetzt |
|||
[[Datei:Orthogonal tyrosin.svg | thumb | upright=2 | right | Orthogonal geschütztes Tyrosin mit Abspaltbedingungen]] |
|||
In beiden Fällen wird damit das Carbonylkohlenstoffatom vor einem [[nukleophil]]en Angriff geschützt. |
|||
Unter [[Orthogonalität]] bei Schutzgruppen versteht man dass sich jede Schutzgruppe seperat und selektiv und alle in einer beliebigen Reihenfolge aufgrund der verschiedenen Abspaltreagenzien abspalten lassen. Dabei darf keine der anderen Schutzgruppen angegriffen werden. Im gezeigten Beispiel eines geschützten [[Tyrosin]]s kann der Benzylester hydrogenolytisch, die Fluorenylmethylenoxy-Gruppe (Fmoc) wird durch Basen (wie z. B. [[Piperidin]]) und der [[Phenol | phenolische]] ''tert''.-Butylether wird sauer (z. B. mit [[Trifluoressigsäure]]) gespalten. |
|||
Ein weit verbreitetes Beispiel für diese Anwendung ist die Fmoc-Pepidsynthese die sowohl in Lösung als auch auf fester Phase eine große Bedeutung hat.<ref>W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, ISBN 0-19-963724-5.</ref> Die Schutzgruppe hier müssen so standardisiert sein dass sie durch von einem Automaten durchgeführt werden können und Ausbeuten weit über 99% erreicht werden müssen da sonst die Trennung des Reaktionsgemisches praktisch unmöglich ist.<ref>Chan, White: Fmoc Solid Phase Peptide Synthesis., S. 10–12.</ref> |
|||
=== Amin-Schutzgruppen === |
|||
<gallery widths="300" heights="300" perrow="5"> |
|||
[[Amino]]funktionen von [[Aminosäure]]n lassen sich mit Schutzgruppen vom Urethantyp<ref name=jakubke1>Hans-Dieter Jakubke, Hans Jeschkeit: ''Aminosäuren, Peptide, Proteine'', Verlag Chemie, Weinheim, 118-127, 1982, ISBN 3-527-25892-2.</ref>, Säureamidtyp<ref name=jakubke2>Hans-Dieter Jakubke, Hans Jeschkeit: ''Aminosäuren, Peptide, Proteine'', Verlag Chemie, Weinheim, 127-130, 1982, ISBN 3-527-25892-2.</ref> oder vom Alkyltyp<ref name=jakubke3>Hans-Dieter Jakubke, Hans Jeschkeit: ''Aminosäuren, Peptide, Proteine'', Verlag Chemie, Weinheim, 130-132, 1982, ISBN 3-527-25892-2.</ref> schützen. Zu einer Auswahl solcher Schutzgruppen zählen: |
|||
Datei:SPPS1is.svg | Schematische Darstellung einer Festphasen-Peptidsynthese mit orthogonalen Schutzgruppen '''X''' und '''Y''' |
|||
* [[ADPOC-Schutzgruppe|1-(1-Adamantyl)-1-methylethoxycarbonyl]] (ADPOC) |
|||
Datei:SPPS2is.svg | Fmoc-Festphasen Peptidsynthese mit orthogonalen Schutzgruppen |
|||
* [[Allyloxycarbonyl-Gruppe|Allyloxycarbonyl]] (ALLOC) |
|||
</gallery> |
|||
* [[Chlorameisensäurebenzylester|Benzyloxycarbonyl]] (Z) |
|||
* [[Boc-Gruppe|Di-''tert''-butyloxycarbonyl]] (Boc) |
|||
* [[Fluorenylmethoxycarbonyl]] (FMOC) |
|||
* [[Trifluoracetylgruppe]] (TFA) |
|||
* [[Triphenylmethylgruppe]] (TRT) |
|||
Eine weitere wichtige Anwendung von orthogonalen Schutzgruppen ist in der Kohlenhydrat-Chemie nötig. Da Kohlenhydrate über sehr gleichartige Hydroxylgruppen verfügen muss der Schutz bzw. das Entschützen von einzelnen Hydroylgruppen möglich sein. Einen ähnlichen Fall stellt die Synthese von Nucleotiden dar. Hier hat man zum einen das Problem (wie bei der Peptidsynthese) das es sich um vektorelle Moleküle handelt. Zum anderen hat man hier auch das Problem der [[Zucker]]chemie mit dem Zuckerrest der [[Ribose]] bei der Synthese von [[RNA]]-Molekülen. |
|||
=== Verschiedene === |
|||
*[[Doppelbindung]]en können iodiert werden. Man entfernt die Schutzgruppe anschließend mit metallischem Zink. Die Konfiguration der Doppelbindung bleibt dabei erhalten. |
|||
Aber auch in der Synthese von komplexen Naturstoffen oder Wirkstoffen mit vielen Funktionellen Gruppen ist man auf die Orthogonalität der Schutzgruppen angewiesen.<ref>K.C. Nicolaou, E.J. Sorensen: Classics in Total Synthesis: ''Targets, Strategies, Methods'', VCH Verlagsgesellschaft mbH, Weinheim, 1996, S. 711–729, ISBN 3-527-29284-5.</ref><ref>K.C. Nicolaou, S.A. Snyder: ''Classics in Total Synthesis II'', Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003, ISBN 3-527-30684-6.</ref> |
|||
== Funktionelle Gruppen == |
|||
=== Amine === |
|||
Amine sind die Funktionelle Gruppe welche bei weitem die größte Vielfalt an Schutzgruppen aufweist. Dies hängt zum einen damit zusammen dass Amine in der [[Peptidsynthese]] einer besondere Wichtigkeit zukommt aber auch der Eigenschaften von [[Amin]]en. Diese sind zum einen recht potente [[Nucleophil]]e aber auch verhältnismässig starke [[Base (Chemie) | Basen]]. Diese Eigenschaften führen dazu, dass immer neue Schutzgruppen für Amine entwickelt wurden.<ref>Kocieński: Protecting Groups, S. 186.</ref> |
|||
Eine grosse Gruppe der Schutzgruppen für Amine gehören zu den [[Carbamat]]en. Carbamate beziehen ihre Triebkraft bei der Spaltung durch die Bildung des sehr stabilen Kohlendioxid-Moleküls. Je nach Resten des Carbamates wurden verschiedene Spaltungsmöglichkeiten entwickelt. Die am häufigsten benutzten Carbamate sind die ''tert''.-Butyloxycarbonyl–, Benzyloxycarbonyl–, die Fluorenylmethylenoxycarbonyl– und die Allyloxycarbonyl–Verbindungen. |
|||
{| class="wikitable" |
|||
|- |
|||
! Rest || Formel !! Name !! Abkürzung !! Spaltung |
|||
|- |
|||
|[[Butyloxycarbonyl-Gruppe | ''tert''.-Butyl]] ||[[Datei:Boc-NR.svg | 150px]] ||''tert''.-Butyloxycarbonyl || Boc || Sauer; Trifluoressigsäure (TFA) rein oder als Lösung in Dichlormethan<ref>N. Sakai, Y. Ohfune: In ''J. Am. Chem. Soc.'' '''1992''', ''114'', 998.</ref>, 3 M Salzsäure in Essigsäureethylester<ref>G.L. Stahl, R. Walter, C.W. Smith: In ''J. org. Chem.'' '''1978''', ''43'', 2285.</ref> oder 10% Schwefelsäure in Dioxan<ref>R.A. Houghton, A. Beckman, J.M. Ostresh: In ''Int. J. Pept. Protein Res.'' '''1986''', ''48'', 653.</ref> |
|||
|- |
|||
|[[Benzylgruppe | Benzyl]] ||[[Datei:Cbz-NR.svg | 150px]] || Benzyloxycarbonyl || Cbz oder Z || Hydrogenolytisch; Wasserstoff und Palladium auf Aktivkohle<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 195 ISBN 3-13-135601-4.</ref>, Lithium oder Natrium in flüssigem Ammoniak<ref>R.M. Williams, P.J. Sinclir, D. Zhai, D. Chen: In ''J.Am. Chem. Soc.'' '''1988''', '110'', 1547.</ref> |
|||
|- |
|||
|[[Fmoc-Schutzgruppe | Fluorenylmethylen]] ||[[Datei:Fmoc-NR.svg | 150px]] || Fluorenylmethylenoxycarbonyl || Fmoc || Basisch; 20-50% Piperidin in Dimethylformamid<ref>W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, S. 27-30 ISBN 0-19-963724-5.</ref> |
|||
|- |
|||
|[[Allylgruppe | Allyl]] ||[[Datei:Alloc-NR.svg | 150px]] || Allyloxycarbonyl || Alloc || Übergangsmetallkatalysiert; Metalle wie Palladium(0)– oder Nickel(0)-Komplexe<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 199-201 ISBN 3-13-135601-4.</ref> |
|||
|} |
|||
Neben den Carbamaten sind noch eine Reihe anderer ''N''-Acyl-Derivate als Schutzgruppen von Bedeutung aber bei weitem nicht so weit verbreitet. Dazu gehören beispielsweise die [[Phthalimid]]e welche entweder durch die Umsetzung der primären Amine mit Phtalsäureanhydrid oder durch den Aufbau der Aminogruppe über eine [[Gabriel-Synthese]] zugänglich sind. Die Spaltung der Phtalimide erfolgt normalerweise durch [[Hydrazin]]hydrat oder Natriumboranat.<ref>J.O. Osby, M.G. Martin, B. Ganem: In "An Exceptionally Mild Deprotection of Phthalimides". ''Tetrahedron Lett.'' '''1984''', ''25'', 2093. {{doi|10.1016/S0040-4039(01)81169-2}}</ref> Trifluoracetamide sind überaus leicht im basischen zu verseifen und daher dienen die durch die Umsetzung mit [[Trifluoressigsäureanhydrid]] erhaltenen Acetamide gelegenlich als Schutzgruppe für Amine. |
|||
Bei [[Indol]]en, [[Pyrrol]] und [[Imidazol]]en also heterocyclischen Verbindungen finden, die auf ''normalen'' Aminen für eine Schutzgruppe häufig zu stabilen ''N''-Sulfonyl-Derivate ihre Anwendung. Die Darstellung erfolgt hier durch [[Sulfonsäure | Sulfonierung]] mit [[Phenylsulfonylchlorid]] mit dem deprotonierten Heterocyclus. Die Spaltung erfolgt durch basische Hydrolyse. ''N''-Acyl-Derivate von primären und sekundären Aminen sind zwar relativ leicht durch die Umsetzung der Amine mit einem Arylsulfonsäurechlorid zugänglich aber können nur schwer z. B. unter den Bedingungen einer [[Birch-Reduktion]] (Natrium in flüssigem Ammoniak) oder durch Umsetzung mit [[Natriumnaphtalid]] gespalten werden. |
|||
Unter den ''N''-Alkyl-Derivaten haben die durch Alkylierung oder reduktive Alkylierung darstellbaren ''N''-Benzyl-Derivate eine gewisse Bedeutung. Die Spaltung erfolgt wie bei der Cbz-Gruppe reduktiv und normalerweise durch [[Hydrierkatalysatoren | katalytische Hydrierung]] oder durch [[Birch-Reduktion]]. ''N''-Alkyl-Amine habe hier einen entscheidenden Nachteil gegenüber den Carbamaten oder Amiden dass der basische Stickstoff erhalten bleibt. |
|||
=== Alkohole === |
|||
Die klassische Schutzgruppe für Alkohole sind Carbonsäureester. Häufig sind die Ester von Vorstufen käuflich erhältlich oder können leicht durch Umsetzung der Alkohole mit den Säurechloriden oder Anhydriden durch eine [[Schotten-Baumann-Reaktion]] oder aber durch Umesterung erhalten werden. Die Spaltung der Ester erfolgt in der Regel durch die Umsetzung mit Nucleophilen wie den Alkalihydroxyden, Alkali–Alkoholaten oder Lithium– bzw. Magnesium–organische Verbindungen oder aber reduktiv durch Umsetzung mit komplexen Hydriden wie Lithiumalanat. Die Reaktivität der Ester gegenüber nucleophiler Angriffe sinkt mit der sterischen Hinderung der Carbonsäure in der Reihenfolge: |
|||
:<math>\mathbf{Pivaloyl < Benzoyl < Acetyl < Chloracetyl}</math> |
|||
Die Reaktivität der Alkohole sinkt ebenfalls mit der steigenden sterischen Hinderung der Alkohole: |
|||
:<math>\mathbf{Phenole > prim\ddot a re\ Alkohole > sekund\ddot a re\ Alkohole > terti\ddot a re\ Alkohole}</math> |
|||
Die wichtigsten Ester die als Schutzgruppen gebräuchlich sind, das sind die Essigsäureester, die Benzoesäureester und Pivalinsäureester da sie sich nach den angegebenen Reaktivitäten differenziert voneinander abspalten lassen. |
|||
[[Datei:Tms protecting.svg | thumb | upright=2 |right | Schützung eines sekundären Alkohols mit einer Trimethylsilyl-Schutzgruppe mit Imidazol als Aktivierungsagenz]] |
|||
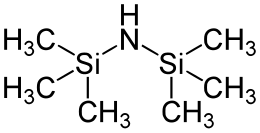
[[Datei:Hexamethylsilazane.svg | thumb | upright=1.2 | right | Hexamethylsilazan]] |
|||
Zu den wichtigsten Schutzgruppen von Alkoholen und auch Phenolen zählen wohl die sehr gut untersuchten und dokumentierten trisubstitituierten Silylether. Dabei trägt das Silizium als organische Reste sowohl Alkyl– als auch Arylgruppen. Dieser Typ an Schutzgruppen hat den Vorteil dass sie sich bezüglich der Einführung aber noch mehr bezüglich der Abspaltung sehr gut moderierbar sind. Hergestellt werden diese Ether entweder in einer [[Williamson-Ethersynthese]] aus dem Chlorsilan und einem Alkoholat-Ion oder aber durch die Verwendung von Aktivierungsreagenzien wie Imidazol. |
|||
Für reine analytische Zwecke um z. B. ein Kohlenhydrat mit Hilfe von GC-MS detektieren zu können und flüchtig zu machen existieren kommerziell erhältliche Reaktionskits.<ref>P. Vouros: In Chemical derivatization in gas chromatographie-mass spectrometrie, in "Mass Spectrometrie", Degger, New York, 1979, Bd. 2, S. 129.</ref> Silylether sind grundsätzlich empfindlich gegenüber Säuren und Fluorid-Ionen. Letzteres wird meist für deren Spaltung ausgenutzt. Die kommerziellen Preise der Chlorsilane ist jedoch je nach Substitution sehr unterschiedlich. Das preiswerteste Chlorsilan ist hier das Chortrimethylsilan (TMS-Cl), was ein Abfallprodukt der Silicon-Herstellung nach Rochow und Müller ist. Eine andere gebräuchliche Quelle der Trimethylsilyl-Gruppe ist das Hexamethyldisilazan (HMDS). Jedoch sind die Trimethylsilylether auch extrem empfindlich und werden daher heute selten als Schutzgruppe benutzt. |
|||
{| class="wikitable" |
|||
|- |
|||
! Name|| Formel !! Abkürzung !! Spaltung |
|||
|- |
|||
|[[Trimethylsilylgruppe | Trimethylsilyl]] || [[Datei:Trimethylsilyl group.PNG | 100px]] || TMS || Kaliumfluorid, Essigsäure oder Kaliumcarbonat in Methanol<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 29 ISBN 3-13-135601-4.</ref> |
|||
|- |
|||
|[[Triethylsilylgruppe | Triethylsilyl]] || [[Datei:Tes is.svg | 100px]] || TES || 10-100 mal stabiler als eine TMS-Gruppe;<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 31 ISBN 3-13-135601-4.</ref> Trifluoressigsäure in Wasser/THF,<ref>T.K Jones, R.A. Reamer, R. Desmond, S.G. Mills: In ''J. Am. Chem. Soc.'' '''1990''', ''112'', 2998.</ref> Essigsäure in Wasser/Tetrahydrofuran,<ref>D. Seebach, H.-F. Chow, R.F.W. Jackson, M.A. Sutter: In ''Liebigs Ann. Chem.'' ''1986'', 1281.</ref> Fluorwasserstoffsäure, Pyridinium hydrofluorid in Pyridin<ref>D.A. Evans, S.W. Kaldor, T.K. Jones, J. Clardy: In ''J. Am. Chem. Soc.'' '''1990''', ''112'', 7001.</ref> |
|||
|- |
|||
|''[[tert-Butyldimethylsilylgruppe | tert.''-Butyldimethylsilyl]] || [[Datei:Tbs is.svg |100px]] || TBS, TBDMS || Essigsäure in Tetrahydrofuran/Wasser,<ref>J.A. Marshall, R. Seddrani: in ''J. Org. Chem.'' '''1991''', ''56'', 5496.</ref> Pyridinium tosylat in Methanol,<ref>J.D. White, M. Kawasaki: In ''J. Am. Chem. Soc.'' '''1990''', ''112'', 4991.</ref> Trifluoressigsäure in Wasser,<ref>M.J. Robins, V. Samno, M.D. Johnson: In ''J. org. Chem.'' '''1990''', ''55'', 410.</ref> Fluorwasserstoffsäure in Acetonitril,<ref>R. F. Newton, D.P. Reynolds, C.F. Webb, S.M. Roberts: In ''J. Chem. Soc., Perkin Trans I'' '''1981''', 255.</ref> Pyridinium hydrofluorid in Tetrahydrofuran,<ref>K.C. Nicolaou, R.. Daines, T.K. Chakraborty: In ''J. Am. Chem. Soc.'' '''1987''', ''109'', 2208.</ref> Tetrabutylammoniumfluorid in THF<ref>L.A. Paquett, A.M. Doherty, C.M. Rayner: In ''J. Am. Chem. Soc.'' '''1991''', ''109'', 2208.</ref> |
|||
|- |
|||
|[[tert-Butyldiphenylsilylgruppe | ''tert.''-Butyldiphenylsilyl]] || [[Datei:Tbdbs is.svg |100px]] || TBDPS || Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten (100-250 mal langsamer als TBS und 5-10 mal langsamer als TIPS; Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridinium hydrofluorid in Tetrahydrofuran<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 38-39 ISBN 3-13-135601-4.</ref> |
|||
|- |
|||
|[[Triethylsilylgruppe | Triisopropylsilyl]] || [[Datei:Tips is.svg | 100px]] || TIPS || Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten; Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridinium hydrofluorid in Tetrahydrofuran<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 40 ISBN 3-13-135601-4.</ref> |
|||
|} |
|||
Eine weitere Klasse an Schutzgruppen für Alkohole sind die Alkylether. Auch hier gibt es vielfältige und orthogonale Möglichkeiten die Ether zu spalten. Aliphatische Methoxyether sind nur schwer und unter drastischen Bedingungen zu spalten so dass diese im Allgemeinen nur bei Phenolen zum Einsatz kommen. |
|||
{| class="wikitable" |
|||
|- |
|||
! Name|| Formel !! Abkürzung !! Spaltung |
|||
|- |
|||
|[[Methylgruppe | Methyl]] || [[Datei:Me is.svg | 80px]] || Me || In der Regel nur für Phenole gebräuchlich;Iodtrimethylsilan in Chloroform, Dichlormethan oder Acetonitril,<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 43 ISBN 3-13-135601-4.</ref> Bortribomid oder Bortrichlorid in Dichlormethan,<ref>[http://orgsyn.org/orgsyn/pdfs/CV5P0412.pdf J.F.W. McOmie, D.E. West: In "3,3'-Dihyroxybiphenyl" ''Org. Synth.'' '''1969''', ''49'', 50]</ref> Lewis-Säuren (Aluminiumchlorid, Bortrifluorid in Gegenwart von Thiolen)<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 43 ISBN 3-13-135601-4.</ref> |
|||
|- |
|||
|[[Benzylgruppe | Benzyl]] || [[Datei:Bn is.svg | 100px]] || Bn || Reduktiv; Katalytische Hydrierung (Palladium auf Aktivkohle, Raney-Nickel oder Rhodium auf Aluminiumoxid als Katalysator)<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 46-49 ISBN 3-13-135601-4.</ref> |
|||
|- |
|||
|[[4-Methoxybenzylgruppe | ''p''-Methoxybenzyl]] || [[Datei:PMB is.svg | 100px]] || PMB, MPM || Oxidativ; DDQ (Dichlordicyanochinon) in Dichlormethan,<ref>Y. Oikawa, T. Yoshioka, O. Yonemitsu: In ''Tetrahedron Lett.'' '''1982''', ''23'', 855.</ref> Cerammoniumchlorid in Wasser<ref>R. Johansson, B. Samuelsson: In ''J. Chem. Soc., Perkin Trans I'' '''1984''', 2371.</ref> |
|||
|- |
|||
|[[3,4-Dimethoxybenzylgrupp | 3,4-Dimethoxbenzyl]] || [[Datei:DMB is.svg | 100px]] || DMB, DMPM || Wie PMB oxidativ; DDQ (Dichlordicyanochinon) in Dichlormethan, Cerammoniumchlorid in Wasser<ref>Literatur wie ''p''-Methoxybenzyl</ref> |
|||
|- |
|||
|[[Triphenylmethylgruppe | Triphenylmethyl (Trityl)]] || [[Datei:Tr is.svg | 100px]] || Tr || Sauer; Ameisensäure in Ether oder Wasser,<ref>M. Bessodes, D. Komiodis, K. Antonakis: In 'Tetrahedron Lett.'' '''1986''', ''27'' 579.</ref> 80% Essigsäure,<ref>B. Helferich: In ''Carbonhydr. Chem. Biochem'' '''1948''', ''3'', 79</ref> 1 M Salzsäure<ref>M.L. García, J. Pascual, L. Borràs, J.A. Andreu, E. Fos, D. Mauleón, G. Carganico, F. Arcamone: In ''Tetrahedron'' '''1991''', ''47'', 10023.</ref> |
|||
|- |
|||
|[[Butylgruppe | ''tert.''-Butyl]] || [[Datei:TBu is.svg | 100px]] || || Sauer; Wasserfreie Trifluoressigsäure, Bromwasserstoffsäure/Essigsäure, 4 N Salzsäure<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 59-60 ISBN 3-13-135601-4.</ref> |
|||
|- |
|||
|[[Allylgruppe | Allyl]] || [[Datei:Allyl is.svg | 100px]] || || Kalium-''tert.''-Butanol,<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 62 ISBN 3-13-135601-4.</ref> Palladium auf Aktivkohle, DABCO in Methanol, diverse Platin-Element-Komplexe – anschließend saure Aufarbeitung<ref>R.E. Ireland, D,W. Norbeck: In ''J. Am. Chem. Soc.'' '''1985''', ''107'', 3279.</ref> |
|||
|- |
|||
|[[Allyloxycarbonylgruppe | Allyloxycarbonyl]] || [[Datei:Alloc is.svg | 100px]]|| Alloc || Wie Allyl; Kalium-''tert.''-Butanol, Palladium auf Aktivkohle, DABCO in Methanol, diverse Platin-Element-Komplexe – anschließend saure Aufarbeitung<ref>Literatur siehe Allyl</ref> |
|||
|- |
|||
|[[Methoxymethylgruppe | Methoxymethyl]] || [[Datei:MOM is.svg | 100px]] || MOM || Sauer; 6 N Salzsäure in Tetrahydrofuran/Wasser<ref>P.A. Wender, C.R.D. Correira: In ''J. Am. Chem. Soc.'' '''1987''', ''104'', 2523.</ref> |
|||
|- |
|||
|[[Methylthomethylgruppe | Methylthiomethyl]] || [[Datei:MTM is.svg | 100px]] || MTM || Quecksilber(II)-Chlorid/Calciumcarbonat in Acetonitril/Wasser,<ref>E.J. Corey, M. Bock: In ''Tetrahedron Lett.'' '''1975''', 3269.</ref> Silbernitrat in Tetrahydrofuran/Wasser<ref>E.J. Corey, D.H. Hua, B.-C. Pan, S.P. Seitz: In ''J. Am. Chem. Soc.'' '''1982''', ''104'', 6818.</ref> |
|||
|- |
|||
|[[2-Methoxyethoxy)methylgruppe | (2-Methoxyethoxy)methyl]] || [[Datei:MEM is.svg | 100px]] || MEM || Wässrige Bromwasserstoffsäure in Tetrahydrofuran,<ref>S. David, A. Thieffry, A. Veyrièses: In ''J. Chem. Soc., Perkin Trans I'' '''1981''', 1796.</ref> Zinkbromid in Dichlormethan<ref>K. Fuji, S. Nakano, E. Fujita: ''Synthesis'' '''1975''', 276.</ref> |
|||
|- |
|||
|[[Benzyloxymethylgruppe | Benzyloxymethyl]] || [[Datei:BOM is.svg | 100px]] || BOM || Vergleichbar mit der Stabilität von MOM, MEM und SEM; <ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 77 ISBN 3-13-135601-4.</ref> Reduktiv; Natrium in flüssigem Ammoniak,<ref>H. Nagaoka, W. Rutsch, G. Schmidt, H. Ito, M.R. Johnson, Y. Kishi: In ''J. Am. Chem. Soc.'' '''1980''', ''102'', 7962.</ref><ref>W.C. Still, D.J. Mobilio: In '' J. org. Chem.'' '''1983''', ''48'', 4785.</ref> Katalytische Hydrierung (Palladiumhydroxyd auf Aktivkohle), Raney-Nickel in Ethanol<ref>M. Hirama, M.J. Uei: In ''J. Am. Chem. Soc.'' '''1982''', ''104'', 4251.</ref><ref>W.C. Still, S. Murata, G. Revial, K. Yoshihara: In ''J. Am. Chem. Soc.'' '''1983''', ''105'', 625.</ref> |
|||
|- |
|||
|[[(Trimethylsilyl)ethoxymethylgruppe | β-(Trimethylsilyl)ethoxymethyl]] || [[Datei:SEM is.svg | 130px]] || SEM || Labiler als MEM und MOM gegenüber saurer Hydrolyse; 0.1 M Salzsäure in Methanol,<ref>R.C. Gadwood, R.M. Lett, J.E. Wissinger: In ''J. Am. Chem. Soc.'' '''1984''', ''106'', 3869.</ref> konzentrierte Fluorwasserstoffsäure in Acetonitril,<ref>J.D. White, M. Kawasaki: In ''J. Am. Chem. Soc.'' '''1990''', ''112'', 4991.</ref> Bortrifluorid-Etherat in Dichlormethan,<ref>S. Burk, G.J. Pacofsky: In ''Tetrahedron Lett.'' '''1986''', ''27', 445.</ref> Tetrabutylammoniumfluorid in HMPT (Hexamethylphosphorsäuretriamid) oder in Tetrahydrofuran<ref>T. Kan, M. Hashimoto, M. Yanagiya, H. Shirahama: In ''Tetrahedron Lett.'' '''1988''', ''29'', 5417.</ref><ref>J.P. Marino, S.I. Dax: ''J. org. Chem.'' '''1984''', ''49'', 3671.</ref> |
|||
|- |
|||
|[[Tetrahydropyranylgruppe | Tetrahydropyranyl]] || [[Datei:THP is.svg | 80px]] || THP || Essigsäure in Tetrahydrofuran/Wasser,<ref>K.F. Bernardy, M.B. Floyd, J. Poletto, M.J. Weiss: In ''J. org. Chem.'' '''1979''', ''44'', 1438.</ref> ''p''-Toluolsulfonsäure in Methanol<ref>E.J. Corey, H. Niwa, J. Knolle: In ''J. Am. Chem. Soc.'' '''1978''', ''100'', 1942</ref> |
|||
|} |
|||
=== 1,2-Diole === |
|||
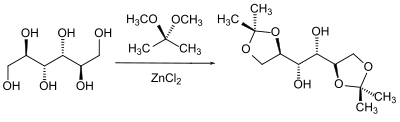
Eine besondere Klasse von Alkoholen in der Schutzgruppen-Chemie stellen die 1,2-Diole ([[Glykole]]) dar. Die Nachbarstellung von zwei Hydroxylgruppen kann man z. B. bei [[Zucker]]n dazu ausnutzen dass man beide Hydroxylgruppen abhängig von einander als [[Acetale | Acetal]] schützt. Gebräuchlich sind hier die [[Benzylgruppe | Benzyliden–]], [[Isopropylgruppe | Isopropyliden–]] und [[Cyclohexylgruppe | Cyclohexyliden–]] bzw. [[Cyclopentylgruppe | Cyclopentyliden]]-Acetale. |
|||
[[Datei:Acetals is.svg | 400px | center | Gebräuchliche Acetale]] |
|||
Die Herstellung der Acetale erfolgt in der Regel durch Verschieben des Gleichgewichtes eines Gemisches des Glycols mit der Carbonyl-Komponenten durch Entfernen des Reaktionswassers oder durch Umacetalisierung mit einem einfachen Acetal und dem Entfernen des entstehenden Alkohol aus dem Reaktionsgemisch. |
|||
[[Datei:Acetals formation is.svg | 400px | center | Herstellung von Acetalen]] |
|||
Gerade in der Zuckerchemie wird hier die unterschiedliche Stellung der Hydroxylgruppen zueinander ausgenutzt um diese in bestimmter stereochemischer Abhängigkeit selektiv zu schützen. So reagieren zwei benachbarte Hydroxylgruppen bevorzugt, neben anderen möglichen Kombinationen, bevorzugt miteinander welche die stabilste Konformation bildet.<ref>P. Collins, R. Ferrier: Monosacharides - Their Chemistry and their Roles in Natural Products. Wiley West Sussex 1995, ISBN 0-471-95343-1.</ref><ref>[http://orgsyn.org/orgsyn/pdfs/CV9P0450.pdf Christopher R. Schmid, Jerry D. Bryant: In <small>D</small>-''(''R'')-Glycerinaldehyd Acetonide'' ''Org. Synth.'' '''1995''', ''72'', 6.]</ref> |
|||
[[Datei:Glycerinaldehyd Acetonide is.svg | 400px | center | Darstellung von Glycerinaldehydacetonid]] |
|||
Acetale können grundsätzlich in wässrigen sauren Lösungsmitteln wieder gespalten werden. Einen besonderen Fall stellt hier die Benzyliden-Schutzgruppe dar die auch reduktiv gespalten werden kann. Dies erfolgt entweder durch katalytische Hydrierung oder durch den Hydriddonor [[Diisobutylaluminiumhydrid]] (DIBAL). Die Spaltung durch DIBAL entschützt jedoch nur eine Alkoholgruppe da der Benzylrest auf der zweiten und sterisch gehinderteren Hydroxylgruppe als Benzylether verbleibt.<ref>A. Lipták, J. Imre, J. Harangi, P. P. Nánási, A. Neszmélyi: In ''Tetrahedron'' '''1982''', ''38'', 3721.</ref> |
|||
[[Datei:DIBAL Bn is.svg | 400px | center]] |
|||
=== Carbonylgruppen === |
|||
Carbonylgruppen sind vor allem durch nucleophile Angriffe wie [[Grignard-Reagenz]]ien oder von Hydrid-Ionen gefährdet. Aldehyde können zusätzlich noch zu Carbonsäuren oxidiert werden. Aber auch unerwünschte Reaktionen die durch saurer– und basen-katalysierte Reaktionen der Carbonylgruppe wie z. B. [[Aldolreaktion]]en können durch eine geeignete Schutzgruppe verhindert werden. |
|||
Die gebräuchlichste Schutzgruppe für Carbonylgruppen sind Acetale und hier besonders cyclische Acetale mit Diolen. Daneben werden auch cyclische Acetale mit 1,2-Hydroxythiolen oder Dithioglycolen verwendet – den sogenannten ''O'',''S''– bzw. ''S'',''S''-Acetalen. |
|||
[[Datei:Ethylene glycol chemical structure.png | thumb | 100px | Ethylenglycol]] |
|||
Für Acetale als Schutzgruppe für Carbonylverbindungen gilt grundsätzlich das gleiche wie für Acetale als Schutzgruppe für 1,2-Diole. Sowohl die Herstellung als auch die Spaltung sind naturgemäß identisch. Allerdings spielt bei Acetalen als Schutzgruppe der Prozess einer Umacetalisierung eine untergeordnete Rolle und sie werden in der Regel aus den Glycolen durch Wasserabspaltung hergestellt. Modernere Varianten verwenden hier auch Glycole bei welchen die Hydroxyl-Wasserstoff-Atome durch eine Trimethylsilyl-Gruppe ersetzt wurde.<ref>T. Tsunoda, M. Suzuki, R. Noyori: In ''Tetrahedron Lett.'' '''1980''', ''21''1357.</ref><ref>J. Yoshinera, S. Horita, H. Hashimoto: In ''Chem. Lett.'' '''1881''', 375.</ref> Normalerweise finden einfache Glycole wie das Ethylenglycol oder das 1,3-Propandiol als Diole für die Acetale Verwendung. |
|||
Acetale könne unter sauren wässrigen Bedingungen gespalten werden. Dabei werden als Säuren die Mineralsäuren verwendet. Als Cosolvent wird häufig [[Aceton]] als Lösungsvermittler benutzt. Als nicht-sauren Abspaltmethoden gibt es die Methode mit Hilfe von [[Palladium(II)-chlorid]]-Acetonitril-Komplex in Aceton<ref>B.H. Lipshutz, D. Pollart, J. Monforte, H. Kotsuki: In ''Tetrahedron Lett.'' '''1985''', 26'', 705.</ref> oder [[Eisen(III)-chlorid]] auf [[Kieselgel]] aufgezogen in Chloroform<ref>K.S. Kim, Y.H. Song, B.H. Lee, C.S. Hahn: In ''J. org. Chem.'' '''1986''', ''51'', 404.</ref>. |
|||
Cyclische Acetale sind sehr viel stabiler gegenüber sauerer Hydrolyse als acyclische Acetale. Daher werden die Acyclischen praktisch ausschließlich benutzt wenn eine sehr milde Anspaltung nötig ist oder wenn zwei verschiedene geschützte Carbonylgruppen bezüglich ihrer Freisetzung differenziert werden müssen.<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 167-170 ISBN 3-13-135601-4.</ref> |
|||
Acetale finden jedoch neben ihrer alleinigen Funktion als Schutzgruppe zusätzlich noch Anwendung als chirales Hilfsreagenz. So können Acetale von chiralen Glycolen wie z. B. Derivate der [[Weinsäure]] mit hoher Selektivität asymmetrisch geöffnet werden und so können neue Chiralitätszentren aufgebaut werden.<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 164-167 ISBN 3-13-135601-4.</ref> |
|||
[[Datei:Lardolure is.svg | 500px | center]] |
|||
Neben den ''O'',''O''-Acetalen haben auch noch die ''S'',''O''– und ''S'',''S''-Acetale eine Bedeutung, wenn auch geringere, als Carbonylschutzgruppe. [[Thiole]] welche man zur Herstellung dieser Acetale einsetzen muss haben einen sehr unangenehmen Geruch und sind giftig was die Anwendung sehr einschränkt. [[Thioacetal]]e und die gemischten ''S'',''O''-Acetale sind sehr viel stabiler gegenüber saurer Hydrolyse gegenüber den reinen ''O'',''O''-Acetalen. Dies ermöglicht die selektive Spaltung dieser in Gegenwart von [[Schwefel]]-geschützten Carbonylgruppen. |
|||
Die Herstellung der ''S'',''S''-Acetalen erfolgt normalerweise analog der ''O'',''O''-Acetalen durch saurer Katalyse aus den Dithiolen und der Carbonylkomponente. Aufgrund der großen Stabilität dieser Schwefelacetale liegt das Gleichgewicht auf der Seite der Acetale und es muss zum Unterschied zu den ''O'',''O''-Acetalen kein Reaktionswasser entfernt werden um das Gleichgewicht zu verschieben.<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 176 ISBN 3-13-135601-4.</ref> |
|||
''S'',''O''-Acetale werden um den Faktor 10.000 schneller hydrolysiert als die entsprechenden ''S'',''S''-Acetale. Ihre Herstellung erfolgt in Analogie zu diesen aus den Thioalkoholen aber auch ihre Spaltung erfolgt unter vergleichbaren Bedingungen und vorwiegend durch Quecksilber(II)-Verbindungen in wässrigem Acetonitril.<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 178-180 ISBN 3-13-135601-4.</ref> |
|||
Für Aldehyde ist eine temporäre Schützung der Carbonylgruppe in Anwesenheit von Ketonen beschrieben. Hier wird ausgenutzt dass Aldehyde eine sehr viel höhere Carbonylaktivität aufweisen als Ketone und dass viele Additionsreaktionen reversibel sind.<ref>S.H. Danishefsky, N.B. Mantlo, D.S. Yamashita, G. Schulye: In ''J. Am. Chem. Soc.'' '''1988''', ''110'', 6890.</ref><ref>J.N. Heseltine, M.P. Cabal, N.B. Mantlo, N. Iwasawa, D.S. Yamashita, R.S. Coleman, S.J. Danishefsky, G.K. Schulte: In ''J. Am. Chem. Soc.'' '''1991''', ''113'', 3850.</ref> |
|||
[[Datei:Danishefsky endiine is.svg | 500px | center | Temporäre Schützung eines Aldehydes]] |
|||
=== Carboxylgruppen === |
|||
Die wichtigsten Schutzgruppen für Carboxylat-Gruppen sind die Ester von verschiedenen Alkoholen. Daneben sind auch noch Ortho-Ester und Oxazoline in Gebrauch aber von untergeordneter Bedeutung. Für die Herstellung von Carbonsäureester gibt es grundsätzlich verschiedene Methoden:<ref>P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 119 ISBN 3-13-135601-4.</ref> |
|||
* Direkte Veresterung von Carbonsäuren und Alkoholkomponente. Aufgrund der ungünstigen Gleichgewichtslage bei der Reaktion zwischen Alkoholen und Carbonsäuren muss das Gleichgewicht entweder durch das Entfernen des Reaktionswassers oder aber durch das Arbeiten mit großen Überschüssen an Alkohol erfolgen. Dazu muss der Alkohol jedoch sehr preiswert sein. Diese Reaktion ist säurekatalysiert (Schwefelsäure, ''p''-Toluolsulfonsäure oder saure Ionentauscher sind die gebräuchlichsten Veresterungskatalysatoren) |
|||
* Die Reaktion von Säureanhydriden oder Säurechloriden mit Alkoholen in Gegenwart von Hilfsbasen. Als Hilfsbase findet hier häufig Pyridin Diisopropylethylamin oder Triethylamin Anwendung. Diese Reaktion kann mit 4-''N'',''N''-Dimethylaminopyridin katalysiert werden was die Reaktiongeschwindigkeit im Vergleich zu reinem Pyridin um den Faktor 10<sup>4</sup> steigert. Diese Veresterungsmethoden sind im Vergleich zu der direkten Veresterung schon eine recht milde Methode. |
|||
* Die Reaktion von Carbonsäuresalzen mit Alkylhalogeniden ist eine weitere Methode zur Herstellung von Carbonsäureestern. |
|||
* Die Reaktion von Carbonsäuren mit Olefinen ist eine sanfte Methode zur Herstellung von ''tert-''-Butylester. Hier wird Isobuten mit der Carbonsäure in Gegenwart einer starken Säure wie Schwefelsäure umgesetzt. |
|||
* Die Reaktion von Carbonsäuren mit Diazoalkyane ist eine sehr sanfte und quantitative Methode um Ester herzustellen. Sie wird aufgrund der schlechten Zugänglichkeit von komplexen Diazoalkanen jedoch meist nur für die Herstellung von Methyl- und Benzhydril-Estern benutzt. |
|||
Neben diesen klassischen Methoden der Veresterung wurden für Fälle bei denen diese nicht anwendbar waren weitere und modernere Methoden entwickelt. |
|||
* Die Aktivierung der Carbonsäure mit Cyclohexlcarbodiimid und Umsetzung des so erhaltenen ''O''-Acylisoharnstoffes mit der Alkoholkomponente in Gegenwart von 4-''N'',''N''-Dimethylaminopyridin ([[Steglich-Veresterung]]). |
|||
* Die Aktivierung der Carbonsäure durch Herstellung eines gemischten Anhydrides mit der [[2,4,6-Trichlorbenzoesäure]] durch Umsetzung der Carbonsäure mit dem Benzyoylchlorid in Gegenwart von 4-''N'',''N''-Dimethylaminopyridin und Triethylamin. Das gemischte Anhydrid wird ''in situ'' hergestellt und sofort weiter mit der Alkoholkomponete umgesetzt ([[Yamaguchi-Veresterung)]]. |
|||
* Die Aktivierung der Alkoholkomponete durch die Umsetzung unter [[Mitsunobu-Reaktion | Mitsunobu-Bedingungen]] mit [[Diethylazodicarboxylat]] und Triphenylphosphin und anschließenden Umsetzung ''in situ'' mit der Carbonsäure ([[Mitsunobu-Veresterung]]) |
|||
Als Alkoholkomponente können verschiedene Gruppen dienen. Sehr gebräuchlich sind hier jedoch die Methyl-, die ''tert.''-Butyl, die Benzyl- und die Allylester. Darüber hinaus kommen noch eine Reihe Schutzgruppen hinzu welche sich aus den Ether-Schutzgruppen der Hydroxylgruppen herleiten. Die spezifischen Abspaltbedingungen sind jedoch häufig sehr ähnlich. Grundsätzlich kann jeder Ester in Anwesenheit von Hydroxydionen in wässrig-alkoholischer Lösung hydrolysiert werden. Bei empfindlicheren Substraten verwendet man jedoch häufig [[Lithiumhydroxid]] in Tetrahydrofuran und in Anwesenheit von Methanol. Für die Hydolysetendenz gelten naturgemäß die gleichen Regeln wie bei den Estern als Alkoholschutzgruppe. |
|||
{| class="wikitable" |
|||
|- |
|||
! Name|| Formel !! Abkürzung !! Spaltung || Besondere Herstellung |
|||
|- |
|||
| Methyl|| [[Datei:Me is.svg | 80px]] || Me || Nucleophil-alkalisch durch Metallhydroxide oder Carbonate in wässrigem Methanol oder Tetrahydrofuran, Alkalymetallhalogenide in feuchten aprotischen Lösungsmitteln wie Dimethylsulfoxid, ''N'',''N''-Dimethylformamid in der Hitze, Enzymatisch z. B. durch Schweineleberesterase || Diazomethan in Diethylether, Cäsiumcarbonat und Methyliodid in ''N'',''N''-Dimethylformamid, Methanol und katalytisch Trimethylsilylchlorid |
|||
|- |
|||
|''tert.''-Butyl || [[Datei:TBu is.svg | 100px]] || tert.-Bu || Sauer; Trifluoressigsäure (rein oder in Dichlormethan), Ameisensäure, ''p''-Toluolsulfonsäure || Isobuten in Dioxan und katalytisch Schwefelsäure |
|||
|- |
|||
|Benzyl || [[Datei:Bn is.svg | 100px]] || Bn || Hydrogenolyse; Wasserstoff Palladium auf Aktivkohle || |
|||
|- |
|||
|Benzhydryl || [[Datei:Benzhydrol is.svg |70px]] || || Hydrogenolyse; Wasserstoff Palladium auf Aktivkohle (Sehr leicht zu spalten) || |
|||
|- |
|||
|Allyl || [[Datei:Allyl is.svg | 100px]] ||Allyl || Analog der Ether; Kalium-tert.-Butanol, Palladium auf Aktivkohle, DABCO in Methanol, diverse Platin-Element-Komplexe – anschließend saure Aufarbeitung || |
|||
|} |
|||
=== Alkene === |
|||
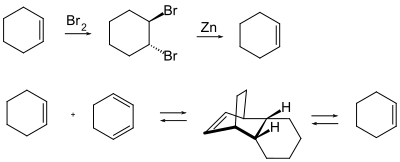
Alkene werden und müssen selten durch eine Schutzgruppe geschützt werden. Sie sind in der Regel nur durch elektrophile Angriffe, Isomerisierung und bei der katalytischen Hydrierung von unerwünschten Nebenreaktionen betroffen- Grundsätzlich kennt man zwei Schutzgruppen. |
|||
* Die temporäre Halogenierung mit Brom zur ''trans''-1,2-Dibromalkyl-Verbindung. Die Regeneration des Alkens erfolgt unter Wiederherstellung der Konformation durch elementaren Zink. |
|||
* Die Schützung durch eine [[Diels-Alder-Reaktion]]. Die Umsetzung eines Alkens mit einem Dien führt zu einem cyclischem Alken welches jedoch auch ein ähnliches Gefährdungspotential aufweist. Die Abspaltung des Diens als Schutzgruppe erfolgt thermisch da es sich bei einer Diels-Alder-Reaktion um eine reversible bzw. Gleichgewichtsreaktion handelt. |
|||
[[Datei:Alkene protecting groups is.svg|center|400px|Schema Alken Schutzgruppen]] |
|||
=== Alkine === |
|||
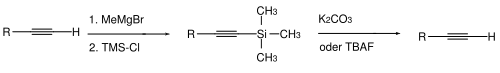
Für Alkine kennt man zwei Typen von Schutzgruppen. Es ist manchmal notwendig bei einem terminalen Alkin das acide Wasserstoffatom zu maskieren. Dies erfolgt normalerweise durch Deprotonierung (starke Basen wie Methylmagnesiumbromid oder Butyllithium in Tetrahydrofuran/Dimethylsulfoxid) und anschließender Umsetzung mit Chlortrimethylsilan zum terminal TMS-geschützten Alkin. Die Abspaltung erfolgt Hydrolytisch – mit Kaliumcarbonat in Methanol oder durch Fluorid-Ionen – Tetrabutylammoniumfluorid. |
|||
[[Datei:Alkin tms is.svg | center | 500px | TMS-Alkinschützung]] |
|||
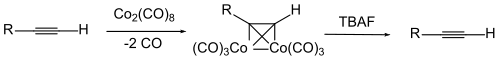
Um die Mehrfachbindung selber zu schützen wird manchmal ein Komplex der Alkin-Verbindung mit Di-Cobaltoctacarbonyl benutzt. Die Abspaltung des Cobalts erfolgt durch Oxidation. |
|||
[[Datei:Alkin Co schützung is.svg | center | 500px | Co Alkinschützung]] |
|||
== Literatur == |
== Literatur == |
||
* P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4 |
* P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4 |
||
* Peter G.M. Wuts, Theodora W. Greene: Green's Protective Groups in Organic Synthesis, Fourth Ed. John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0 |
* Peter G.M. Wuts, Theodora W. Greene: Green's Protective Groups in Organic Synthesis, Fourth Ed. John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0 |
||
* H. Waldmann: In ''Angewandte Chemie'' '''1996''', ''103'', 2192 |
|||
== Weblinks == |
== Weblinks == |
||
*[http://books.google.de/books?id=EDJrWODkoKMC&pg=PA213&dq=schutzgruppe Jan Bulle, Aloys Huttermann: ''Das Basiswissen der organischen Chemie'' (als Google-Book)] |
|||
*[[Philipps-Universität Marburg|Universität Marburg]]: [http://www.uni-marburg.de/fb15/studium/praktika/hauptfach/hauptstudium/ofp/synth/2schutzgruppen.pdf ''Schutzgruppen in der organischen Synthesechemie''] |
*[[Philipps-Universität Marburg|Universität Marburg]]: [http://www.uni-marburg.de/fb15/studium/praktika/hauptfach/hauptstudium/ofp/synth/2schutzgruppen.pdf ''Schutzgruppen in der organischen Synthesechemie''] |
||
Version vom 28. November 2010, 18:21 Uhr
Eine Schutzgruppe ist ein organischer (selten auch anorganischer) Rest der eine Funktionelle Gruppe während einem oder mehrere Syntheseschritte vor unerwünschten Angriffen schützt. Jede Funktionelle Gruppe hat ihren eigenen Satz an Schutzgruppen. Diese unterscheiden sich innerhalb einer Funktionellen Gruppe aber auch generell in ihrer Stabilität und den Bedingungen ihrer Abspaltung. Bei der Synthese vom speziellen Verbindungsklassen mit sich wiederholenden Funktionellen Gruppen, in der Regel sind dies Biomoleküle wie Peptide, Oligosaccharide oder Nucleotide, haben sich Standardsätze an Schutzgruppen etabliert. Schutzgruppen sind heute ein wichtiges Werkzeug in der modernen Synthese von komplexen Verbindungen geworden.
Die Anforderungen an eine Schutzgruppe ist recht hoch. Dazu gehören dass sie sich mit sehr guten Ausbeuten und spezifisch an einer Funktionelle Gruppen einführen lassen muss und ebenso wieder abzuspalten sein muss. Für beide Schritte sollten die Reaktionsbedingungen sehr standardisierbar sein. Sie muss unter möglichst vielen Reaktionsbedingungen stabil sein. Nach Möglichkeit müssen der Reaktionsabfall leicht abtrennbar sein. Eine optimales Schutzgruppen-Reagenz ist auch zusätzlich noch preiswert. Je breiter der Erfahrungsschatz mit einer Schutzgruppe ist um so besser ist eine Vorhersagbarkeit der Reaktivitäten der Schutzgruppe.
Geschichte

Die Geschichte der Schutzgruppentechnik ist nicht genau belegbar da sie fließend einher geht mit der Verwendung von Ausgangsverbindungen einer Synthese. Die frühen Schutzgruppen beruhten in der Regel darauf dass man die Ausgangsverbindung so wählte dass eine Funktionelle Gruppe möglichst lange blockiert war. So wurden z. B. Anisole anstatt Phenole gewählt oder Ester anstelle von freien Alkoholgruppen. Erst mit der, langsam Anfang des 20. Jahrhunderts aufkommenden, gezielte Synthese von immer komplexer werdenden Verbindungen wurde die Schutzgruppentechnik wirklich bedeutsam. Im großen Stil und auch mit einem Forschungsaufwand den man in die Chemie der Schutzgruppen investierte wurde etwa ab 1960 begonnen. Während dieser Zeit begannen Chemiker immer komplexerere Naturstoffe zu synthetisieren. Hervor zuheben während dieser Zeit sind vor allem Arbeiten von den Nobelpreisträgern Robert B. Woodward und Elias J. Corey sowie Albert Eschenmoser die bei der Synthese von komplexen Naturstoffen Pionierarbeit geleistet haben.[1][2]
Heute hat man eine Vielzahl an Schutzgruppen zur Verfügung welche in Monographien bezüglich ihrer Eigenschaften zusammen gefasst sind.[3][4] Dabei gibt es sehr etablierte Schutzgruppen und sehr viele exotische Schutzgruppen die nur für eine Synthese oder ein recht spezielles Gebiet entwickelt wurden.
Anforderungen an eine Schutzgruppe
Da Schutzgruppen-Operationen keine produktiven Schritte in einer Synthesesequenz sind, da sie lediglich ein Derivatisierungsschritt darstellen, liegen die Anforderungen an eine gute Schutzgruppe recht hoch. Hinzu kommt noch dass jeder Syntheseschritt in der Regel Entwicklungsarbeit bedarf den es gilt möglichst gering zu halten.
Als Grundanforderungen für eine gute Schutzgruppe haben sich folgende Merkmale heraus gebildet:
- Das Reagenz muss käuflich und preiswert oder leicht herstellbar sein.
- Die Schutzgruppe muss einfach, spezifisch und in hohen Ausbeuten einführbar sein.
- Sie muss stabil gegenüber einer möglichst großen Anzahl an Reaktionbedingungen und Aufarbeitungs- und Reinigungsmethoden sein.
- Sie muss spezifisch, hoch selektiv und in hohen Ausbeuten abspaltbar sein. Dabei sollten die Bedingungen standardisierbar sein.
Ein sehr wichtiger Aspekt stellt die hohe Selektivität der Abspaltung dar. Denn im Idealfall ist immer nur eine von vielen Schutzgruppen vom Abspaltungsprozess betroffen. Leider verhalten sich Schutzgruppen in der Praxis nicht immer so, wie man anhand der Literatur erwarten würde und es gibt Fälle da musste trotz großem Erfahrungsschatz sowohl für das Einführen als auch für das Abspalten Entwicklungsarbeit geleistet werden.[5][6]
Orthogonalität von Schutzgruppen

Unter Orthogonalität bei Schutzgruppen versteht man dass sich jede Schutzgruppe seperat und selektiv und alle in einer beliebigen Reihenfolge aufgrund der verschiedenen Abspaltreagenzien abspalten lassen. Dabei darf keine der anderen Schutzgruppen angegriffen werden. Im gezeigten Beispiel eines geschützten Tyrosins kann der Benzylester hydrogenolytisch, die Fluorenylmethylenoxy-Gruppe (Fmoc) wird durch Basen (wie z. B. Piperidin) und der phenolische tert.-Butylether wird sauer (z. B. mit Trifluoressigsäure) gespalten.
Ein weit verbreitetes Beispiel für diese Anwendung ist die Fmoc-Pepidsynthese die sowohl in Lösung als auch auf fester Phase eine große Bedeutung hat.[7] Die Schutzgruppe hier müssen so standardisiert sein dass sie durch von einem Automaten durchgeführt werden können und Ausbeuten weit über 99% erreicht werden müssen da sonst die Trennung des Reaktionsgemisches praktisch unmöglich ist.[8]
-
Schematische Darstellung einer Festphasen-Peptidsynthese mit orthogonalen Schutzgruppen X und Y
-
Fmoc-Festphasen Peptidsynthese mit orthogonalen Schutzgruppen
Eine weitere wichtige Anwendung von orthogonalen Schutzgruppen ist in der Kohlenhydrat-Chemie nötig. Da Kohlenhydrate über sehr gleichartige Hydroxylgruppen verfügen muss der Schutz bzw. das Entschützen von einzelnen Hydroylgruppen möglich sein. Einen ähnlichen Fall stellt die Synthese von Nucleotiden dar. Hier hat man zum einen das Problem (wie bei der Peptidsynthese) das es sich um vektorelle Moleküle handelt. Zum anderen hat man hier auch das Problem der Zuckerchemie mit dem Zuckerrest der Ribose bei der Synthese von RNA-Molekülen.
Aber auch in der Synthese von komplexen Naturstoffen oder Wirkstoffen mit vielen Funktionellen Gruppen ist man auf die Orthogonalität der Schutzgruppen angewiesen.[9][10]
Funktionelle Gruppen
Amine
Amine sind die Funktionelle Gruppe welche bei weitem die größte Vielfalt an Schutzgruppen aufweist. Dies hängt zum einen damit zusammen dass Amine in der Peptidsynthese einer besondere Wichtigkeit zukommt aber auch der Eigenschaften von Aminen. Diese sind zum einen recht potente Nucleophile aber auch verhältnismässig starke Basen. Diese Eigenschaften führen dazu, dass immer neue Schutzgruppen für Amine entwickelt wurden.[11]
Eine grosse Gruppe der Schutzgruppen für Amine gehören zu den Carbamaten. Carbamate beziehen ihre Triebkraft bei der Spaltung durch die Bildung des sehr stabilen Kohlendioxid-Moleküls. Je nach Resten des Carbamates wurden verschiedene Spaltungsmöglichkeiten entwickelt. Die am häufigsten benutzten Carbamate sind die tert.-Butyloxycarbonyl–, Benzyloxycarbonyl–, die Fluorenylmethylenoxycarbonyl– und die Allyloxycarbonyl–Verbindungen.
| Rest | Formel | Name | Abkürzung | Spaltung |
|---|---|---|---|---|
| tert.-Butyl | 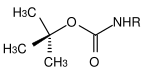 |
tert.-Butyloxycarbonyl | Boc | Sauer; Trifluoressigsäure (TFA) rein oder als Lösung in Dichlormethan[12], 3 M Salzsäure in Essigsäureethylester[13] oder 10% Schwefelsäure in Dioxan[14] |
| Benzyl | 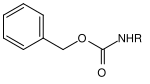 |
Benzyloxycarbonyl | Cbz oder Z | Hydrogenolytisch; Wasserstoff und Palladium auf Aktivkohle[15], Lithium oder Natrium in flüssigem Ammoniak[16] |
| Fluorenylmethylen | 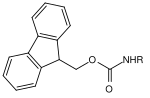 |
Fluorenylmethylenoxycarbonyl | Fmoc | Basisch; 20-50% Piperidin in Dimethylformamid[17] |
| Allyl | 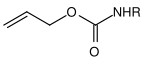 |
Allyloxycarbonyl | Alloc | Übergangsmetallkatalysiert; Metalle wie Palladium(0)– oder Nickel(0)-Komplexe[18] |
Neben den Carbamaten sind noch eine Reihe anderer N-Acyl-Derivate als Schutzgruppen von Bedeutung aber bei weitem nicht so weit verbreitet. Dazu gehören beispielsweise die Phthalimide welche entweder durch die Umsetzung der primären Amine mit Phtalsäureanhydrid oder durch den Aufbau der Aminogruppe über eine Gabriel-Synthese zugänglich sind. Die Spaltung der Phtalimide erfolgt normalerweise durch Hydrazinhydrat oder Natriumboranat.[19] Trifluoracetamide sind überaus leicht im basischen zu verseifen und daher dienen die durch die Umsetzung mit Trifluoressigsäureanhydrid erhaltenen Acetamide gelegenlich als Schutzgruppe für Amine.
Bei Indolen, Pyrrol und Imidazolen also heterocyclischen Verbindungen finden, die auf normalen Aminen für eine Schutzgruppe häufig zu stabilen N-Sulfonyl-Derivate ihre Anwendung. Die Darstellung erfolgt hier durch Sulfonierung mit Phenylsulfonylchlorid mit dem deprotonierten Heterocyclus. Die Spaltung erfolgt durch basische Hydrolyse. N-Acyl-Derivate von primären und sekundären Aminen sind zwar relativ leicht durch die Umsetzung der Amine mit einem Arylsulfonsäurechlorid zugänglich aber können nur schwer z. B. unter den Bedingungen einer Birch-Reduktion (Natrium in flüssigem Ammoniak) oder durch Umsetzung mit Natriumnaphtalid gespalten werden.
Unter den N-Alkyl-Derivaten haben die durch Alkylierung oder reduktive Alkylierung darstellbaren N-Benzyl-Derivate eine gewisse Bedeutung. Die Spaltung erfolgt wie bei der Cbz-Gruppe reduktiv und normalerweise durch katalytische Hydrierung oder durch Birch-Reduktion. N-Alkyl-Amine habe hier einen entscheidenden Nachteil gegenüber den Carbamaten oder Amiden dass der basische Stickstoff erhalten bleibt.
Alkohole
Die klassische Schutzgruppe für Alkohole sind Carbonsäureester. Häufig sind die Ester von Vorstufen käuflich erhältlich oder können leicht durch Umsetzung der Alkohole mit den Säurechloriden oder Anhydriden durch eine Schotten-Baumann-Reaktion oder aber durch Umesterung erhalten werden. Die Spaltung der Ester erfolgt in der Regel durch die Umsetzung mit Nucleophilen wie den Alkalihydroxyden, Alkali–Alkoholaten oder Lithium– bzw. Magnesium–organische Verbindungen oder aber reduktiv durch Umsetzung mit komplexen Hydriden wie Lithiumalanat. Die Reaktivität der Ester gegenüber nucleophiler Angriffe sinkt mit der sterischen Hinderung der Carbonsäure in der Reihenfolge:
Die Reaktivität der Alkohole sinkt ebenfalls mit der steigenden sterischen Hinderung der Alkohole:
Die wichtigsten Ester die als Schutzgruppen gebräuchlich sind, das sind die Essigsäureester, die Benzoesäureester und Pivalinsäureester da sie sich nach den angegebenen Reaktivitäten differenziert voneinander abspalten lassen.

Zu den wichtigsten Schutzgruppen von Alkoholen und auch Phenolen zählen wohl die sehr gut untersuchten und dokumentierten trisubstitituierten Silylether. Dabei trägt das Silizium als organische Reste sowohl Alkyl– als auch Arylgruppen. Dieser Typ an Schutzgruppen hat den Vorteil dass sie sich bezüglich der Einführung aber noch mehr bezüglich der Abspaltung sehr gut moderierbar sind. Hergestellt werden diese Ether entweder in einer Williamson-Ethersynthese aus dem Chlorsilan und einem Alkoholat-Ion oder aber durch die Verwendung von Aktivierungsreagenzien wie Imidazol.
Für reine analytische Zwecke um z. B. ein Kohlenhydrat mit Hilfe von GC-MS detektieren zu können und flüchtig zu machen existieren kommerziell erhältliche Reaktionskits.[20] Silylether sind grundsätzlich empfindlich gegenüber Säuren und Fluorid-Ionen. Letzteres wird meist für deren Spaltung ausgenutzt. Die kommerziellen Preise der Chlorsilane ist jedoch je nach Substitution sehr unterschiedlich. Das preiswerteste Chlorsilan ist hier das Chortrimethylsilan (TMS-Cl), was ein Abfallprodukt der Silicon-Herstellung nach Rochow und Müller ist. Eine andere gebräuchliche Quelle der Trimethylsilyl-Gruppe ist das Hexamethyldisilazan (HMDS). Jedoch sind die Trimethylsilylether auch extrem empfindlich und werden daher heute selten als Schutzgruppe benutzt.
| Name | Formel | Abkürzung | Spaltung |
|---|---|---|---|
| Trimethylsilyl | 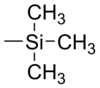 |
TMS | Kaliumfluorid, Essigsäure oder Kaliumcarbonat in Methanol[21] |
| Triethylsilyl |  |
TES | 10-100 mal stabiler als eine TMS-Gruppe;[22] Trifluoressigsäure in Wasser/THF,[23] Essigsäure in Wasser/Tetrahydrofuran,[24] Fluorwasserstoffsäure, Pyridinium hydrofluorid in Pyridin[25] |
| tert.-Butyldimethylsilyl |  |
TBS, TBDMS | Essigsäure in Tetrahydrofuran/Wasser,[26] Pyridinium tosylat in Methanol,[27] Trifluoressigsäure in Wasser,[28] Fluorwasserstoffsäure in Acetonitril,[29] Pyridinium hydrofluorid in Tetrahydrofuran,[30] Tetrabutylammoniumfluorid in THF[31] |
| tert.-Butyldiphenylsilyl | 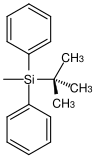 |
TBDPS | Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten (100-250 mal langsamer als TBS und 5-10 mal langsamer als TIPS; Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridinium hydrofluorid in Tetrahydrofuran[32] |
| Triisopropylsilyl |  |
TIPS | Unter gleichen Bedingungen wie TBS aber längere Reaktionszeiten; Tetrabutylammoniumfluorid in Tetrahydrofuran, Fluorwasserstoffsäure in Acetonitril, Pyridinium hydrofluorid in Tetrahydrofuran[33] |
Eine weitere Klasse an Schutzgruppen für Alkohole sind die Alkylether. Auch hier gibt es vielfältige und orthogonale Möglichkeiten die Ether zu spalten. Aliphatische Methoxyether sind nur schwer und unter drastischen Bedingungen zu spalten so dass diese im Allgemeinen nur bei Phenolen zum Einsatz kommen.
| Name | Formel | Abkürzung | Spaltung |
|---|---|---|---|
| Methyl | Me | In der Regel nur für Phenole gebräuchlich;Iodtrimethylsilan in Chloroform, Dichlormethan oder Acetonitril,[34] Bortribomid oder Bortrichlorid in Dichlormethan,[35] Lewis-Säuren (Aluminiumchlorid, Bortrifluorid in Gegenwart von Thiolen)[36] | |
| Benzyl |  |
Bn | Reduktiv; Katalytische Hydrierung (Palladium auf Aktivkohle, Raney-Nickel oder Rhodium auf Aluminiumoxid als Katalysator)[37] |
| p-Methoxybenzyl | PMB, MPM | Oxidativ; DDQ (Dichlordicyanochinon) in Dichlormethan,[38] Cerammoniumchlorid in Wasser[39] | |
| 3,4-Dimethoxbenzyl | 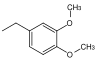 |
DMB, DMPM | Wie PMB oxidativ; DDQ (Dichlordicyanochinon) in Dichlormethan, Cerammoniumchlorid in Wasser[40] |
| Triphenylmethyl (Trityl) | 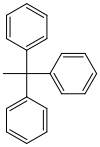 |
Tr | Sauer; Ameisensäure in Ether oder Wasser,[41] 80% Essigsäure,[42] 1 M Salzsäure[43] |
| tert.-Butyl |  |
Sauer; Wasserfreie Trifluoressigsäure, Bromwasserstoffsäure/Essigsäure, 4 N Salzsäure[44] | |
| Allyl | Kalium-tert.-Butanol,[45] Palladium auf Aktivkohle, DABCO in Methanol, diverse Platin-Element-Komplexe – anschließend saure Aufarbeitung[46] | ||
| Allyloxycarbonyl | Alloc | Wie Allyl; Kalium-tert.-Butanol, Palladium auf Aktivkohle, DABCO in Methanol, diverse Platin-Element-Komplexe – anschließend saure Aufarbeitung[47] | |
| Methoxymethyl | MOM | Sauer; 6 N Salzsäure in Tetrahydrofuran/Wasser[48] | |
| Methylthiomethyl | MTM | Quecksilber(II)-Chlorid/Calciumcarbonat in Acetonitril/Wasser,[49] Silbernitrat in Tetrahydrofuran/Wasser[50] | |
| (2-Methoxyethoxy)methyl | MEM | Wässrige Bromwasserstoffsäure in Tetrahydrofuran,[51] Zinkbromid in Dichlormethan[52] | |
| Benzyloxymethyl | BOM | Vergleichbar mit der Stabilität von MOM, MEM und SEM; [53] Reduktiv; Natrium in flüssigem Ammoniak,[54][55] Katalytische Hydrierung (Palladiumhydroxyd auf Aktivkohle), Raney-Nickel in Ethanol[56][57] | |
| β-(Trimethylsilyl)ethoxymethyl | 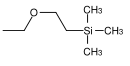 |
SEM | Labiler als MEM und MOM gegenüber saurer Hydrolyse; 0.1 M Salzsäure in Methanol,[58] konzentrierte Fluorwasserstoffsäure in Acetonitril,[59] Bortrifluorid-Etherat in Dichlormethan,[60] Tetrabutylammoniumfluorid in HMPT (Hexamethylphosphorsäuretriamid) oder in Tetrahydrofuran[61][62] |
| Tetrahydropyranyl |  |
THP | Essigsäure in Tetrahydrofuran/Wasser,[63] p-Toluolsulfonsäure in Methanol[64] |
1,2-Diole
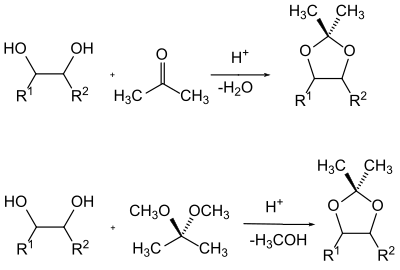
Eine besondere Klasse von Alkoholen in der Schutzgruppen-Chemie stellen die 1,2-Diole (Glykole) dar. Die Nachbarstellung von zwei Hydroxylgruppen kann man z. B. bei Zuckern dazu ausnutzen dass man beide Hydroxylgruppen abhängig von einander als Acetal schützt. Gebräuchlich sind hier die Benzyliden–, Isopropyliden– und Cyclohexyliden– bzw. Cyclopentyliden-Acetale.

Die Herstellung der Acetale erfolgt in der Regel durch Verschieben des Gleichgewichtes eines Gemisches des Glycols mit der Carbonyl-Komponenten durch Entfernen des Reaktionswassers oder durch Umacetalisierung mit einem einfachen Acetal und dem Entfernen des entstehenden Alkohol aus dem Reaktionsgemisch.
Gerade in der Zuckerchemie wird hier die unterschiedliche Stellung der Hydroxylgruppen zueinander ausgenutzt um diese in bestimmter stereochemischer Abhängigkeit selektiv zu schützen. So reagieren zwei benachbarte Hydroxylgruppen bevorzugt, neben anderen möglichen Kombinationen, bevorzugt miteinander welche die stabilste Konformation bildet.[65][66]
Acetale können grundsätzlich in wässrigen sauren Lösungsmitteln wieder gespalten werden. Einen besonderen Fall stellt hier die Benzyliden-Schutzgruppe dar die auch reduktiv gespalten werden kann. Dies erfolgt entweder durch katalytische Hydrierung oder durch den Hydriddonor Diisobutylaluminiumhydrid (DIBAL). Die Spaltung durch DIBAL entschützt jedoch nur eine Alkoholgruppe da der Benzylrest auf der zweiten und sterisch gehinderteren Hydroxylgruppe als Benzylether verbleibt.[67]

Carbonylgruppen
Carbonylgruppen sind vor allem durch nucleophile Angriffe wie Grignard-Reagenzien oder von Hydrid-Ionen gefährdet. Aldehyde können zusätzlich noch zu Carbonsäuren oxidiert werden. Aber auch unerwünschte Reaktionen die durch saurer– und basen-katalysierte Reaktionen der Carbonylgruppe wie z. B. Aldolreaktionen können durch eine geeignete Schutzgruppe verhindert werden.
Die gebräuchlichste Schutzgruppe für Carbonylgruppen sind Acetale und hier besonders cyclische Acetale mit Diolen. Daneben werden auch cyclische Acetale mit 1,2-Hydroxythiolen oder Dithioglycolen verwendet – den sogenannten O,S– bzw. S,S-Acetalen.

Für Acetale als Schutzgruppe für Carbonylverbindungen gilt grundsätzlich das gleiche wie für Acetale als Schutzgruppe für 1,2-Diole. Sowohl die Herstellung als auch die Spaltung sind naturgemäß identisch. Allerdings spielt bei Acetalen als Schutzgruppe der Prozess einer Umacetalisierung eine untergeordnete Rolle und sie werden in der Regel aus den Glycolen durch Wasserabspaltung hergestellt. Modernere Varianten verwenden hier auch Glycole bei welchen die Hydroxyl-Wasserstoff-Atome durch eine Trimethylsilyl-Gruppe ersetzt wurde.[68][69] Normalerweise finden einfache Glycole wie das Ethylenglycol oder das 1,3-Propandiol als Diole für die Acetale Verwendung.
Acetale könne unter sauren wässrigen Bedingungen gespalten werden. Dabei werden als Säuren die Mineralsäuren verwendet. Als Cosolvent wird häufig Aceton als Lösungsvermittler benutzt. Als nicht-sauren Abspaltmethoden gibt es die Methode mit Hilfe von Palladium(II)-chlorid-Acetonitril-Komplex in Aceton[70] oder Eisen(III)-chlorid auf Kieselgel aufgezogen in Chloroform[71].
Cyclische Acetale sind sehr viel stabiler gegenüber sauerer Hydrolyse als acyclische Acetale. Daher werden die Acyclischen praktisch ausschließlich benutzt wenn eine sehr milde Anspaltung nötig ist oder wenn zwei verschiedene geschützte Carbonylgruppen bezüglich ihrer Freisetzung differenziert werden müssen.[72]
Acetale finden jedoch neben ihrer alleinigen Funktion als Schutzgruppe zusätzlich noch Anwendung als chirales Hilfsreagenz. So können Acetale von chiralen Glycolen wie z. B. Derivate der Weinsäure mit hoher Selektivität asymmetrisch geöffnet werden und so können neue Chiralitätszentren aufgebaut werden.[73]

Neben den O,O-Acetalen haben auch noch die S,O– und S,S-Acetale eine Bedeutung, wenn auch geringere, als Carbonylschutzgruppe. Thiole welche man zur Herstellung dieser Acetale einsetzen muss haben einen sehr unangenehmen Geruch und sind giftig was die Anwendung sehr einschränkt. Thioacetale und die gemischten S,O-Acetale sind sehr viel stabiler gegenüber saurer Hydrolyse gegenüber den reinen O,O-Acetalen. Dies ermöglicht die selektive Spaltung dieser in Gegenwart von Schwefel-geschützten Carbonylgruppen.
Die Herstellung der S,S-Acetalen erfolgt normalerweise analog der O,O-Acetalen durch saurer Katalyse aus den Dithiolen und der Carbonylkomponente. Aufgrund der großen Stabilität dieser Schwefelacetale liegt das Gleichgewicht auf der Seite der Acetale und es muss zum Unterschied zu den O,O-Acetalen kein Reaktionswasser entfernt werden um das Gleichgewicht zu verschieben.[74]
S,O-Acetale werden um den Faktor 10.000 schneller hydrolysiert als die entsprechenden S,S-Acetale. Ihre Herstellung erfolgt in Analogie zu diesen aus den Thioalkoholen aber auch ihre Spaltung erfolgt unter vergleichbaren Bedingungen und vorwiegend durch Quecksilber(II)-Verbindungen in wässrigem Acetonitril.[75]
Für Aldehyde ist eine temporäre Schützung der Carbonylgruppe in Anwesenheit von Ketonen beschrieben. Hier wird ausgenutzt dass Aldehyde eine sehr viel höhere Carbonylaktivität aufweisen als Ketone und dass viele Additionsreaktionen reversibel sind.[76][77]
Carboxylgruppen
Die wichtigsten Schutzgruppen für Carboxylat-Gruppen sind die Ester von verschiedenen Alkoholen. Daneben sind auch noch Ortho-Ester und Oxazoline in Gebrauch aber von untergeordneter Bedeutung. Für die Herstellung von Carbonsäureester gibt es grundsätzlich verschiedene Methoden:[78]
- Direkte Veresterung von Carbonsäuren und Alkoholkomponente. Aufgrund der ungünstigen Gleichgewichtslage bei der Reaktion zwischen Alkoholen und Carbonsäuren muss das Gleichgewicht entweder durch das Entfernen des Reaktionswassers oder aber durch das Arbeiten mit großen Überschüssen an Alkohol erfolgen. Dazu muss der Alkohol jedoch sehr preiswert sein. Diese Reaktion ist säurekatalysiert (Schwefelsäure, p-Toluolsulfonsäure oder saure Ionentauscher sind die gebräuchlichsten Veresterungskatalysatoren)
- Die Reaktion von Säureanhydriden oder Säurechloriden mit Alkoholen in Gegenwart von Hilfsbasen. Als Hilfsbase findet hier häufig Pyridin Diisopropylethylamin oder Triethylamin Anwendung. Diese Reaktion kann mit 4-N,N-Dimethylaminopyridin katalysiert werden was die Reaktiongeschwindigkeit im Vergleich zu reinem Pyridin um den Faktor 104 steigert. Diese Veresterungsmethoden sind im Vergleich zu der direkten Veresterung schon eine recht milde Methode.
- Die Reaktion von Carbonsäuresalzen mit Alkylhalogeniden ist eine weitere Methode zur Herstellung von Carbonsäureestern.
- Die Reaktion von Carbonsäuren mit Olefinen ist eine sanfte Methode zur Herstellung von tert--Butylester. Hier wird Isobuten mit der Carbonsäure in Gegenwart einer starken Säure wie Schwefelsäure umgesetzt.
- Die Reaktion von Carbonsäuren mit Diazoalkyane ist eine sehr sanfte und quantitative Methode um Ester herzustellen. Sie wird aufgrund der schlechten Zugänglichkeit von komplexen Diazoalkanen jedoch meist nur für die Herstellung von Methyl- und Benzhydril-Estern benutzt.
Neben diesen klassischen Methoden der Veresterung wurden für Fälle bei denen diese nicht anwendbar waren weitere und modernere Methoden entwickelt.
- Die Aktivierung der Carbonsäure mit Cyclohexlcarbodiimid und Umsetzung des so erhaltenen O-Acylisoharnstoffes mit der Alkoholkomponente in Gegenwart von 4-N,N-Dimethylaminopyridin (Steglich-Veresterung).
- Die Aktivierung der Carbonsäure durch Herstellung eines gemischten Anhydrides mit der 2,4,6-Trichlorbenzoesäure durch Umsetzung der Carbonsäure mit dem Benzyoylchlorid in Gegenwart von 4-N,N-Dimethylaminopyridin und Triethylamin. Das gemischte Anhydrid wird in situ hergestellt und sofort weiter mit der Alkoholkomponete umgesetzt (Yamaguchi-Veresterung).
- Die Aktivierung der Alkoholkomponete durch die Umsetzung unter Mitsunobu-Bedingungen mit Diethylazodicarboxylat und Triphenylphosphin und anschließenden Umsetzung in situ mit der Carbonsäure (Mitsunobu-Veresterung)
Als Alkoholkomponente können verschiedene Gruppen dienen. Sehr gebräuchlich sind hier jedoch die Methyl-, die tert.-Butyl, die Benzyl- und die Allylester. Darüber hinaus kommen noch eine Reihe Schutzgruppen hinzu welche sich aus den Ether-Schutzgruppen der Hydroxylgruppen herleiten. Die spezifischen Abspaltbedingungen sind jedoch häufig sehr ähnlich. Grundsätzlich kann jeder Ester in Anwesenheit von Hydroxydionen in wässrig-alkoholischer Lösung hydrolysiert werden. Bei empfindlicheren Substraten verwendet man jedoch häufig Lithiumhydroxid in Tetrahydrofuran und in Anwesenheit von Methanol. Für die Hydolysetendenz gelten naturgemäß die gleichen Regeln wie bei den Estern als Alkoholschutzgruppe.
Alkene
Alkene werden und müssen selten durch eine Schutzgruppe geschützt werden. Sie sind in der Regel nur durch elektrophile Angriffe, Isomerisierung und bei der katalytischen Hydrierung von unerwünschten Nebenreaktionen betroffen- Grundsätzlich kennt man zwei Schutzgruppen.
- Die temporäre Halogenierung mit Brom zur trans-1,2-Dibromalkyl-Verbindung. Die Regeneration des Alkens erfolgt unter Wiederherstellung der Konformation durch elementaren Zink.
- Die Schützung durch eine Diels-Alder-Reaktion. Die Umsetzung eines Alkens mit einem Dien führt zu einem cyclischem Alken welches jedoch auch ein ähnliches Gefährdungspotential aufweist. Die Abspaltung des Diens als Schutzgruppe erfolgt thermisch da es sich bei einer Diels-Alder-Reaktion um eine reversible bzw. Gleichgewichtsreaktion handelt.
Alkine
Für Alkine kennt man zwei Typen von Schutzgruppen. Es ist manchmal notwendig bei einem terminalen Alkin das acide Wasserstoffatom zu maskieren. Dies erfolgt normalerweise durch Deprotonierung (starke Basen wie Methylmagnesiumbromid oder Butyllithium in Tetrahydrofuran/Dimethylsulfoxid) und anschließender Umsetzung mit Chlortrimethylsilan zum terminal TMS-geschützten Alkin. Die Abspaltung erfolgt Hydrolytisch – mit Kaliumcarbonat in Methanol oder durch Fluorid-Ionen – Tetrabutylammoniumfluorid.
Um die Mehrfachbindung selber zu schützen wird manchmal ein Komplex der Alkin-Verbindung mit Di-Cobaltoctacarbonyl benutzt. Die Abspaltung des Cobalts erfolgt durch Oxidation.
Literatur
- P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4
- Peter G.M. Wuts, Theodora W. Greene: Green's Protective Groups in Organic Synthesis, Fourth Ed. John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0
- H. Waldmann: In Angewandte Chemie 1996, 103, 2192
Weblinks
Einzelnachweise
- ↑ K.C. Nicolaou, E.J. Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods, 1996, ISBN 3-527-29284-5.
- ↑ K.C. Nicolaou, S.A. Snyder: Classics in Total Synthesis II, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003, ISBN 3-527-30684-6.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4.
- ↑ Peter G.M. Wuts, Theodora W. Greene: Green's Protective Groups in Organic Synthesis, Fourth Ed. John Wiley & Sons Inc., Hoboken, New Jersey, ISBN 0-471-69754-0.
- ↑ Kocieński: Protecting Groups, S. 245-250
- ↑ Spitzner, D.; Oesterreich, K.; European Journal of Organic Chemistry, 2001, 10; 1883-1886
- ↑ W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, ISBN 0-19-963724-5.
- ↑ Chan, White: Fmoc Solid Phase Peptide Synthesis., S. 10–12.
- ↑ K.C. Nicolaou, E.J. Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods, VCH Verlagsgesellschaft mbH, Weinheim, 1996, S. 711–729, ISBN 3-527-29284-5.
- ↑ K.C. Nicolaou, S.A. Snyder: Classics in Total Synthesis II, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003, ISBN 3-527-30684-6.
- ↑ Kocieński: Protecting Groups, S. 186.
- ↑ N. Sakai, Y. Ohfune: In J. Am. Chem. Soc. 1992, 114, 998.
- ↑ G.L. Stahl, R. Walter, C.W. Smith: In J. org. Chem. 1978, 43, 2285.
- ↑ R.A. Houghton, A. Beckman, J.M. Ostresh: In Int. J. Pept. Protein Res. 1986, 48, 653.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 195 ISBN 3-13-135601-4.
- ↑ R.M. Williams, P.J. Sinclir, D. Zhai, D. Chen: In J.Am. Chem. Soc. 1988, '110, 1547.
- ↑ W. C. Chan, P. D. White: Fmoc Solid Phase Peptide Synthesis. Reprint 2004, Oxford University Press, S. 27-30 ISBN 0-19-963724-5.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 199-201 ISBN 3-13-135601-4.
- ↑ J.O. Osby, M.G. Martin, B. Ganem: In "An Exceptionally Mild Deprotection of Phthalimides". Tetrahedron Lett. 1984, 25, 2093. doi:10.1016/S0040-4039(01)81169-2
- ↑ P. Vouros: In Chemical derivatization in gas chromatographie-mass spectrometrie, in "Mass Spectrometrie", Degger, New York, 1979, Bd. 2, S. 129.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 29 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 31 ISBN 3-13-135601-4.
- ↑ T.K Jones, R.A. Reamer, R. Desmond, S.G. Mills: In J. Am. Chem. Soc. 1990, 112, 2998.
- ↑ D. Seebach, H.-F. Chow, R.F.W. Jackson, M.A. Sutter: In Liebigs Ann. Chem. 1986, 1281.
- ↑ D.A. Evans, S.W. Kaldor, T.K. Jones, J. Clardy: In J. Am. Chem. Soc. 1990, 112, 7001.
- ↑ J.A. Marshall, R. Seddrani: in J. Org. Chem. 1991, 56, 5496.
- ↑ J.D. White, M. Kawasaki: In J. Am. Chem. Soc. 1990, 112, 4991.
- ↑ M.J. Robins, V. Samno, M.D. Johnson: In J. org. Chem. 1990, 55, 410.
- ↑ R. F. Newton, D.P. Reynolds, C.F. Webb, S.M. Roberts: In J. Chem. Soc., Perkin Trans I 1981, 255.
- ↑ K.C. Nicolaou, R.. Daines, T.K. Chakraborty: In J. Am. Chem. Soc. 1987, 109, 2208.
- ↑ L.A. Paquett, A.M. Doherty, C.M. Rayner: In J. Am. Chem. Soc. 1991, 109, 2208.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 38-39 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 40 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 43 ISBN 3-13-135601-4.
- ↑ J.F.W. McOmie, D.E. West: In "3,3'-Dihyroxybiphenyl" Org. Synth. 1969, 49, 50
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 43 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 46-49 ISBN 3-13-135601-4.
- ↑ Y. Oikawa, T. Yoshioka, O. Yonemitsu: In Tetrahedron Lett. 1982, 23, 855.
- ↑ R. Johansson, B. Samuelsson: In J. Chem. Soc., Perkin Trans I 1984, 2371.
- ↑ Literatur wie p-Methoxybenzyl
- ↑ M. Bessodes, D. Komiodis, K. Antonakis: In 'Tetrahedron Lett. 1986, 27 579.
- ↑ B. Helferich: In Carbonhydr. Chem. Biochem 1948, 3, 79
- ↑ M.L. García, J. Pascual, L. Borràs, J.A. Andreu, E. Fos, D. Mauleón, G. Carganico, F. Arcamone: In Tetrahedron 1991, 47, 10023.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 59-60 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 62 ISBN 3-13-135601-4.
- ↑ R.E. Ireland, D,W. Norbeck: In J. Am. Chem. Soc. 1985, 107, 3279.
- ↑ Literatur siehe Allyl
- ↑ P.A. Wender, C.R.D. Correira: In J. Am. Chem. Soc. 1987, 104, 2523.
- ↑ E.J. Corey, M. Bock: In Tetrahedron Lett. 1975, 3269.
- ↑ E.J. Corey, D.H. Hua, B.-C. Pan, S.P. Seitz: In J. Am. Chem. Soc. 1982, 104, 6818.
- ↑ S. David, A. Thieffry, A. Veyrièses: In J. Chem. Soc., Perkin Trans I 1981, 1796.
- ↑ K. Fuji, S. Nakano, E. Fujita: Synthesis 1975, 276.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 77 ISBN 3-13-135601-4.
- ↑ H. Nagaoka, W. Rutsch, G. Schmidt, H. Ito, M.R. Johnson, Y. Kishi: In J. Am. Chem. Soc. 1980, 102, 7962.
- ↑ W.C. Still, D.J. Mobilio: In J. org. Chem. 1983, 48, 4785.
- ↑ M. Hirama, M.J. Uei: In J. Am. Chem. Soc. 1982, 104, 4251.
- ↑ W.C. Still, S. Murata, G. Revial, K. Yoshihara: In J. Am. Chem. Soc. 1983, 105, 625.
- ↑ R.C. Gadwood, R.M. Lett, J.E. Wissinger: In J. Am. Chem. Soc. 1984, 106, 3869.
- ↑ J.D. White, M. Kawasaki: In J. Am. Chem. Soc. 1990, 112, 4991.
- ↑ S. Burk, G.J. Pacofsky: In Tetrahedron Lett. 1986, 27', 445.
- ↑ T. Kan, M. Hashimoto, M. Yanagiya, H. Shirahama: In Tetrahedron Lett. 1988, 29, 5417.
- ↑ J.P. Marino, S.I. Dax: J. org. Chem. 1984, 49, 3671.
- ↑ K.F. Bernardy, M.B. Floyd, J. Poletto, M.J. Weiss: In J. org. Chem. 1979, 44, 1438.
- ↑ E.J. Corey, H. Niwa, J. Knolle: In J. Am. Chem. Soc. 1978, 100, 1942
- ↑ P. Collins, R. Ferrier: Monosacharides - Their Chemistry and their Roles in Natural Products. Wiley West Sussex 1995, ISBN 0-471-95343-1.
- ↑ Christopher R. Schmid, Jerry D. Bryant: In D-(R)-Glycerinaldehyd Acetonide Org. Synth. 1995, 72, 6.
- ↑ A. Lipták, J. Imre, J. Harangi, P. P. Nánási, A. Neszmélyi: In Tetrahedron 1982, 38, 3721.
- ↑ T. Tsunoda, M. Suzuki, R. Noyori: In Tetrahedron Lett. 1980, 211357.
- ↑ J. Yoshinera, S. Horita, H. Hashimoto: In Chem. Lett. 1881, 375.
- ↑ B.H. Lipshutz, D. Pollart, J. Monforte, H. Kotsuki: In Tetrahedron Lett. 1985, 26, 705.
- ↑ K.S. Kim, Y.H. Song, B.H. Lee, C.S. Hahn: In J. org. Chem. 1986, 51, 404.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 167-170 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 164-167 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 176 ISBN 3-13-135601-4.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 178-180 ISBN 3-13-135601-4.
- ↑ S.H. Danishefsky, N.B. Mantlo, D.S. Yamashita, G. Schulye: In J. Am. Chem. Soc. 1988, 110, 6890.
- ↑ J.N. Heseltine, M.P. Cabal, N.B. Mantlo, N. Iwasawa, D.S. Yamashita, R.S. Coleman, S.J. Danishefsky, G.K. Schulte: In J. Am. Chem. Soc. 1991, 113, 3850.
- ↑ P. J. Kocieński: Protecting Groups. 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, S. 119 ISBN 3-13-135601-4.