Ellagitannine
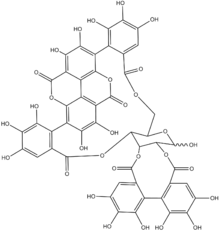

Ellagitannine (auch Ellagtannine) sind eine Gruppe von Polyphenolen und Tanninen aus Pflanzen. Der Bestandteil Ellagsäure wurde von Henri Braconnot in Anlehnung an die Gallussäure, die in Pflanzengallen gehäuft vorkommt, durch Umkehrung des Wortes Galle benannt.
Eigenschaften
Ellagitannine entstehen durch oxidative Verknüpfung von Gallussäuren, vor allem in 1,2,3,4,6-Pentagallylglucose. Dabei bilden die Gallussäuren untereinander C-C-Bindungen, im Gegensatz zu den Gallotanninen, bei denen die Bindung zwischen den Gallussäuren depsidisch ist. Ein weiterer Gegensatz zu Gallotanninen sind die Makrozyklen in Ellagitanninen, die Hexahydroxydiphenylgruppen, Gallylgruppen oder Sanguisorbylgruppen enthalten.

Die Biosynthese der Ellagitannine erfolgt über 1,2,3,4,6-Penta-O-galloyl-beta-D-glucopyranose durch eine Laccase-ähnliche Phenoloxidase zu Tellimagrandin II, gefolgt von einer weiteren Oxidation durch eine andere Phenoloxidase zu Cornusiin E (ein dimeres Ellagitannin).[1] Ellagitannine werden von der menschlichen Darmflora zu Urolithinen abgebaut.[2][3]
Beispiele
Mehr als 1000 Ellagitannine wurden beschrieben.[4] Beispiele für Ellagitannine sind Castalagin,[4] Castalin,[4] Casuarictin, Casuarinin,[4] Castanopsinine A bis H,[5] Excoecarianin,[6] Grandinin, Pterocarinine A und B,[7] Rhoipteleanine A bis G,[8] Roburin A, Tellimagrandin II, Terflavin B, Punicalagin,[4] Punicalin,[4] Punigluconin,[4] Alnusiin,[4] Alnusnin A,[4] Alnusnin B,[4] Cercidinin A,[4] Cercidinin B,[4] Chebulagsäure,[4] Chebulinsäure,[4] Corilagin,[4] Geraniin,[4] Isoterchebin,[4] Nobotanine B, C, E, G, H, I, J, und K,[4] Roxbin B,[4] Sanguiine H-2, H-3 und H-6,[4] Stachyurin,[4] Terchebin,[4] Vescalagin[4] und Vescalin.[4] Sie kommen vor allem in zweikeimblättrigen Bedecktsamern vor, wie in Myrtales, zu denen unter anderem der Granatapfel zählt.[9][10]
Analyse
Ellagitannine können per Chromatographie getrennt werden.[11] Für eine Analyse werden die Esterbindungen mit Trifluoressigsäure in wässrigem Methanol hydrolysiert. Ebenso können die Esterbindungen durch die Ellagitannin-Acylhydrolase (synonym Ellagitannase) gespalten werden.[11] Die dabei freigesetzte Hexahydroxydiphenylsäure bildet das Lacton Ellagsäure und die freigesetzte Sanguisorbinsäure das Dilacton Sanguisorbinsäuredilacton, während Gallussäure erhalten bleibt.[12]
Verwendung
Ellagitannine besitzen antientzündliche Wirkungen und werden zur Neuroprotektion,[13] zur Vorbeugung von Infektionskrankheiten,[14] Krebs,[14] chronisch-entzündlicher Darmerkrankungen[15] und Herz-Kreislauf-Erkrankungen untersucht.[15]
Die Ellagitannine Castalagin und Vescalagin aus der Stieleiche (Ellagitanninmassenanteil 4,84 %)[16] und der Traubeneiche (Ellagitanninmassenanteil 3,44 %)[16] diffundieren bei der Herstellung von Wein im Barriqueausbau aus dem Holz des Fasses in den Wein und gehören zu den Phenolen im Wein.[17] Die Ellagitannine hemmen im Wein die malolaktische Gärung.[18] Mit der Oxidation der Ellagitannine nimmt die Adstringenz ab.[18]
Literatur
- K. S. Feldman, M. R. Iyer, Y. Liu: Ellagitannin chemistry. Studies on the stability and reactivity of 2,4-HHDP-containing glucopyranose systems. In: The Journal of organic chemistry. Band 68, Nummer 19, September 2003, S. 7433–7438, doi:10.1021/jo034495x, PMID 12968897.
Einzelnachweise
- ↑ R. Niemetz, G. G. Gross: Enzymology of gallotannin and ellagitannin biosynthesis. In: Phytochemistry. Band 66, Nummer 17, September 2005, S. 2001–2011, doi:10.1016/j.phytochem.2005.01.009, PMID 16153405.
- ↑ C. D. Davis, J. A. Milner: Gastrointestinal microflora, food components and colon cancer prevention. In: The Journal of nutritional biochemistry. Band 20, Nummer 10, Oktober 2009, S. 743–752, doi:10.1016/j.jnutbio.2009.06.001, PMID 19716282, PMC 2743755 (freier Volltext).
- ↑ C. Garcia-Muñoz, F. Vaillant: Metabolic fate of ellagitannins: implications for health, and research perspectives for innovative functional foods. In: Critical reviews in food science and nutrition. Band 54, Nummer 12, 2014, S. 1584–1598, doi:10.1080/10408398.2011.644643, PMID 24580560.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x H. Yamada, S. Wakamori, T. Hirokane, K. Ikeuchi, S. Matsumoto: Structural Revisions in Natural Ellagitannins. In: Molecules. Band 23, Nummer 8, Juli 2018, S. , doi:10.3390/molecules23081901, PMID 30061530, PMC 6222896 (freier Volltext).
- ↑ M. Ageta, G.-I. Nonaka, I. Nishioka: Tannins and related compounds. LXVII : Isolation and characterization of castanopsinins A-H, novel ellagitannins containing a triterpenoid glycoside core, from castanopsis cuspidata var. sieboldii NAKAI. In: Chemical and pharmaceutical bulletin, Tokyo (Japan), JAACC, Band 36, Nummer 5, 1988, S. 1646–1663.
- ↑ Lin Jer-huei, T. Tanaka, G.-I. Nonaka, I. Nishioka, Chen Ih-sheng: Tannins and related compounds : XCVIII, Structures of three new dimeric ellagitannins, excoecarianin and excoecarinins A and B, isolated from the leaves of Excoecaria kawakamii Hayata. In: Chemical and pharmaceutical bulletin, JAACC, Band 38, Nummer 8, 1990, S. 2162–2171.
- ↑ G. Nonaka, K. Ishimaru, R. Azuma, M. Ishimatsu, I. Nishioka: Tannins and related compounds. LXXXV : Structures of novel C-glycosidic ellagitannins, grandinin and pterocarinins A and B. In: Chemical and pharmaceutical bulletin, JAACC, Band 37, Nummer 8, 1989, S. 2071–2077.
- ↑ T. Tanaka, Z.-H. Jiang, I. Kouno: Structures and biogenesis of rhoipteleanins, ellagitannins formed by stereospecific intermolecular C-C oxidative coupling, isolated from Rhoiptelea chiliantha. In: Chemical and pharmaceutical bulletin, JAACC, Band 45, Nummer 12, 1997, S. 1915–1921.
- ↑ Takashi Yoshida, Yoshiaki Amakura, Morio Yoshimura: Structural Features and Biological Properties of Ellagitannins in Some Plant Families of the Order Myrtales. In: International Journal of Molecular Sciences. 11, 2010, S. 79, doi:10.3390/ijms11010079.
- ↑ A. M. Gómez-Caravaca, V. Verardo, M. Toselli, A. Segura-Carretero, A. Fernández-Gutiérrez, M. F. Caboni: Determination of the major phenolic compounds in pomegranate juices by HPLC-DAD-ESI-MS. In: Journal of agricultural and food chemistry. Band 61, Nummer 22, Juni 2013, S. 5328–5337, doi:10.1021/jf400684n, PMID 23656584.
- ↑ a b P. Aguilar-Zarate, J. E. Wong-Paz, J. J. Buenrostro-Figueroa, J. A. Ascacio, J. C. Contreras-Esquivel, C. N. Aguilar: Ellagitannins: Bioavailability, Purification and Biotechnological Degradation. In: Mini reviews in medicinal chemistry. Band 18, Nummer 15, 2018, S. 1244–1252, doi:10.2174/1389557517666170208144742, PMID 28183264.
- ↑ T. Yoshida, Ts. Hatano, H. Ito, T. Okuda, S. Quideau: Structural diversity and antimicrobial activities of ellagitannins. In: Chemistry and Biology of Ellagitannins, World Scientific Publishing, 2009, S. 55–93.
- ↑ S. Tejada, W. N. Setzer, M. Daglia, S. F. Nabavi, A. Sureda, N. Braidy, O. Gortzi, S. M. Nabavi: Neuroprotective Effects of Ellagitannins: A Brief Review. In: Current drug targets. Band 18, Nummer 13, 2017, S. 1518–1528, doi:10.2174/1389450117666161005112002, PMID 27719661.
- ↑ a b L. Lipińska, E. Klewicka, M. Sójka: The structure, occurrence and biological activity of ellagitannins: a general review. In: Acta scientiarum polonorum. Technologia alimentaria. Band 13, Nummer 3, 2014 Jul-Sep, S. 289–299, PMID 24887944.
- ↑ a b A. K. Kiss, J. P. Piwowarski: Ellagitannins, Gallotannins and their Metabolites - The Contribution to the Anti-Inflammatory Effect of Food Products and Medicinal Plants. In: Current medicinal chemistry. Band 25, Nummer 37, 2018, S. 4946–4967, doi:10.2174/0929867323666160919111559, PMID 27655073.
- ↑ a b Jean-Louis Puech, Andrei Prida, Jean-Claude Boulet, Bacchus in Bourgogne: Second Interdisciplinary and International Wine Conference - 3rd – 4th – 5th November 2005. Effet de l’espèce et de la forêt ou "terroir" sur la teneur en ellagitanins du bois de chêne à merrain dans une forêt mixte (Quercus robur L., Quercus petraea Liebl). S. 49.
- ↑ Augustin Scalbert, Catherine Lapierre: Ellagitanins et lignines du cœur de chêne : Structure et évolution au cours du vieillissement du bois. In: Revue des Œnologues, 1994, Band 71, S. 9–12.
- ↑ a b Nicolas Vivas, Marie Francoise Nonier, Nathalie Vivas de Gaulejac: Caractérisation et rôle des ellagitanins du bois de chêne dans l'élevage des vins rouges: Interaction avec les bactéries. In: Bulletin de l'OIV, Office international de la vigne et du vin, 2006, Band 79, Nummer 901–903, S. 141–161.




