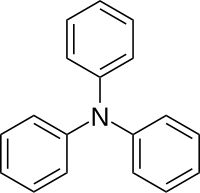
Triphenylamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triphenylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H15N | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis weiße Kristalle mit einem charakteristischen Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 245,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
0,774 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Triphenylamin ist eine aromatische organische Verbindung mit der Summenformel C18H15N. Es gehört zur Stoffklasse der tertiären Amine. Es ist hinsichtlich der Molmasse die leichteste und erste Triphenylverbindung in der Stickstoffgruppe des Periodensystems mit den weiteren Vertretern Triphenylphosphin, Triphenylarsin, Triphenylstibin und Triphenylbismutin.
Gewinnung und Darstellung
Triphenylamin kann durch Einwirkung von Natrium und Brombenzol aus Diphenylamin erhalten werden.[1][5]
Eigenschaften
Im Gegensatz zu den meisten anderen aliphatischen und aromatischen Aminen hat Triphenylamin mit einem pKB-Wert von 19 keinen stark basischen Charakter.[6] Dies ist auf die Resonanzstrukturen des Moleküls zurückzuführen, die die Nucleophilie des zentralen Stickstoffatoms deutlich abschwächen.
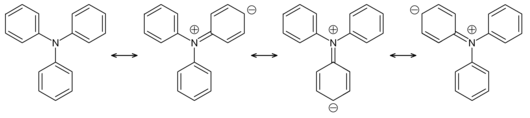
Triphenylamin und seine Derivate haben nützliche Eigenschaften in ihrer elektrischen Leitfähigkeit und Elektrolumineszenz. Sie werden aus diesem Grund in OLED-Materialien als Lochtransporter genutzt.[7]
Galerie
-
Triphenylamin in einer Petrischale
-
3D-Struktur von Triphenylamin im Kugel-Stab-Modell
-
3D-Struktur von Triphenylamin im Kalottenmodell
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Triphenylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. September 2019.
- ↑ a b Eintrag zu Triphenylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. September 2019. (JavaScript erforderlich)
- ↑ a b Datenblatt Triphenylamine, 98% bei Sigma-Aldrich, abgerufen am 5. September 2019 (PDF).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 2. November 2015.
- ↑ Touraj Manifar, Sohrab Rohani: Synthesis and Analysis of Triphenylamine: A Review. In: The Canadian Journal of Chemical Engineering. 82, 2004, S. 323–334, doi:10.1002/cjce.5450820213.
- ↑ periodensystem-online, aufgerufen am 4. September 2019.
- ↑ Wei Shi, Suqin Fan, Fei Huang, Wei Yang, Ransheng Liu, Yong Cao: Synthesis of Novel Triphenylamine-based Conjugated Polyelectrolytes and Their Application to Hole-Transport Layer in Polymeric Light-Emitting Diodes. In: J. Mater. Chem., 2006, 16, 2387–2394. doi:10.1039/B603704F







