Agrobacterium
| Agrobacterium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Agrobacterium | ||||||||||||
| Conn 1942[1][2] |
Agrobacterium ist eine von H. J. Conn 1942 eingerichtete Gattung gramnegativer Bakterien,[1][2] die DNA zwischen sich selbst und Pflanzen übertragen können. Agrobacterium-Arten können so als Vektor für horizontalen Gentransfer (HGT) bei Pflanzen fungieren und sind daher zu einem wichtigen Werkzeug für die Gentechnik geworden. Die Typusart Agrobacterium tumefaciens ist die am häufigsten untersuchte Art dieser Gattung, sie kann per HGT Tumore in Pflanzen hervorrufen.
Pflanzenpathogen
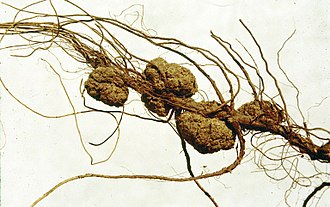

Agrobacterium tumefaciens verursacht bei Pflanzen die Kronengallenkrankheit (englisch crown-gall disease). Die Krankheit ist gekennzeichnet durch eine tumorartige Wucherung oder Galle an der infizierten Pflanze, oft an der Verbindung zwischen Wurzel und Spross. Die Tumore werden durch den Transfer eines DNA-Abschnitts („Tumor-DNA“, T-DNA, auch t-DNA) aus dem bakteriellen „tumorinduzierenden Plasmid“ (Ti-Plasmid) während einer Art Konjugation der Bakterien- mit der Pflanzenzelle ausgelöst. Auch die verwandte Art Rhizobium rhizogenes induziert Wurzeltumoren und trägt ein sog. Ri-Plasmid (von englisch root-inducing ‚wurzelinduzierend‘). Ein Ti- oder Ri-Plasmid kann bei verschiedenen Mitgliedern der Familie Rhizobiaceae (Rhizobien) gefunden werden, die der Gattung Agrobacterium respektive Rhizobium angehören. Aus Umweltproben werden aber auch Stämme der Rhizobiaceae isoliert, die weder ein Ti- noch ein Ri-Plasmid aufweisen. Diese sind für Pflanzen nicht virulent (infektiös).[3]
Die T-DNA des Plasmids wird halb zufällig in das Genom der Wirtszelle integriert,[4] worauf von der Pflanzenzelle die für die Tumor-Morphologie verantwortlichen Gene der T-DNA exprimiert werde, was zur Bildung der Galle führt. Die T-DNA trägt Gene für die biosynthetischen Enzyme zur Produktion ungewöhnlicher Aminosäuren, wie (typischerweise) Nopalin[5] oder Octopin. Sie trägt auch Gene für die Biosynthese der Pflanzenhormone Auxin und Cytokinin sowie für Opine. Diese bieten den Bakterien eine Kohlenstoff- und Stickstoffquelle bieten, die die meisten anderen Mikroorganismen nicht nutzen können, was Agrobacterium einen Selektionsvorteil verschafft.[6] Durch die Veränderung des Hormonhaushalts in der Pflanzenzelle kann die Pflanze die Teilung der infizierten Zellen nicht mehr kontrollieren, und es bilden sich Tumore. Das Verhältnis der von den Tumorgenen produzierten Hormone Auxin und Cytokinin zueinander bestimmt die Morphologie des Tumors (wurzelartig, desorganisiert oder sprossartig).
Humanpathogen
Zwar wird Agrobacterium im Allgemeinen als Pflanzenpathogen (infektiös für Pflanzen) angesehen wird, aber es kann auch Opisthokonta infizieren: Beispielsweise wird es wird zur Erzeugung transgener Pilze genutzt (s. u.). Offenbar kann es auch bei Menschen mit geschwächtem Immunsystem opportunistische Infektionen verursachen.[7][8] Allerdings hat es sich bei ansonsten gesunden Menschen nicht als primärer Krankheitserreger erwiesen. Als erstes in Verbindung mit Krankheiten beim Menschen gebracht wurde Agrobacterium radiobacter, wie 1988 vom Arzt J. R. Cain in Schottland gemeldet.[9] Eine spätere Studie deutete darauf hin, dass Agrobacterium sich an verschiedene Arten menschlicher Zellen anheftet und diese genetisch verändert, indem es seine T-DNA in das menschliche Zellgenom integriert. Die Studie wurde mit kultiviertem menschlichem Gewebe im Labor (in vitro) durchgeführt und ließ daher keine Rückschlüsse auf eine entsprechende biologische Aktivität in der Natur (in vivo) zu.[10]
Anwendungen
Die Fähigkeit von Agrobacterium, Gene auf Pflanzen und Pilze zu übertragen, wird in der Biotechnologie genutzt, insbesondere in der Gentechnik zur Pflanzenzüchtung. Genome von Pflanzen und Pilzen können mit Hilfe von Agrobacterium wie auch Rhizobium durch die Übertragung von DNA-Sequenzen, die in der T-DNA als Vektor untergebracht sind, manipuliert werden. Dabei kann ein modifiziertes Ti- (Agrobacterium) oder Ri-Plasmid (Rhizobium) verwendet werden, wenn es durch Deletion (Ausschalten bzw. Entfernen) der tumorinduzierenden Gene entschärft wird. Die einzigen wesentlichen Teile der T-DNA sind die beiden kleinen sog. Border-Repeats (spezielle DNA-Sequenzwiederholungen von 25 Basenpaaren), von denen mindestens eines für die Pflanzentransformation benötigt wird.[11][12] Dabei werden die Pflanze einzubringenden Gene zusammen mit einem selektierbaren Marker in einen Pflanzenvektor mit der entschärften T-DNA des Plasmids eingebracht. Dies ermöglicht danach die Selektion auf erfolgreich transformierte Pflanzen. Eine alternative Methode ist die sog. Agroinfiltration (s. u.).[13][14]

Die Transformation mit Agrobacterium kann auf verschiedene Weise erfolgen. Protoplasten oder alternativ Blattscheiben können mit dem Agrobacterium bebrütet und danach die ganzen Pflanzen mit Hilfe von Pflanzengewebekulturen regeneriert werden.[15]
Bei der Agroinfiltration kann Agrobacterium direkt in das Blattgewebe einer Pflanze injiziert werden. Bei dieser Methode werden nur die Zellen transformiert, die in unmittelbarem Kontakt mit den Bakterien stehen, und es kommt zu einer vorübergehenden Expression der Plasmid-DNA.[15]
Die Agroinfiltration wird üblicherweise zur Transformation von Tabak (Gattung Nicotiana) verwendet. Ein gängiges Transformationsprotokoll für Arabidopsis mit der Ackerschmalwand (A. thaliana) ist die Flower-Dip-Methode (englisch floral dip method), bei der die Blütenstände in eine Agrobacterium-Suspension getaucht werden. Das Bakterium transformiert die so die Keimbahnzellen, aus denen die weiblichen Gameten entstehen. Die Samen können dann auf den selektiven Marker untersucht und entsprechend selektiert.[16][13]
Agrobacterium infiziert nicht alle Pflanzenarten, ggf. muss auf eine der anderen wirksamen Techniken zur Pflanzentransformation wie die Genkanone zurückgegriffen werden. Agrobacterium wird von der auS-FDA als Vektor des genetischen Materials für folgende Pflanzen aufgeführt:[17]
- Sojabohne
- Baumwolle
- Mais
- Zuckerrübe
- Luzerne
- Weizen
- Raps (Canola)
- Weißes Straußgras (als Futterpflanze)
- Reis (Goldener Reis)
Die Transformation von Pilzen mit Agrobacterium wird in erster Linie zu Forschungszwecken eingesetzt.[18][19] Dies erfolgt nach ähnlichen Ansätzen wie bei der Pflanzentransformation. Das Ti-Plasmid-System wird so modifiziert, dass es DNA-Elemente zur Selektion der transformierten Pilzstämme enthält, nachdem Agrobacterium-Stämme mit diese Plasmide mit den gewünschten Pilzarten ko-inkubiert wurden.
Forschungsgeschichte
Marc Van Montagu und Jozef Schell von der Universität Gent (Belgien) entdeckten 1977 den Mechanismus des Gentransfers zwischen Agrobacterium und Pflanzen. Dies ermöglichte die Entwicklung von Methoden, mit denen Agrobacterium zu einem effizienten Trägersystem für die Gentechnik in Pflanzen benutzt werden kann:[11][12] Ein Forscherteam unter der Leitung von Mary-Dell Chilton wies 1983 als erstes nach, dass die Virulenzgene entfernt werden können, ohne die Fähigkeit von Agrobacterium, seine eigene DNA in das Pflanzengenom einzufügen, zu beeinträchtigen.[20]
Genom
Die Sequenzierung des Genoms mehrerer Agrobacterium-Spezies hat die Untersuchung der Evolutionsgeschichte dieser Organismen ermöglicht und Informationen über die Gene geliefert und damit über die Systeme, die an der Symbiose bzw. Pathogenese und der biologischen Kontrollmechanismen beteiligt sind. Eine wichtige Erkenntnis ist die Möglichkeit, dass sich bei vielen dieser Bakterien die Chromosomen aus Plasmiden entwickelt haben. Eine weitere Entdeckung ist, dass diese genetischen Elemente offenbar sowohl symbiotische als auch pathogene Lebensweisen unterstützen können. Die Verfügbarkeit der Genomsequenzen von Agrobacterium-Spezies wird sicherlich weiter zunehmen, was zu wesentlichen Erkenntnissen über die Funktion und die Evolutionsgeschichte dieser Gruppe von pflanzenassoziierten Mikroben führen dürfte.[21]

● zirkuläres Chromosom (Hauptchromosom),
● lineares Chromosom (Sekundärchromosom oder Chromid),
● At-Plasmid (pAt), und
● Ti-Plasmid (pTi).
Jeder Keil steht für ein Gen. Orangefarbene Gene entsprechen der Codon Usage der kombinierten Chromosomen, magentafarbene Gene entsprechen der Codon Usage der kombinierten Plasmide, blaugrüne Gene entsprechen sowohl den Chromosomen als auch den Plasmiden, und schwarze Gene entsprechen keinem der beiden.

Das Genom der Agrobacterium-Stämme besteht wie für Mitglieder der Familie Rhizobiaceae typisch – aber für Bakterien im Allgemeinen ungewöhnlich – aus mehreren Teilen (DNA-Molekülen):[22][23]
- dem ringförmigen Hauptchromosom
- einem linearen Sekundärchromosom, auch Chromid genannt[A. 1]
- dem Ti-Plasmid (Tumor-induzierendes Plasmid, englisch Tumor inducing plasmid)
- bei dem meisten Stämmen von A. tumefaciens[23] (z. B. beim Stamm C58[22]) noch ein sog. At-Plasmid (pAt)
Die beiden Plasmide sind – wenn vorhanden – viel kleiner als das (Haupt)-Chromosom und das Chromid.[22]
Systematik
Bis in die 1990er Jahre wurde die Gattung Agrobacterium als Papierkorb-Taxon verwendet. Mit dem Aufkommen der 16S-rRNA-Sequenzierung wurden viele Agrobacterium-Arten (insbesondere die marinen Arten) anderen (neuen) Gattungen wie Ahrensia, Pseudorhodobacter, Ruegeria und Stappia zugeordnet.[24][25] Die übrigen Agrobacterium-Arten wurden drei Biovaren zugeordnet: Biovar 1 (Agrobacterium tumefaciens), Biovar 2 (Agrobacterium rhizogenes) und Biovar 3 (Agrobacterium vitis). In den frühen 2000er Jahren wurde Agrobacterium mit der Gattung Rhizobium synonymisiert,[26] was aber umstritten blieb.[27][28] Die Debatte wurde schließlich mit der Wiedereinführung der Gattung Agrobacterium beigelegt,[29] nachdem der Nachweis erbracht worden war, dass sich beide Arten phylogenetisch unterscheiden.[30][31] Durch diese Maßnahme verblieb nur noch Biovar 1 (mit linearem Chromid und telA) bei der Gattung Agrobacterium (mit A. tumefaciens), Biovar 2 (mit ringförmigem Chromid/Plasmid und ohne telA, bis dato A. rhizogenes) wurde in Rhizobium rhizogenes umbenannt, und Biovar 3 (nur Weinreben, Gattung Vitis, infizierend, bis dato A. vitis) wurde in Allorhizobium vitis umbenannt.[30][31] Die Agrobacterium-Arten haben eine für sie typische Synapomorphie gemeinsam haben: das Gen telA für eine Protelomerase.[32] Dadurch werden alle Mitglieder der Gattung zum Träger des für Bakterien ungewöhnlichen linearen Chromids. Offenbar hat ein gemeinsamer Vorfahr der Gattung Agrobacterium das Gen telA einmalig erworben und damit die durch das lineare Chromid gekennzeichnete Gattung Agrobacterium begründete. Diese telA-Phylogenie deckt sich mit der des Reparaturgens recA, das als Marker-Gen der Agrobacterium-Phylogenie verwendet wird.[33] Rhizobium rhizogenes wie auch Ensifer meliloti[34] (syn. Sinorhizobium meliloti;[35] Rhizobiaceae) besitzen dagegen ein zirkuläres Chromid und kein telA-Gen.[33]
Artenliste
Gattung: Agrobacterium (Smith & Townsend 1907) Conn 1942
- Synonym: Polymonas Lieske 1928[36]
- Typusart der Gattung Agrobactrium ist A. tumefaciens.[1][A. 2]
Artenliste nach der List of Prokaryotic names with Standing in Nomenclature (LPSN) mit Stand 29. November 2023:[1]
- Agrobacterium arsenijevicii Kuzmanović et al. 2019
- „Agrobacterium aurantiacum“ Yokoyama et al. 1994
- „Agrobacterium bohemicum“ Zahradnik et al. 2018
- Agrobacterium burrii Mafakheri et al. 2022
- Agrobacterium cavarae Flores-Félix et al. 2020
- Agrobacterium cucumeris Warabieda et al. 2023
- „Agrobacterium deltaense“ Yan et al. 2017
- Agrobacterium divergens Naranjo et al. 2023
- Agrobacterium fabacearum Delamuta et al. 2020[38]
- „Agrobacterium fabrum“ Lassalle et al. 2011
- „Agrobacterium kieliense“ Balows et al. 1992
- Agrobacterium larrymoorei Bouzar & Jones 2001
- Agrobacterium leguminum Castellano-Hinojosa et al. 2021
- Agrobacterium nepotum (Puławska et al. 2012) Mousavi et al. 2016
- „Agrobacterium oryzihabitans“ (Zhao et al. 2020) Ma et al. 2023
- Agrobacterium pusense (Panday et al. 2011) Mousavi et al. 2016
- Agrobacterium radiobacter (Beijerinck & van Delden 1902) Conn 1942[39]
- Agrobacterium rosae Kuzmanović et al. 2019[40]
- Agrobacterium rubi (Hildebrand 1940) Starr & Weiss 1943
- Agrobacterium salinitolerans Yan et al. 2017
- Agrobacterium shirazense Mafakheri et al. 2022
- Agrobacterium skierniewicense (Puławska et al. 2012) Mousavi et al. 2016
- Agrobacterium tomkonis Singh et al. 2022
- Agrobacterium tumefaciens (Smith & Townsend 1907) Conn 1942
- Agrobacterium vaccinii Puławska et al. 2022
- „Agrobacterium viscosum“[41] (nicht LPSN) mit Stamm KB-105[33] alias G15[40] oder ATCC:31113[41]
- Agrobacterium sp. CP4[42][43][45]
Im Zug der Neuordnung der ehemaligen Papierkorb-Gattung gab es zahlreiche Verschiebungen, darunter zur Gattung…
- Allorhizobium (Rhizobiaceae): A. vitis ⇒ Allorhizobium vitis
- Peteryoungia (Rhizobiaceae): A. albertimagni ⇒ Peteryoungia albertimagni
- Rhizobium (Rhizobiaceae): A. rhizogenes ⇒ Rhizobium rhizogenes
- Ahrensia (Ahrensiaceae): A. kieliense ⇒ Ahrensia kielensis
- Porphyrobacter (Erythrobacteraceae): A. sanguineum ⇒ Porphyrobacter sanguineus
- Xanthomonas (Lysobacteraceae): A. albilineans ⇒ Xanthomonas albilineans
- Rathayibacter (Microbacteriaceae): A. rathayi ⇒ Rathayibacter rathayi
- Pseudorhodobacter (Paracoccaceae): A. ferrugineum ⇒ Pseudorhodobacter ferrugineus
- Pseudomonas (Pseudomonadaceae): A. agile[46][47] ⇒ „Pseudomonas sp. A82“
- Ruegeria (Roseobacteraceae): A. atlanticum ⇒ Ruegeria atlantica und A. meteori ⇒ Ruegeria atlantica
- Thalassobius (Roseobacteraceae): A. gelatinovorum ⇒ Thalassobius gelatinovorus
- Sphingopyxis (Sphingomonadaceae): A. luteum[48] ⇒ „Sphingopyxis sp. 19D1“
- Labrenzia (Stappiaceae): A. aggregatum ⇒ Labrenzia aggregata
- Stappia (Stappiaceae): A. stellulatum ⇒ Stappia stellulata
Weblinks
- Tina Kyndt, Dora Quispe, Hong Zhai, Robert Jarret, Marc Ghislain, Qingchang Liu, Godelieve Gheysen, Jan F. Kreuze: The genome of cultivated sweet potato contains Agrobacterium T-DNAs with expressed genes: An example of a naturally transgenic food crop. In: Proceedings of the National Academy of Sciences of the United States of America. Band 112, Nr. 18, Mai 2015, S. 5844–5849, bibcode:2015PNAS..112.5844K, doi:10.1073/pnas.1419685112, PMID 25902487, PMC 4426443 (freier Volltext) (englisch). Dazu:
- Bob Yirka: Researchers find the genome of the cultivated sweet potato has bacterial DNA. Auf: phys.org vom 21. April 2015.
- Bacteria confused with rhizobia, including Agrobacterium taxonomy. Auf: NZ Rhizobia. Stand: 9. Januar 2016. Memento im Webarchiv vom 7. Mai 2022.
- Plant transformation with Agrobacterium: Using a soil bacterium as a gene transporter. Auf: GMO Safety vom 8. Mãrz 2010 (englisch). Memento im Webarchiv vom 20. Mai 2011.
- GBIF: Agrobacterium Conn, 1942 (Genus).
Anmerkungen
- ↑ Chromid ist die Bezeichnung für Replikons an der Grenze zwischen (linearen) Chromosomen und (zirkulären) Plasmiden.
- ↑ Abweichend von der autoritativen List of Prokaryotic names with Standing in Nomenclature (LPSN) wurde gelegentlich Agrobacterium tumefaciens als Synonym von Agrobacterium radiobacter angesehen, mit dieser Spezies zur Typusart (Keane et al., 1970).[37] Bei Martha H. Ramírez-Bahena et al. (2014) ist Agrobacterium tumefaciens ein Synonym für Agrobacterium fabrum.[33]
Einzelnachweise
- ↑ a b c d LPSN: Genus Agrobacterium Conn 1942.
- ↑ a b H. J. Conn: Validity of the Genus Alcaligenes. In: ASM Journals: Journal of Bacteriology, Band 44, Nr. 3, 1. September 1942, S. 353–360; doi:10.1128/jb.44.3.353-360.1942 (englisch).
- ↑ Hiroyuki Sawada, Hiroyuki Ieki, Hiroshi Oyaizu, Satoshi Matsumoto: Proposal for rejection of Agrobacterium tumefaciens and revised descriptions for the genus Agrobacterium and for Agrobacterium radiobacter and Agrobacterium rhizogenes. In: International Journal of Systematic Bacteriolog, Band 43, Nr. 4, Oktober 1993, S. 694–702; doi:10.1099/00207713-43-4-694, PMID 8240952 (englisch).
- ↑ Kirk E. Francis, Steven Spiker: Identification of Arabidopsis thaliana transformants without selection reveals a high occurrence of silenced T-DNA integrations. In: The Plant Journal, Band 41, Nr. 3, Februar 2005, S. 464–477; doi:10.1111/j.1365-313X.2004.02312.x, PMID 15659104 (englisch).
- ↑ Nopaline, CAS-Nummer 22350-70-5.
- ↑ Andrea Pitzschke, Heribert Hirt: New insights into an old story: Agrobacterium-induced tumour formation in plants by plant transformation. In: The EMBO Journal, Band 29, Nr. 6, März 2010, S. 1021–1032; doi:10.1038/emboj.2010.8, PMID 20150897, PMC 2845280 (freier Volltext) (englisch).
- ↑ Michelle Hulse, Stuart Johnson, Patricia Ferrieri: Agrobacterium infections in humans: experience at one hospital and review. In: Clinical Infectious Diseases. 16. Jahrgang, Nr. 1, 1. Januar 1993, S. 112–7, doi:10.1093/clinids/16.1.112, PMID 8448285 (englisch).
- ↑ W. M Dunne Jr., J. Tillman, J. C. Murray: Recovery of a strain of Agrobacterium radiobacter with a mucoid phenotype from an immunocompromised child with bacteremia. In: Journal of Clinical Microbiology. 31. Jahrgang, Nr. 9, September 1993, S. 2541–2543, doi:10.1128/JCM.31.9.2541-2543.1993, PMID 8408587, PMC 265809 (freier Volltext) – (englisch).
- ↑ John Raymond Cain: A case of septicaemia caused by Agrobacterium radiobacter. In: The Journal of Infection, Band 16, Nr. 2, März 1988, S 205–206; doi:10.1016/s0163-4453(88)94272-7, PMID 3351321 (englisch).
- ↑ Talya Kunik, Tzvi Tzfira, Yoram Kapulnik, Yedidya Gafni, Colin Dingwall, Vitaly Citovsky: Genetic transformation of HeLa cells by Agrobacterium. In: Proceedings of the National Academy of Sciences of the United States of America, Band 98. Jahrgang, Nr. 4, Februar 2001, S. 1871–1876, bibcode:2001PNAS...98.1871K; doi:10.1073/pnas.041327598, PMID 11172043, PMC 29349 (freier Volltext), JSTOR:3054968 (englisch).
- ↑ a b Jozef (Jeff) Stefaan Schell, Marc Van Montagu: Genetic Engineering for Nitrogen Fixation. Hrsg.: Alexander Hollaender, R. H. Burris, P. R. Day, R. W. F. Hardy, D. R. Helinski, M. R. Lamborg, L. Owens, R. C. Valentine (= Basic Life Sciences. Band 9). 1977, ISBN 978-1-4684-0882-9, The Ti-Plasmid of Agrobacterium tumefaciens, A Natural Vector for the Introduction of NIF Genes in Plants?, S. 159–179, doi:10.1007/978-1-4684-0880-5_12 (englisch). PMID 336023.
- ↑ a b Henk Joos, Benedikt Timmerman, Marc Van Montagu, Jozef (Jeff) Stefaan Schell: Genetic analysis of transfer and stabilization of Agrobacterium DNA in plant cells. In: The EMBO Journal, Band 2. Jahrgang, Nr. 12, 1. Dezember 1983, S. 2151–2160; doi:10.1002/j.1460-2075.1983.tb01716.x, PMID 16453483, PMC 555427 (freier Volltext) (englisch).
- ↑ a b James A. Thomson: Genetic Engineering of Plants. In: Encyclopedia of Life Support Systems (EOLSS): Biotechnology, Band 3, 17. Januar 2017, S. 1–7 (englisch).
- ↑ Kahlin Leuzinger, Matthew Dent, Jonathan Hurtado, Jake Stahnke, Huafang Lai, Xiaohong Zhou, Qiang Chen: Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. In: Journal of Visualized Experiments. Nr. 77, 23. Juli 2013, doi:10.3791/50521, PMID 23913006, PMC 3846102 (freier Volltext) – (englisch).
- ↑ a b Moneim Shamloul, Jason Trusa, Vadim Mett, Vidadi Yusibov: Optimization and utilization of Agrobacterium-mediated transient protein production in Nicotiana. In: Journal of Visualized Experiments (JOVE), Nr. 86, 19. April 2014; doi:10.3791/51204, PMID 24796351, PMC 4174718 (freier Volltext) (englisch).
- ↑ Steven J. Clough, Andrew F. Bent: Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. In: The Plant Journal, Band 16, Nr. 6, Dezember 1998, S. 735–743; doi:10.1046/j.1365-313x.1998.00343.x, PMID 10069079 (englisch).
- ↑ List of Completed Consultations on Bioengineered Foods. U.S. Food and Drug Administration, Center for Food Safety and Applied Nutrition. November 2007 (englisch. Memento im Webarchiv vom 13. Mai 2008.)
- ↑ Caroline B. Michielse, Paul J. J. Hooykaas, Cees A. M. J. J. van den Hondel, Arthur F. J. Ram : Agrobacterium-mediated transformation as a tool for functional genomics in fungi. In: Current Genetics, Band 48, Nr. 1, Juli 2005, S. 1–17; doi:10.1007/s00294-005-0578-0, PMID 15889258 (englisch).
- ↑ Alexander Idnurm, Andy M. Bailey, Timothy C. Cairns, Candace E. Elliott, Gary D. Foster, Giuseppe Ianiri, Junhyun Jeon: Agrobacterium-mediated transformation of fungi. In: Fungal Biology and Biotechnology, Band 4, 26. September 2017, S. 6; doi:10.1186/s40694-017-0035-0, PMID 28955474, PMC 5615635 (freier Volltext) (englisch).
- ↑ Mary-Dell Chilton: Agrobacterium. A Memoir. In: Plant Physiology, Band 125, Nr. 1, Januar 2001, S. 9–14; doi:10.1104/pp.125.1.9, JSTOR:4279598 (englisch).
- ↑ Joao Carlos Setubal, Derek W. Wood, Thomas Burr, Stephen K. Farrand, Barry S. Goldman, Brad Goodner, Leon Otten, Steven Slater: Plant Pathogenic Bacteria: Genomics and Molecular Biology. Hrsg.: Robert W. Jackson. Caister Academic Press, 2009, ISBN 978-1-904455-37-0, The Genomics of Agrobacterium: Insights into its Pathogenicity, Biocontrol, and Evolution, S. 91–112, doi:10.21775/9781910190876 (englisch, google.com). ResearchGate: 228789604.
- ↑ a b c d James J. Davis, Gary J. Olsen: Modal Codon Usage: Assessing the Typical Codon Usage of a Genome. In: Molecular Biology and Evolution, Band 27, Nr. 4, April 2010, S. 800–810; doi:10.1093/molbev/msp281, ResearchGate: [1], ePub 17. Dezember 2009 (englisch). Siehe insbes. Fig. 1: Gene-by-gene plot of the codon usage of Agrobacterium tumefaciens C58.
- ↑ a b Almudena González-Mula, Julien Lang, Catherine Grandclément, Delphine Naquin, Mohammed Ahmar, Laurent Soulère, Yves Queneau, Yves Dessaux, Denis Faure: Lifestyle of the biotroph Agrobacterium tumefaciens in the ecological niche constructed on its host plant. In: New Phytologist, 27. April 2018; doi:10.1111/nph.15164, ResearchGate: 324802306 (englisch). Siehe insbes. Fig. 4.
- ↑ Yoshihito Uchino, Aiko Hirata, Akira Yokota, Junta Sugiyama: Phylogenetic position of the marine subdivision of Agrobacterium species based on 16S rRNA sequence analysis., In: The Journal of General and Applied Microbiology, Band 43, Nr. 4, August 1997, S. 243–247; doi:10.2323/jgam.43.243, PMID 12501326 (englisch).
- ↑ Yoshihito Uchino, Aiko Hirata, Akira Yokota, Junta Sugiyama: Reclassification of marine Agrobacterium species: Proposals of Stappia stellulata gen. nov., comb. nov., Stappia aggregata sp. nov., nom. rev., Ruegeria atlantica gen. nov., comb. nov., Ruegeria gelatinovora comb. nov., Ruegeria algicola comb. nov., and Ahrensia kieliense gen. nov., sp. nov., nom. rev. In: The Journal of General and Applied Microbiology, Band 44, Nr. 3, Juni 1998, S. 201–210; doi:10.2323/jgam.44.201, PMID 12501429 (englisch).
- ↑ John M. Young, L. David Kuykendall, Esperanza Martínez-Romero, Alan Kerr, Hiroyuki Sawada: A revision of Rhizobium Frank 1889, with an emended description of the genus, and the inclusion of all species of Agrobacterium Conn 1942 and Allorhizobium undicola de Lajudie et al. 1998 as new combinations: Rhizobium radiobacter, R. rhizogenes, R. rubi, R. undicola and R. vitis. In: International Journal of Systematic and Evolutionary Microbiology, Band 51, Nr. 1, Januar 2001, S. 89–103, doi:10.1099/00207713-51-1-89, PMID 11211278 (englisch).
- ↑ Stephen K. Farrand, Peter B. van Berkum, Philippe Oger: Agrobacterium is a definable genus of the family Rhizobiaceae. In: International Journal of Systematic and Evolutionary Microbiology, Band 53. Nr. 5, September 2003, S. 1681–1687; doi:10.1099/ijs.0.02445-0, PMID 13130068 (englisch).
- ↑ John M. Young, L. David Kuykendall, Esperanza Martínez-Romero, Alan Kerr, Hiroyuki Sawada: Classification and nomenclature of Agrobacterium and Rhizobium. In: International Journal of Systematic and Evolutionary Microbiology, Band 53, Nr. 5, September 2003, S. 1689–1695; doi:10.1099/ijs.0.02762-0, PMID 13130069, ResearchGate: 5250500 (englisch).
- ↑ José David Flores-Félix, Esther Menéndez, Alvaro Peix, Paula García-Fraile, Encarna Velázquez: History and current taxonomic status of genus Agrobacterium. In: Systematic and Applied Microbiology, Band 43, Nr. 1, Januar 2020, S. 126046; doi:10.1016/j.syapm.2019.126046, PMID 31818496, hdl:10174/28328 (englisch).
- ↑ a b Seyed Abdollah Mousavi, Janina Österman, Niklas Wahlberg, Xavier Nesme, Céline Lavire, Ludovic Vial, Lars Paulin, Philippe de Lajudie, Kristina Lindström: Phylogeny of the Rhizobium-Allorhizobium-Agrobacterium clade supports the delineation of Neorhizobium gen. nov. In: Systematic and Applied Microbiology, Band 37, Nr. 3, Mai 2014, S. 208–215; doi:10.1016/j.syapm.2013.12.007, PMID 24581678 (englisch).
- ↑ a b Seyed Abdollah Mousavi, Anne Willems, Xavier Nesme, Philippe de Lajudie, Kristina Lindström: Revised phylogeny of Rhizobiaceae: Proposal of the delineation of Pararhizobium gen. nov., and 13 new species combinations. In: Systematic and Applied Microbiology, Band 38, Nr. 2, März 2015, S. 84–90; doi:10.1016/j.syapm.2014.12.003, PMID 25595870 (englisch).
- ↑ Ke Shi, Wai Mun Huang, Hideki Aihara: An enzyme-catalyzed multistep DNA refolding mechanism in hairpin telomere formation. In: PLOS Biology. 11. Jahrgang, Nr. 1, 2013, ISSN 1545-7885, S. e1001472, doi:10.1371/journal.pbio.1001472, PMID 23382649, PMC 3558466 (freier Volltext) – (englisch).
- ↑ a b c d Martha H. Ramírez-Bahena, Ludovic Vial, Florent Lassalle, Benjamin Diel, David Chapulliot, Vincent Daubin, Xavier Nesme, Daniel Muller: Single acquisition of protelomerase gave rise to speciation of a large and diverse clade within the Agrobacterium/Rhizobium supercluster characterized by the presence of a linear chromid. In: Molecular Phylogenetics and Evolution, Band 73, April 2014, S. 202–207; doi:10.1016/j.ympev.2014.01.005, PMID 24440816 (englisch). Zu A. viscosum siehe Fig. 1.
- ↑ LPSN: Species Ensifer meliloti (Dangeard 1926) Young 2003.
- ↑ NCBI Taxonomy Browser: Sinorhizobium meliloti (Dangeard 1926) De Lajudie et al. 1994 (species); homotypic synonym: Ensifer meliloti (Dangeard 1926) Young 2003, …
- ↑ Robert Earle Buchanan: Proposal for rejection of the generic name Polymonas Lieske 1928. In: International Bulletin of Bacteriological Nomenclature and Taxonomy. 15. Jahrgang, Nr. 1, 1. Januar 1965, S. 43–44, doi:10.1099/00207713-15-1-43 (englisch).
- ↑ P. J. Keane, A. Kerr, P. B. New: Crown gall of stone fruit II. Identification and nomenclature of Agrobacterium isolates. In: Australian Journal of Biological Sciences, Band 23, Nr. 3, 1970, S. 585–596, ISSN 0004-9417; doi:10.1071/BI9700585 (englisch).
- ↑ Jakeline Renata Marçon Delamuta, Anderson José Scherer, Renan Augusto Ribeiro, Mariangela Hungria: Genetic diversity of Agrobacterium species isolated from nodules of common bean and soybean in Brazil, Mexico, Ecuador and Mozambique, and description of the new species Agrobacterium fabacearum sp. nov. In: International Journal of Systematic and Evolutionary Microbiology, Band 70, Nr. 7, Juni 2020; doi:10.1099/ijsem.0.004278, ResearchGate: 342372467 (englisch).
- ↑ DSMZ: Agrobacterium radiobacter DSM:30147 (alias IAM:12048, ATCC:19358, NCI: 9042 oder EX3.24.2).
- ↑ a b Nemanja Kuzmanović, Joanna Puławska, Kornelia Smalla, Xavier Nesme: Agrobacterium rosae sp. nov., isolated from galls on different agricultural crops. In: Systematic and Applied Microbiology, Band 41, Nr. 3, Mai 2018, S. 191–197; doi:10.1016/j.syapm.2018.01.004 (englisch).
- ↑ a b
NCBI Taxonomy Browser: Agrobacterium viscosum (species). Dazu:
- Taxonomy Browser: Agrobacterium viscosum ATCC 31113 (no rank), Nucleotide: txid300300[Organism:exp] AND ATCC 31113. Stamm ATCC:31113,
- Nucleotide: txid300300[Organism:exp] AND strain CICC10215 Stamm CICC10215,
- Nucleotide: txid300300[Organism:exp] AND strain EsR Stamm EsR,
- Nucleotide: txid300300[Organism:exp] AND strain SDGD01 Stamm SDGD01.
- ↑
Philip A. Rea: How Glyphosate Cropped Up. In: American Scientist, Band 110, Nr. 3, Januar 2022, S. 170; doi:10.1511/2022.110.3.170, ResearchGate: 360101663 (englisch). Dazu:
- Philip A. Rea: Landwirtschaft: Wie Glyphosat die Welt eroberte. Auf: spektrum.de vom 29. September 2023.
- ↑ NCBI Taxonomy Browser: Agrobacterium sp. CP4 (species), equivalent: Agrobacterium sp. (strain CP4).
- ↑ Pfam: PF00275 EPSP synthase (3-phosphoshikimate 1-carboxyvinyltransferase).
- ↑ UniProt: Q9R4E4 · AROA_AGRSC (eine glyphosatresistente Version der EPSP-Synthase[44]). Gen aroA, Organismus Agrobacterium sp. (strain CP4).
- ↑ DSMZ: Agrobacterium agile A82 (alias IAM:12615 oder ATCC:25651).
- ↑ WoRMS: Agrobacterium agile Ahrens, 1968 (Species).
- ↑ NCBI Nucleotide: Agrobacterium luteum strain 19D1 … Zugriffsnr. AY570981.




