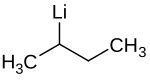
sec-Butyllithium
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | sec-Butyllithium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9Li | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 64,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig | ||||||||||||||||||
| Siedepunkt | 90 °C (0,05 Torr)[2] | ||||||||||||||||||
| Löslichkeit | löslich in Cyclohexan[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
sec-Butyllithium (s-BuLi) ist eine sekundäre metallorganische Verbindung des Elements Lithium (Organolithium-Verbindung). Daneben gibt es noch die isomeren Formen n-Butyllithium und tert-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. s-BuLi ist somit die zweitstärkste Base in dieser Reihe. sec-Butyllithium ist kommerziell üblicherweise als Lösung in Cyclohexan erhältlich. Während der Lagerung kann sich ein feiner Lithiumhydrid-Niederschlag bilden; Dies führt auch zu Konzentrationserniedrigung der Lösungen.
Gewinnung und Darstellung
Die Synthese kann durch Reaktion von 2-Chlorbutan mit elementarem Lithium erfolgen.[5]
Eigenschaften

Physikalische Eigenschaften
sec-Butyllithium ist eine farblose, viskose Flüssigkeit.[6] Für den Reinstoff wurde massenspektrometrisch eine Tetramerstruktur nachgewiesen.[7] In unpolaren Lösungsmitteln wie Benzol, Cyclohexan oder Cyclopentan liegt die Verbindung als Tetramer vor.[6][8][9] Bei Temperaturen von −41 °C konnte in Cyclopentan mittels 6Li-NMR-Spektroskopie ein Hexamer detektiert werden.[9] In Lösungsmitteln mit Donoreigenschaften wie Tetrahydrofuran existiert ein Gleichgewicht zwischen dimeren und monomeren Strukturen.[10]
Chemische Eigenschaften
s-BuLi kann für den Lithium-Halogenaustausch an halogenierten Aromaten oder zum Deprotonieren, beispielsweise von Aminen oder Alkoholen, verwendet werden. Mit Kupfer(I)-iodid werden Lithiumdi-sec-butylcuprate gebildet. Im Vergleich zu n-BuLi reagiert s-BuLi bei Raumtemperatur schneller mit Diethylether und THF. Die Verbindung zerfällt bei Raumtemperatur langsam bzw. bei erhöhter Temperatur schneller in Lithiumhydrid und einem Butengemisch aus 1-Buten, cis-2-Buten und trans-2-Buten.[11][12]
Reines s-Butyllithium ist pyrophor[1] und verbrennt an der Luft mit einer typisch roten Flamme.
Verwendung
Die Kohlenstoff-Lithium-Bindung ist stark polarisiert, was dazu führt, dass der Kohlenstoff sehr nucleophil und basisch ist. s-Buli ist basischer als n-Buli und zusätzlich sterisch mehr gehindert. Diese beiden Eigenschaften kann man sich in diversen Synthesen zu Nutze machen. Es wird z. B. eingesetzt, wenn nur eine schwache C-H-Acidität vorliegt und n-BuLi keine zufriedenstellende Resultate liefert. Zudem wird s-Butyllithium als Katalysator für technische Polymerisationen von Isopren, Butadien und Styrol verwendet.[1]
Sicherheitshinweise
s-BuLi ist an der Luft selbstentzündlich (pyrophor) und reagiert zudem heftig mit Wasser. Auch Lösungen in organischen Lösungsmitteln sind, außer bei niedriger Konzentration, pyrophor und können durch Reaktion mit Wasser in Brand geraten.[13]
Einzelnachweise
- ↑ a b c Eintrag zu Butyllithium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Dezember 2013.
- ↑ T. V. Ovaska: s-Butyllithium. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, New York 2001. doi:10.1002/047084289X.rb397.
- ↑ a b c Datenblatt sec-Butyllithium solution, 1.4 M in cyclohexane bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ Teile der Gefahrstoffkennzeichnung beziehen sich auf die Gefahren, die durch das Lösungsmittel verursacht werden.
- ↑ H. Gilman, F. W. Moore, O. Baine: Secondary and Tertiary Alkyllithium Compounds and Some Interconversion Reactions with Them. In: J. Am. Chem. Soc. 63, 1941, S. 2479–2482, doi:10.1021/ja01854a046.
- ↑ a b U. Wietelmann, R. J. Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a15_393
- ↑ D. Plavsic, D. Srzic, L. Klasinc: Mass spectrometric investigations of alkyllithium compounds in the gas phase. In: J. Phys. Chem. 90, 1986, S. 2075–2080, doi:10.1021/j100401a020.
- ↑ S. Bywater, D. J. Worsfold: Alkyllithium anionic polymerization initiators in hydrocarbon solvents. In: J. Organomet. Chem. 10, 1967, S. 1–6.
- ↑ a b G. Fraenkel, M. Henrichs, M. Hewitt, B. M. Su: Structure and dynamic behavior of a chiral alkyllithium compound: 13C and 6Li NMR of sec-butyllithium. In: J. Am. Chem. Soc. 106, 1984, S. 255–256.
- ↑ W. Bauer, W. R. Winchester, P. von Schleyer: Monomeric organolithium compounds in tetrahydrofuran: tert-butyllithium, sec-butyllithium, supermesityllithium, mesityllithium, and phenyllithium. Carbon-lithium coupling constants and the nature of carbon-lithium bonding. In: Organometallics. 6, 1987, S. 2371–2379, doi:10.1021/om00154a017.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Thermal Decomposition of sec.-Butyllithium. In: J. Org. Chem. 30, 1965, S. 1258–1259, doi:10.1021/jo01015a514.
- ↑ W. H. Glaze, J. Lin, E. G. Felton: The Pyrolysis of Unsolvated Alkyllithium Compounds. In: J. Org. Chem. 31, 1966, S. 2643–2645, doi:10.1021/jo01346a044.
- ↑ Thomas J. Malinski, David E. Bergbreiter: Safer solvents for reactive organometallic reagents. In: Tetrahedron Letters. Band 59, Nr. 44, Oktober 2018, S. 3926–3929, doi:10.1016/j.tetlet.2018.09.041 (elsevier.com [abgerufen am 4. August 2024]).
Literatur
- Heinz G. O. Becker u. a.: Organikum. 21. Auflage. Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-53501-7.











