Reichardt-Farbstoff
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
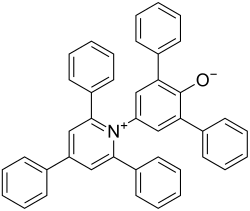
| ||||||||||
| Allgemeines | ||||||||||
| Name | Reichardt-Farbstoff | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C41H29NO | |||||||||
| Kurzbeschreibung |
kristallin Farbe: dunkelviolett[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 551,68 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
Keine Daten verfügbar[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten |
Kein gefährlicher Stoff oder gefährliches Gemisch gemäß der Verordnung (EG) Nr. 1272/2008.[1] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Reichardt-Farbstoff (Betain 30) (2,6-Diphenyl-4-(2,4,6-triphenyl-1-pyridinio)phenolat), ist ein organischer Farbstoff aus der Gruppe der Azomerocyaninbetaine. Er ist bemerkenswert durch seine solvatochrome Eigenschaft. Das bedeutet, dass er seine Farbe mit dem Lösemittel ändern kann, in dem er gelöst ist. Er hat einen der größten bekannten solvatochromen Effekte[3] mit Farben, die das komplette sichtbare Spektrum abdecken.[4] Diese große Farbverschiebung wurde genutzt, um eine Skala, die -Skala zu erstellen. Sie wurde durch spektroskopische Daten abgeleitet, dabei wird sie als Übergangsenergie der längstwelligen Vis/NIR-Absorptionsbande von Reichardt-Farbstoff bei Normalbedingungen in kcal·mol−1 definiert. Definiert man die Polarität von Tetramethylsilan auf 0 und die von Wasser auf 1, so erhält man die normalisierten -Werte, die -Werte.[5]

Geschichte
Der Reichardt-Farbstoff ist nach Christian Reichardt benannt, der ihn während seiner Doktorarbeit unter Karl Dimroth synthetisierte und seine Eigenschaften entdeckte. In einigen Quellen wird der Farbstoff daher auch als Dimroth-Reichardt-Farbstoff bezeichnet. In einigen Fällen werden auch Derivate so genannt, speziell solche, die tert-Butylgruppen in para-Stellung besitzen.[6]
Vorkommen
Der Reichardt-Farbstoff hat keine natürlichen Vorkommen und kann nur synthetisch hergestellt werden.
Gewinnung und Darstellung
Eine neuere Synthese ist folgende:[7]
2,6-Diphenylphenol wird mit verdünnter HNO3 in 4-Stellung nitriert und anschließend mit Natriumdithionit zum Amin reduziert. Dieses Amin wird mit 2,4,6-Triphenylpyryliumhydrogensulfat in Gegenwart von Natriumacetat zum Hydrogensulfat des Farbstoffs umgesetzt, aus dem mit NaOH die Betainform des Reichardt-Farbstoff hergestellt wird.
Eigenschaften
Der Reichardt-Farbstoff ist ein dunkelvioletter kristalliner Feststoff. Neben der Solvatochromie hat er die Eigenschaften der Thermochromie (Eindrucksvoll ist die Farbänderung in Phenol von Orangegelb bei Raumtemperatur über Orange, Rotorange, Rot, Violett bis Blau beim Siedepunkt),[8] Piezochromie und Halochromie.[9]
Verwendung
Bedingt durch seine Solvatochromie kann man mit dem Reichardt-Farbstoff die Polarität von Lösemitteln abschätzen, indem man dessen Absorptionsspektrum in den jeweiligen Lösemitteln vermisst, so beträgt die Wellenlänge der maximalen Absorptionsbanden in Wasser (453 nm) und in Diphenylether (810 nm).[10] Mithilfe folgender Formel kann dann anhand der Wellenlänge (bzw. Wellenzahl) der -Wert für das jeweilige Lösungsmittel berechnet werden. Dieser entspricht der molaren elektronischen Anregungsenergie:[11]
mit
- : Wellenzahl bei Absorptionsmaximum, : Wellenlänge bei Absorptionsmaximum
Der -Wert ist der auf die Polaritätsextrema Tetramethylsilan (=0) und Wasser (=1) normalisierte ET(30)-Wert.
Alternativ kann Brookers Merocyanin verwendet werden.
Literatur
- C. Reichardt: Solvents and Solvent Effects in Organic Chemistry. 3. Auflage. Wiley-VCH Verlag, Weinheim 2003, doi:10.1002/3527601791 (archive.org – Erstausgabe: 1979).
- 4. Auflage; mit T. Welton, 2010, doi:10.1002/9783527632220.
Einzelnachweise
- ↑ a b c d Datenblatt Reichardt’s dye bei Sigma-Aldrich, abgerufen am 10. April 2016 (PDF).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Bruce R. Osterby, Ronald D. McKelvey: Convergent Synthesis of Betaine-30, a Solvatochromic Dye: An Advanced Undergraduate Project and Demonstration. In: J. Chem. Educ. 73. Jahrgang, Nr. 3, 1996, S. 260–261, doi:10.1021/ed073p260.
- ↑ Vanderlei Gageiro Machado, Clodoaldo Machado: An Easy and Versatile Experiment to Demonstrate Solvent Polarity Using Solvatochromic Dyes. In: J. Chem. Educ. 78. Jahrgang, Nr. 5, 2001, S. 649–651, doi:10.1021/ed078p649.
- ↑ Alan R. Katritzky, Dan C. Fara, Hongfang Yang, Kaido Tämm et al.: Quantitative Measures of Solvent Polarity In: Spectroscopic Measurements. S. 183.
- ↑ Christian Reichardt: Solvatochromic Dyes as Solvent Polarity Indicators. In: Chem. Rev. 94. Jahrgang, Nr. 8, 1994, S. 2319–2358, doi:10.1021/cr00032a005.
- ↑ Manfred A. Kessler, Otto S. Wolfbeis: An Improved Synthesis of the Solvatochromic Dye ET-30. In: Synthesis. Band 1988, Nr. 8, Januar 1988, S. 635–636, doi:10.1055/s-1988-27662.
- ↑ Karl Dimroth, Christian Reichardt, Armin Schweig: Über die Thermochromie von Pyridinium-N-phenol-betainen. In: Justus Liebigs Annalen der Chemie. Band 669, Nr. 1, 8. November 1963, S. 95–105, doi:10.1002/jlac.19636690111.
- ↑ Christian Reichardt: Polarity of ionic liquids determined empirically by means of solvatochromic pyridinium N-phenolate betaine dyes. In: Green Chemistry. Band 7, Nr. 5, 2005, S. 339–351, doi:10.1039/B500106B.
- ↑ Guido Heckenkemper: Synthese und UV/Vis-spektroskopische Eigenschaften neuer solvatochromer 2-,3- und 4-pyridylsubstituierter Pyridinium-N-phenolat-Betainfarbstoffe und ihre Anwendung zur Untersuchung wäßriger Ionophorlösungen Dissertation, Chemie, 1999, Kapitel 1, (archiv.ub.uni-marburg.de).
- ↑ Karl Dimroth, Christian Reichardt, Theodor Siepmann, Ferdinand Bohlmann: Über Pyridinium-N-phenol-betaine und ihre Verwendung zur Charakterisierung der Polarität von Lösungsmitteln. In: Justus Liebigs Annalen der Chemie. Band 661, Nr. 1, 18. Februar 1963, S. 1–37, doi:10.1002/jlac.19636610102.













