Bindungswinkel
Als Bindungswinkel bezeichnet man in der Chemie und Molekülphysik den Winkel zwischen kovalenten Bindungen eines Atoms zu zwei Nachbaratomen.[1] Er hängt im Wesentlichen von den an den Bindungen beteiligten Atomorbitalen ab, kann aber zu einem gewissen Grad durch sterische Wechselwirkungen beeinflusst werden. Die Bindungswinkel und damit die geometrischen Strukturen eines Moleküls kann man mit Hilfe des VSEPR-Modells erklären.[2] Bei Verbindungen, die Elemente aus den Nebengruppen enthalten, versagt das VSEPR-Modell jedoch meist.[3]
Für die Bindungswinkel zwischen Atomen in Molekülen, dessen Orbitale hybridisiert sind, ergeben sich spezifische theoretische Winkel (Pseudostruktur):
- sp3-Hybridorbitale in Molekülen richten sich im Tetraederwinkel von 109,5° zueinander aus.[1]
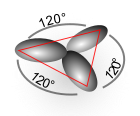
- sp2-Hybridorbitale stehen planar-trigonal zueinander und bilden einen Winkel von 120°.[1]
- sp-Hybridorbitale richten sich linear aus, woraus ein Bindungswinkel von 180° entsteht.[1]
-
Pseudostruktur bei
sp3-Hybridorbitalen -
Pseudostruktur bei
sp2-Hybridorbitalen -
Pseudostruktur bei
sp-Hybridorbitalen

Die tatsächlichen Bindungswinkel (Realstruktur) in vielen Molekülen, die eine tetraedrische, trigonale oder lineare Struktur aufweisen, weichen jedoch unterschiedlich stark von den oben genannten Winkeln (Pseudostruktur) ab. So beträgt der tatsächliche Bindungswinkel im Wassermolekül nicht 109,5°, sondern 104,45°, da die nichtbindenden Elektronenpaare die bindenden geringfügig abstoßen. So liegt auch im Ammoniakmolekül ein abweichender Winkel von 107° vor. Die Abweichung ist geringer als im Wassermolekül, da Ammoniak nur ein freies Elektronenpaar besitzt.[4][5]
Eine Methode zur Messung von Bindungswinkeln ist die NMR-Spektroskopie. Die in der NMR auftretende Abhängigkeit von Kopplungskonstante und Bindungswinkel zwischen zwei C-H-Bindungen wird nach ihrem Entdecker Martin Karplus als Karplus-Beziehung bezeichnet. Molekülschwingungen beinhalten meist eine periodische Deformation von Bindungswinkeln.[6]
Siehe auch
Einzelnachweise
- ↑ a b c d Theodore L. Brown, Bruce Edward Bursten, Harold Eugene LeMay: Chemie Studieren kompakt. Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-122-7, S. 343 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard E. Dickerson: Prinzipien der Chemie. Walter de Gruyter, 1988, ISBN 978-3-11-009969-0, S. 488 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter GmbH & Co KG, 2015, ISBN 978-3-11-035528-4, S. 106 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Thomas Hill: Prüfungswissen Physikum. Georg Thieme Verlag, 2009, ISBN 3-13-152131-7, S. 399 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Arthur Beiser: Atome, Moleküle, Festkörper. Springer-Verlag, 2013, ISBN 978-3-322-91105-6, S. 134 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Paula Yurkanis Bruice: Organische Chemie Studieren kompakt. Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-102-9, S. 491, 551 (eingeschränkte Vorschau in der Google-Buchsuche).