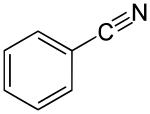
Benzonitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzonitril | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H5N | ||||||||||||||||||
| Kurzbeschreibung |
farblose, angenehm nach Bittermandel riechende Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 103,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[3] | ||||||||||||||||||
| Dichte |
1,01 g·cm−3 (20 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
191 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer in Wasser (10 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Brechungsindex |
1,5289 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Benzonitril ist eine farblose, brennbare Flüssigkeit, die bittermandelartig riecht.
Das Molekül besteht aus einem sechsgliedrigen, aromatischen Ring, an den eine Nitrilgruppe gebunden ist. Es wird als chemischer Ausgangsstoff für Synthesen oder auch sehr selten als Lösungsmittel eingesetzt.
Geschichte
Benzonitril wurde erstmals 1832 von Justus von Liebig und Friedrich Wöhler durch Schmelzen von Benzamid mit Bariumhydroxid hergestellt. Diese gaben der Substanz allerdings keinen Namen, sondern bezeichneten es nur als "ölartigen Körper mit süßlich aromatischem Geruch".[6] 1844 stellte es Hermann Fehling durch die thermische Zersetzung von Ammoniumbenzoat her und nannte auch den Namen, weswegen man später davon ausging, er wäre der erste Chemiker gewesen, der es herstellte.[7][8]
Darstellung und Gewinnung
Die Verbindung kann durch die Umsetzung des Natriumsalzes der Benzolsulfonsäure mit Natriumcyanid gewonnen werden. Die technische Herstellung erfolgt durch eine katalytische Ammonoxidation von Toluol.[2]
Eigenschaften
Physikalische Eigenschaften
Benzonitril ist eine farblose Flüssigkeit, die unter Normaldruck bei 191 °C siedet.[9] Die Verdampfungswärme beträgt 49,1 kJ·mol−1.[10]
Sicherheitstechnische Kenngrößen
Benzonitril bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 67 °C.[3] Der Explosionsbereich liegt zwischen 0,9 Vol.‑% (38 g/m3) als untere Explosionsgrenze (UEG) und 12 Vol.‑% (510 g/m3) als obere Explosionsgrenze (OEG).[3] Der untere Explosionspunkt beträgt 65 °C.[3]
Verwendung
Durch katalytische Hydrierung (Reduktion) von Benzonitril entsteht das Benzylamin. Versetzt man Benzonitril allerdings mit starken wässrigen Säuren oder Basen, so hydrolysiert es über Benzamid zu Benzoesäure und Ammoniak.[11]
Sicherheitshinweise
Beim Verbrennen können blausäurehaltige Gase entstehen.[3]
Einzelnachweise
- ↑ Eintrag zu BENZONITRILE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- ↑ a b Eintrag zu Benzonitril. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. September 2023.
- ↑ a b c d e f g h i j k l m n Eintrag zu Benzonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-38.
- ↑ Eintrag zu Benzonitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ F. Wöhler, J. Liebig: Untersuchungen über das Radikal der Benzoesäure. In: Annalen der Pharmacie. Band 3, Nr. 3, Januar 1832, S. 249–282, doi:10.1002/jlac.18320030302.
- ↑ H. Fehling: Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme in Ann. Chem. Pharm. 49 (1844) 91–97
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 28 pdf.
- ↑ Reddy, S.S.; Reddy, K.D.; Rao, M.V.P.: Excess Volumes of Homologous Series of ALiphatic Hydrocarbons with Chlorobenzene, Nitrobenzene, and Benzonitrile in J. Chem. Eng. Data 27 (1982) 173–176.
- ↑ R. M. Stephenson, S. Malanowski: Handbook of the Thermodynamics of Organic Compounds. Springer 1987, ISBN 94-010-7923-4, doi:10.1007/978-94-009-3173-2.
- ↑ Heinz G. O. Becker, Werner Berger, und Günter Domschke: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3-527-31148-4.






