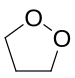
1,2-Dioxolan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,2-Dioxolan | ||||||||||||
| Summenformel | C3H6O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 74.078 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
1,2-Dioxolan ist eine chemische Verbindung aus der Gruppe der Heterocyclen. Es ist eines der beiden möglichen Isomere; das andere ist 1,3-Dioxolan. Die beiden Isomere haben einen entscheidenden Unterschied in ihrer Reaktivität, da bei 1,2-Dioxolan ein Endoperoxid vorliegt, während es sich bei 1,3-Dioxolan um ein Acetal von Formaldehyd handelt.
Vorkommen
1,2-Dioxolan ist in einigen Naturstoffen eine Untereinheit. Prominente Beispiele sind Prostaglandin G2 und H2.
Gewinnung und Darstellung
1,2-Dioxolan kann aus 1,3-Propandiol synthetisiert werden, indem beide Hydroxygruppen triflyliert werden und das triflylierte Zwischenprodukt mit Bis(tributylzinn)peroxid[2] umgesetzt wird. Die dabei ablaufende Reaktion folgt einem doppelten Additions-Eliminierungs-Mechanismus. Pro Produkt-Molekül entstehen zwei Moleküle Tributylzinntriflat[3] als Nebenprodukt. Das Produkt kann so theoretisch quantitativ erhalten werden; die Isolation des Produktes ist bei dieser Synthese jedoch schwer.[4][5] Nach derselben Methode lassen sich auch größere Ringe mit Endoperoxiden synthetisieren, wie zum Beispiel 1,2-Dioxan[6], 1,2-Dioxepan[7] und 1,2-Dioxocan[8], wobei die Ausbeute stets geringer ist als bei 1,2-Dioxolan.

Eine 1986 vorgestellte Synthese beruht auf der radikalischen Ringöffnung von Cyclopropan mittels N-Bromsuccinimid und Wasserstoffperoxid, was zu einem β-Bromhydroperoxid führt. Dieses wird wiederum durch die Bromid-Abstraktion mit Silber(I)-oxid zum Dioxolanring geschlossen. Es entsteht jeweils stöchiometrisch Silberbromid und Silberhydroxid als Nebenprodukte.[9]

Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bis(tri-n-butylzinn)peroxid: CAS-Nummer: 63256-88-2, PubChem: 16690362, ChemSpider: 35780833, Wikidata: Q116389788.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Tributylzinntriflat: CAS-Nummer: 68725-14-4, EG-Nummer: 625-305-1, ECHA-InfoCard: 100.153.814, PubChem: 16685117, ChemSpider: 21169363, Wikidata: Q82305502.
- ↑ M. F. Salomon, R. G. Salomon: Peroxide transfer from tri-n-butyltin peroxides. A mild new synthesis of dialkyl peroxides. In: Journal of the American Chemical Society. Band 99, Nr. 10, 1977, S. 3500–3501, doi:10.1021/ja00452a051.
- ↑ M. F. Salomon, R. G. Salomon: The peroxide transfer reaction. In: Journal of the American Chemical Society. Band 101, Nr. 15, 1979, S. 4290–4299, doi:10.1021/ja00509a042.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Dioxan: CAS-Nummer: 5703-46-8, PubChem: 138570, ChemSpider: 122188, Wikidata: Q4545655.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Dioxepan: CAS-Nummer: 505-63-5, PubChem: 136336, ChemSpider: 120110, Wikidata: Q83071282.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,2-Dioxocan: CAS-Nummer: 6572-89-0, PubChem: 138771, ChemSpider: 122377, Wikidata: Q83092056.
- ↑ A. J. Bloodworth, K. H. Chan, C. J. Cooksey: Oxymetalation. 20. Conversion of cyclopropanes into 1, 2-dioxolanes via tert-butyl peroxymercuration, bromodemercuration, and silver salt induced cyclization. In: The Journal of Organic Chemistry. Band 51, Nr. 11, 1986, S. 2110–2115, doi:10.1021/jo00361a034.




