„Metallorganische Gerüstverbindung“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
HDMW Methode hinzugefügt, Abb. hinzugefügt, ... Markierung: 2017-Quelltext-Bearbeitung |
Aka (Diskussion | Beiträge) K Datumsformat im Einzelnachweis korrigiert, Links normiert, Kleinkram |
||
| Zeile 15: | Zeile 15: | ||
==== Arbeitsablauf bei Solvothermalsynthesen im Teflonreaktor ==== |
==== Arbeitsablauf bei Solvothermalsynthesen im Teflonreaktor ==== |
||
[[Datei:Solvothermal-HD-Reaktor.png|mini|Ein Solvothermalreaktor für die Durchführung von Parallelsynthesen (3D-Modell).]] |
[[Datei:Solvothermal-HD-Reaktor.png|mini|Ein Solvothermalreaktor für die Durchführung von Parallelsynthesen (3D-Modell).]] |
||
[[Datei: |
[[Datei:MOF Synthese HDMW.png|mini|Arbeitsablauf an dem Hochdurchsatz-Mikrowellenofen; (a) Einzelteile des Glasreaktors, (b) verschraubter Glasreaktor im Siliciumcarbidblock, (c) geöffneter Mikrowellenofen mit Sicht auf den Drehteller mit den Trägern des Siliciumcarbidblocks, (d) geöffneter Mikrowellenofen mit abgedecktem Drehteller (Explosionsschutz), (e) geschlossener Mikrowellenofen.]] |
||
Für Reaktionen im Teflonreaktor kann ein HD-Arbeitsablauf z. B. so aussehen, dass 24 Einzelreaktionen parallel durchgeführt werden. Dabei enthält ein Reaktorblock 24 Teflonreaktoren mit einem Volumen von jeweils 2 mL oder weniger. Normalerweise werden in der Solvothermalsynthese Teflonreaktoren mit einem Volumen von mindestens 20 mL verwendet. Die Miniatur-Teflonreaktoren werden dann z. B. mit Lösungen und Feststoffen befüllt und anschließend in einem HD-Reaktorblock mit zwei Teflonfolien versiegelt. Der Autoklav wird durch das Anziehen von Schrauben in einer Hydraulikpresse verschlossen – so präpariert kann der Reaktor im Ofen platziert werden. Die Mehrweg-Teflonfolie dient dazu der mechanische Beanspruchung zu widerstehen, während die Einweg-Teflonfolie die Teflonreaktoren abdichtet. Die alleinige Verwendung von Einweg-Teflonfolie führt dazu, dass sie unter der mechanischen Beanspruchung reist und die Teflonreaktoren trockenlaufen, die gewünschte Reaktion kann so nicht ablaufen. Nach der Reaktion können die Produkte in einer speziellen Filtrierapparatur parallel isoliert und gewaschen werden. Auf dem Filterpapier liegen die Produkte dann getrennt in einer sogenannten Probenbibliothek vor und können im Anschluss durch Röntgenpulverbeugung charakterisiert werden. Die gewonnenen Informationen werden dann zur Planung weiterer Synthesen verwendet. |
Für Reaktionen im Teflonreaktor kann ein HD-Arbeitsablauf z. B. so aussehen, dass 24 Einzelreaktionen parallel durchgeführt werden. Dabei enthält ein Reaktorblock 24 Teflonreaktoren mit einem Volumen von jeweils 2 mL oder weniger. Normalerweise werden in der Solvothermalsynthese Teflonreaktoren mit einem Volumen von mindestens 20 mL verwendet. Die Miniatur-Teflonreaktoren werden dann z. B. mit Lösungen und Feststoffen befüllt und anschließend in einem HD-Reaktorblock mit zwei Teflonfolien versiegelt. Der Autoklav wird durch das Anziehen von Schrauben in einer Hydraulikpresse verschlossen – so präpariert kann der Reaktor im Ofen platziert werden. Die Mehrweg-Teflonfolie dient dazu der mechanische Beanspruchung zu widerstehen, während die Einweg-Teflonfolie die Teflonreaktoren abdichtet. Die alleinige Verwendung von Einweg-Teflonfolie führt dazu, dass sie unter der mechanischen Beanspruchung reist und die Teflonreaktoren trockenlaufen, die gewünschte Reaktion kann so nicht ablaufen. Nach der Reaktion können die Produkte in einer speziellen Filtrierapparatur parallel isoliert und gewaschen werden. Auf dem Filterpapier liegen die Produkte dann getrennt in einer sogenannten Probenbibliothek vor und können im Anschluss durch Röntgenpulverbeugung charakterisiert werden. Die gewonnenen Informationen werden dann zur Planung weiterer Synthesen verwendet. |
||
==== Arbeitsablauf bei Solvothermalsynthesen im Mikrowellenofen ==== |
==== Arbeitsablauf bei Solvothermalsynthesen im Mikrowellenofen ==== |
||
Mit der Reaktionslösung und einem Rührfisch befüllt wird ein kleiner Glasreaktor (z. B. mit 2 mL Volumen) mit einer Teflonkappe und einem Schraubdeckel verschlossen. Die Gefäße werden in einen Reaktionsblock aus Siliciumcarbid eingesetzt, welcher unter anderem eine gleichmäßige Wärmeverteilung ermöglicht. Abgedeckt mit einem Spritz- bzw. Explosionsschutz wird der Reaktionsblock im Mikrowellenofen positioniert, dann kann ein Temperatur-Zeit-Programm eingestellt werden. Die Isolierung der Produkte erfolgt wie beim Arbeitsablauf mit einem Teflonreaktor. |
Mit der Reaktionslösung und einem Rührfisch befüllt wird ein kleiner Glasreaktor (z. B. mit 2 mL Volumen) mit einer Teflonkappe und einem Schraubdeckel verschlossen. Die Gefäße werden in einen Reaktionsblock aus Siliciumcarbid eingesetzt, welcher unter anderem eine gleichmäßige Wärmeverteilung ermöglicht. Abgedeckt mit einem Spritz- bzw. Explosionsschutz wird der Reaktionsblock im Mikrowellenofen positioniert, dann kann ein Temperatur-Zeit-Programm eingestellt werden. Die Isolierung der Produkte erfolgt wie beim Arbeitsablauf mit einem Teflonreaktor. |
||
=== Postsynthetische Modifikation === |
=== Postsynthetische Modifikation === |
||
| Zeile 37: | Zeile 37: | ||
==== Synthese ==== |
==== Synthese ==== |
||
Die Synthese wird üblicherweise unter hydrothermalen oder solvothermalen Bedingungen mit Reaktionszeiten im Bereich von wenigen Stunden bis zu mehreren Tagen durchgeführt. Wie bei MOFs üblich umfasst die Entdeckung neuer Verbindungen das Screening diverser Reaktionsparameter wie pH-Wert, Temperatur, Konzentration, der Menge und Art an Mineralisatoren oder Kristallisationsmodulatoren (siehe dazu oben "Darstellung"). |
Die Synthese wird üblicherweise unter hydrothermalen oder solvothermalen Bedingungen mit Reaktionszeiten im Bereich von wenigen Stunden bis zu mehreren Tagen durchgeführt. Wie bei MOFs üblich umfasst die Entdeckung neuer Verbindungen das Screening diverser Reaktionsparameter wie pH-Wert, Temperatur, Konzentration, der Menge und Art an Mineralisatoren oder Kristallisationsmodulatoren (siehe dazu oben "Darstellung"). |
||
==== Linkermoleküle ==== |
==== Linkermoleküle ==== |
||
| Zeile 44: | Zeile 44: | ||
'''Dicarboxylat-Linker''' |
'''Dicarboxylat-Linker''' |
||
Als Dicarboxylat-Linker können unter anderem folgende Moleküle genutzt werden:<ref name=":5" /> |
Als Dicarboxylat-Linker können unter anderem folgende Moleküle genutzt werden:<ref name=":5" /> |
||
* [[Terephthalsäure]] (z. B. in [[MOF-5]] oder [[MIL-53]]) |
* [[Terephthalsäure]] (z. B. in [[MOF-5]] oder [[MIL-53]]) |
||
| Zeile 50: | Zeile 50: | ||
=== Metallphosphonate === |
=== Metallphosphonate === |
||
Metallphosphonate (MPs) sind metallorganische Gerüstverbindungen, die durch Koordination von Phosphonatliganden an Metallionen aufgebaut werden. Metallphosphonate weisen häufig eine außergewöhnliche chemische und thermische Stabilität, sowie eine geringe Löslichkeit in vielen Lösungsmitteln auf.<ref name=":9">{{Literatur |Autor=Stephen J.I. Shearan, Norbert Stock, Franziska Emmerling, Jan Demel, Paul A. Wright, Konstantinos D. Demadis, Maria Vassaki, Ferdinando Costantino, Riccardo Vivani, Sébastien Sallard, Inés Ruiz Salcedo, Aurelio Cabeza, Marco Taddei |Titel=New Directions in Metal Phosphonate and Phosphinate Chemistry |Hrsg= |Sammelwerk=Crystals |Band=9 |Nummer=5 |Auflage= |Verlag= |Ort= |Datum= |
Metallphosphonate (MPs) sind metallorganische Gerüstverbindungen, die durch Koordination von Phosphonatliganden an Metallionen aufgebaut werden. Metallphosphonate weisen häufig eine außergewöhnliche chemische und thermische Stabilität, sowie eine geringe Löslichkeit in vielen Lösungsmitteln auf.<ref name=":9">{{Literatur |Autor=Stephen J.I. Shearan, Norbert Stock, Franziska Emmerling, Jan Demel, Paul A. Wright, Konstantinos D. Demadis, Maria Vassaki, Ferdinando Costantino, Riccardo Vivani, Sébastien Sallard, Inés Ruiz Salcedo, Aurelio Cabeza, Marco Taddei |Titel=New Directions in Metal Phosphonate and Phosphinate Chemistry |Hrsg= |Sammelwerk=Crystals |Band=9 |Nummer=5 |Auflage= |Verlag= |Ort= |Datum=2019-05-24|ISBN= |DOI=10.3390/cryst9050270 |Seiten=270}}</ref> |
||
Potentiell Anwendung könnten MPs in Ionentauschern, in der Interkalationschemie, Protonenleitung und in der Katalyse finden.<ref name=":9" /> |
Potentiell Anwendung könnten MPs in Ionentauschern, in der Interkalationschemie, Protonenleitung und in der Katalyse finden.<ref name=":9" /> |
||
==== Synthese ==== |
==== Synthese ==== |
||
| Zeile 60: | Zeile 60: | ||
Als Phosphonat-Linker können unter anderem die Anionen folgender Moleküle eingesetzt werden:<ref name=":9" /> |
Als Phosphonat-Linker können unter anderem die Anionen folgender Moleküle eingesetzt werden:<ref name=":9" /> |
||
* [[N, N-Piperazindiphosphonsäure|''N, N''-Piperazindiphosphonsäure]] (z. B. bei MIL-91(Al) und MIL-91(Ti)) |
* [[N, N-Piperazindiphosphonsäure|''N, N''-Piperazindiphosphonsäure]] (z. B. bei MIL-91(Al) und MIL-91(Ti)) |
||
* [[Phenylphosphonsäure]] (<chem>C6H7O3P</chem>) (z. B. bei <chem>Cd(O3PPh)*H2O</chem>) |
* [[Phenylphosphonsäure]] (<chem>C6H7O3P</chem>) (z. B. bei <chem>Cd(O3PPh)*H2O</chem>) |
||
==== Geschichte ==== |
==== Geschichte ==== |
||
| Zeile 136: | Zeile 136: | ||
* [[Schwingungsspektroskopie]] |
* [[Schwingungsspektroskopie]] |
||
*[[Röntgenbeugung|Röntgenpulverbeugung]] |
* [[Röntgenbeugung|Röntgenpulverbeugung]] |
||
* CHNS-[[Elementaranalyse]] |
* CHNS-[[Elementaranalyse]] |
||
* [[Thermogravimetrie]] |
* [[Thermogravimetrie]] |
||
Version vom 29. August 2019, 12:20 Uhr

Metallorganische Gerüste bzw. Metallorganische Gerüstverbindungen (englisch: metal-organic frameworks, MOF) sind mikroporöse Materialien, die aus anorganischen Baueinheiten, den sogenannten SBUs (engl.: Secondary Building Units) und organischen Molekülen (engl.: Linker) als Verbindungselementen zwischen den anorganischen Baueinheiten aufgebaut sind.[1] Metall-organische Gerüste sind oft, aber nicht notwendigerweise, kristallin.[2] MOFs sind sogenannte Koordinationspolymere (genauer: Koordinationsnetzwerke[2]) mit einem offenen Gerüst, welches mögliche Poren enthält.[2][3][4] MOFs basieren üblicherweise auf Werner-Komplexen. Die Poren der dreidimensionalen Strukturen sind nach der Synthese mit Gastmolekülen (z. B. Lösungsmittel oder nicht umgesetzte Linker) gefüllt. Durch die Entfernung der Gastmoleküle (z. B. durch Ausheizen, im Vakuum oder durch Kombination von beidem) können die Poren unter Umständen zugänglich gemacht werden. Potentielle Anwendungsgebiete finden sich in Gasspeicherung (z. B. Wasserstoff, Methan), Stofftrennung, Sensorik und Katalyse.
Darstellung
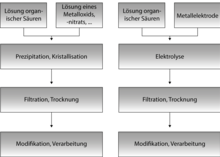
MOFs werden üblicherweise mittels Solvothermalsynthesen dargestellt. Solvothermalsynthesen finden in abgeschlossenen Reaktionsgefäßen, bei Temperaturen oberhalb des Siedepunktes des Lösungsmittels und hohen Drücken statt. Durch diese Bedingungen wird die Lösefähigkeit des Lösungsmittels erhöht, so dass auch schwer lösliche Stoffe für die Synthese verwendet werden können. In der Solvothermalsynthese können molekulare Baueinheiten verwendet werden und komplexe, metastabile Produkte wie MOFs erzeugt werden.
Hochdurchsatz-Methoden
Hochdurchsatz-Methoden (HD-Methoden) sind ein Teilbereich der kombinatorischen Chemie und ein Werkzeug zur Effizienzsteigerung. Grundsätzlich gibt es zwei Synthesestrategien innerhalb der HD-Methoden: Zum einen den kombinatorischen Ansatz, hier laufen alle Reaktionen in einem Gefäß ab, was zu Produktgemischen führt und zum anderen die Parallelsynthese, hier laufen die Reaktionen in verschiedenen Gefäßen ab. Weiterhin wird zwischen dünnen Filmen und lösungsmittelbasierten Verfahren unterschieden.[5]
Dünne Filme werden durch verschiedenen Bedampfungsmethoden, wie z. B. Elektronenstrahl- und thermische Verdampfung oder chemische Transportreaktionen hergestellt. Klassische HD-Untersuchungen innerhalb der lösungsmittelbasierten Verfahren sind Solvothermal- und Sol-Gel-Synthesen.[5]
Solvothermalsynthesen können klassisch im Teflonreaktor in einem Umluftofen oder auch in Glasreaktoren in einem Mikrowellenofen (Hochdurchsatz-Mikrowellenofen, HDMW) durchgeführt werden. Die Verwendung eines Mikrowellenofens verändert die Reaktionsparameter, die notwendig sind, um zum gewünschten Produkt zu gelangen, zum Teil dramatisch.[6]
Arbeitsablauf bei Solvothermalsynthesen im Teflonreaktor


Für Reaktionen im Teflonreaktor kann ein HD-Arbeitsablauf z. B. so aussehen, dass 24 Einzelreaktionen parallel durchgeführt werden. Dabei enthält ein Reaktorblock 24 Teflonreaktoren mit einem Volumen von jeweils 2 mL oder weniger. Normalerweise werden in der Solvothermalsynthese Teflonreaktoren mit einem Volumen von mindestens 20 mL verwendet. Die Miniatur-Teflonreaktoren werden dann z. B. mit Lösungen und Feststoffen befüllt und anschließend in einem HD-Reaktorblock mit zwei Teflonfolien versiegelt. Der Autoklav wird durch das Anziehen von Schrauben in einer Hydraulikpresse verschlossen – so präpariert kann der Reaktor im Ofen platziert werden. Die Mehrweg-Teflonfolie dient dazu der mechanische Beanspruchung zu widerstehen, während die Einweg-Teflonfolie die Teflonreaktoren abdichtet. Die alleinige Verwendung von Einweg-Teflonfolie führt dazu, dass sie unter der mechanischen Beanspruchung reist und die Teflonreaktoren trockenlaufen, die gewünschte Reaktion kann so nicht ablaufen. Nach der Reaktion können die Produkte in einer speziellen Filtrierapparatur parallel isoliert und gewaschen werden. Auf dem Filterpapier liegen die Produkte dann getrennt in einer sogenannten Probenbibliothek vor und können im Anschluss durch Röntgenpulverbeugung charakterisiert werden. Die gewonnenen Informationen werden dann zur Planung weiterer Synthesen verwendet.
Arbeitsablauf bei Solvothermalsynthesen im Mikrowellenofen
Mit der Reaktionslösung und einem Rührfisch befüllt wird ein kleiner Glasreaktor (z. B. mit 2 mL Volumen) mit einer Teflonkappe und einem Schraubdeckel verschlossen. Die Gefäße werden in einen Reaktionsblock aus Siliciumcarbid eingesetzt, welcher unter anderem eine gleichmäßige Wärmeverteilung ermöglicht. Abgedeckt mit einem Spritz- bzw. Explosionsschutz wird der Reaktionsblock im Mikrowellenofen positioniert, dann kann ein Temperatur-Zeit-Programm eingestellt werden. Die Isolierung der Produkte erfolgt wie beim Arbeitsablauf mit einem Teflonreaktor.
Postsynthetische Modifikation
Einige MOFs können nicht synthetisiert werden, da sie in den möglichen Reaktionsbedingungen instabil sind. Eine Möglichkeit diese MOFs dennoch darzustellen sind postsynthetische Modifikationen, bei denen Linker und Metallionen nach der eigentlichen Synthese ausgetauscht werden. Der postsynthetische Austausch von Linkern und Metallionen ist ein wachsendes Forschungsgebiet und eröffnet daher die Möglichkeiten für komplexere Strukturen und erhöhte Funktionalität.[7]
Kristallinität und Kristallisationsprozess
Hohe Temperaturen und ein hoher Druck innerhalb des Reaktionsgefäßes liefern generell gute Bedingungen für das Kristallwachstum, da Kristalldefekte (zu welchen MOFs neigen) wieder gelöst werden können.[8] Die Kristallisation kann heute durch Echtzeit-REM beobachtet werden.[9]
Modulatoren und Additive
Modulatoren und Additive sind Stoffe, welche die Bildung des MOFs unterstützen sollen. Im Allgemeinen können Modulatoren entweder den Nukleationsprozess erleichtern oder in das Partikelwachstum eingreifen. Modulatoren, die bei der Herstellung von MOFs verwendet werden, können in zwei Hauptgruppen eingeteilt werden, nämlich in deprotonierende und koordinierende Modulatoren. Die Erstgenannten erleichtern die Bindung von Linkern an die metallischen Cluster durch Deprotonierung von Linker-Molekülen und beschleunigt entsprechend die MOF-Bildung, während Letztere in Konkurrenz zu den Linkern stehen und die Bildungsgeschwindigkeit verringern.[8] Koordinierende Modulationsmittel sind typischerweise Monocarboxylatmoleküle, die mit den Polycarboxylat-Gerüstbildungs-Linkern konkurrieren und zu Unterschieden in der Kristallgröße und -morphologie führen.[8] So führt beispielsweise der Einsatz von Ameisensäure in der Synthese von MIL-88A zu größeren Partikeln mit einer gleichmäßigeren Größenverteilung bei gleichzeitigem Verlust der Morphologie (diamantförmige Kristalle werden sphärisch).[8]
Typen
Eine sinnvolle Einteilung von MOFs kann unter anderem anhand der verwendeten Linkermoleküle erfolgen.
Metallcarboxylate
Metallcarboxylate sind metallorganische Gerüstverbindungen, die durch Koordination von Carboxylatliganden an Metallionen aufgebaut sind. Die Verfügbarkeit, Verbreitung und Vielfalt von Linkermolekülen mit deprotonierbaren Säuregruppen hat zu einer großen Vielfalt von metallorganischen Gerüftverbindungen geführt.
Synthese
Die Synthese wird üblicherweise unter hydrothermalen oder solvothermalen Bedingungen mit Reaktionszeiten im Bereich von wenigen Stunden bis zu mehreren Tagen durchgeführt. Wie bei MOFs üblich umfasst die Entdeckung neuer Verbindungen das Screening diverser Reaktionsparameter wie pH-Wert, Temperatur, Konzentration, der Menge und Art an Mineralisatoren oder Kristallisationsmodulatoren (siehe dazu oben "Darstellung").
Linkermoleküle
Als Anionen ihrer Säuren können carboxylatgruppenhaltige Moleküle als Liganden von Metallkationen eingesetzt werden, besonders häufig Anwendung finden Moleküle mit zwei oder mehr Carboxylat-Gruppen.
Dicarboxylat-Linker
Als Dicarboxylat-Linker können unter anderem folgende Moleküle genutzt werden:[10]
- Terephthalsäure (z. B. in MOF-5 oder MIL-53)
- 4,4′-Sulfonyldibenzoesäure (z. B. in IITKGP-6 oder CAU-11)
Metallphosphonate
Metallphosphonate (MPs) sind metallorganische Gerüstverbindungen, die durch Koordination von Phosphonatliganden an Metallionen aufgebaut werden. Metallphosphonate weisen häufig eine außergewöhnliche chemische und thermische Stabilität, sowie eine geringe Löslichkeit in vielen Lösungsmitteln auf.[11]
Potentiell Anwendung könnten MPs in Ionentauschern, in der Interkalationschemie, Protonenleitung und in der Katalyse finden.[11]
Synthese
Die Synthese von MPs ist MOF-typisch ein zeitaufwendiger Prozess. Es gilt zu beachten, dass jedes Phosphonat-Systgem einzigartig reagiert und das Verhalten der Reaktionsmischung bisher nicht vorhersehbar ist.[11]
Linkermoleküle
Als Phosphonat-Linker können unter anderem die Anionen folgender Moleküle eingesetzt werden:[11]
- N, N-Piperazindiphosphonsäure (z. B. bei MIL-91(Al) und MIL-91(Ti))
- Phenylphosphonsäure () (z. B. bei )
Geschichte
Die Forschung an Metallphosphonaten wurde 1978 durch Alberti und Costantino et al. begründet. Sie stellten drei Zirkoniumphosphonate her: Zirkoniumphenylphosphonat, ; Zirkoniumhydroxymethylphosphonat, und Zirkoniumethylphosphat, .[11]
Gemischtfunktionelle Liganden
Moleküle mit mehr als einer Art funktioneller Gruppe, welche das Metallzentrum koordinieren kann, werden gerne eingesetzt, um so die Eigenschaften des MOFs zu beeinflussen. Beispiele sind unter anderem:
- 2,2′-Bipyridin-5,5′-Dicarbonsäure (z. B. der MOF Ga(OH)(bpydc), bekannt als COMOC-4 weist eine MOF-253-Topologie auf und besitzt lumineszente Eigenschaften)[13]
Struktur

Die Struktur klassisch-anorganischer Festkörper, wie z. B. die ionischen Verbindung Natriumchlorid oder das Metall Kupfer, kann in der Regel mit zwei konkurrierenden, aber ansonsten komplementierenden Konzepten beschrieben werden. Das eine Modell basiert auf verbundenen Koordinationspolyedern, das andere auf (dichteste) Kugelpackungen. Diese Modelle sind allerdings nicht mehr anwendbar, sobald z. B. der Grad an Unregelmäßigkeiten oder die Porosität zunimmt. So werden bereits Zeolithe durch Ringe unterschiedlicher Größe charakterisiert, die im dreidimensionalen Kanäle und Käfige bilden. Die Art wie diese Ringe räumlich verbunden sind ist entscheidend für die Beschreibung wichtiger Eigenschaften, wie dem Absorptionsverhalten. Die Beschreibung der räumlichen Verbindung der Ringe erfolgt in der Netzwerktopologie (engl. network topology).[6]
Da MOFs aus SBUs und Linkern aufgebaut sind ergeben sich Myriaden von Möglichkeiten, ihre Beschreibung durch Typen verschiedener Netze (innerhalb der Netzwerktopologie) ist daher sinnvoll.[6]
Netzwerktopologie
Die Beschreibung von MOFs erfolgt durch Netze. Ein Netz besteht aus den sogenannten Knotenpunkten bzw. Konnektoren, welche über die Linker verbunden sind. Die Knotenpunkte sind die anorganischen Baueinheiten in Form isolierter Metallatome oder Metall-Sauerstoff-Cluster. Ein leicht zugängliches Beispiel ist ein Bienenwabenmuster, welches ein 63-Netz darstellt: Jeder Knotenpunkt eines Sechsrings verbindet drei weitere Sechsringe.[1]
Heutzutage gibt es eine Vielzahl an verwendeten Methoden, um die Netze zu beschreiben, dies hat zu einer großen Verwirrung innerhalb der Forschung geführt.[10]
Verwendet werden unter anderem:[10]
- Schläfli-Symbole, inkl. langer Schläfli-Symbole
- Kristallographische Punktgruppen
- Vertex-Symbole
- Delaney-Symbole
- Der drei-Buchstaben Code der RCSR-Datenbank
Struktur der anorganischen Baueinheiten
Die anorganischen Baueinheiten können aus isolierten Metallatomen, Metall-Sauerstoff-Cluster, -Ketten oder -Schichten bestehen.[1] Strukturelle Besonderheiten können hier zum Beispiel verbrückende Hydroxidgruppen (μ-OH) sein.
Breathing effect
Beim sog. „Breathing effect“ (deutsch Atmungseffekt, Atmung) handelt es sich um das Phänomen, dass sich in einzelnen MOFs die kristallographischen Zellparameter in Abhängigkeit äußerer Parameter verändern.[1] Diese strukturelle Flexibilität stellt eine intensiv erforschte Eigenschaft von MOFs dar.[14] Äußere Parameter, die das Atmen auslösen können, sind Temperatur- oder Druckänderung und die Anwesenheit oder Abwesenheit von adsorbierten Gastmolekülen. Dabei bricht die Atmung keine kovalenten Bindungen, auch bleibt die Gesamttopologie des MOFs erhalten, alle strukturellen Änderungen sind reversibel. Innere Parameter, die das Atmen auslösen sind allgemein abhängig von:[9]
- Der Art des Metallkations in den Ketten
- Der chemische Natur der verschiedenen Gastmoleküle;
- Der Stärke der Wirt-Gast-Wechselwirkungen innerhalb der Poren
Im Speziellen kann es nur dann zum Breathing effect kommen, wenn Schwachstellen im Gerüst vorhanden sind. Drei Arten von Schwachstellen sind möglich:[14]
- Isomerisierung des Linkers (z. B. bei CAU-10-H oder CAU-13).
- Rotation des Liganden um die O-O-Achse der Carboxylatgruppen (englisch kneecap mechanism, deutsch Kniescheibenmechanismus, unter anderem zu beobachten bei MIL-53).
- Verschiebung miteinander verwobener Netze (vgl. Katenation).
Ändert sich lediglich das Zellvolumen, nicht aber die anderen kristallographischen Zellparameter wird eher von „flexiblen Strukturen“ als vom „Atmen“ gesprochen.
Katenation
Die Katenation (von lateinisch catena ‚Kette‘) beschreibt das sich gegenseitig Durchdringen von zwei oder mehr Netzwerken, dabei nimmt die Porosität der Verbindung in der Regel ab. Kommt es zwischen den Netzen allerdings zu starken Wechselwirkungen, so verringern sie ihren Abstand zueinander, was zu einer Stabilisierung der Verbindung bei gleichzeitig kaum verringerter Porosität fürt.[1]
Nomenklatur

Für Materialien, die der Klasse der porösen Metall-organischen Gerüstverbindungen angehören hat sich etabliert, statt der wenig aussagekräftigen Summenformeln Akronyme zu verwenden. Neben dem Akronym MOF gibt es noch eine große Vielfalt an anderen Kurzbezeichnungen, die oft aus der Bezeichnung der Forschungseinrichtung, der Orte derselben, Firmennamen oder der Ligandengruppen bestehen. So steht z. B. MIL für Matériaux de l'Institut Lavoisier,[15] ZIF (= Zeolitic Imidazolate Frameworks),[16] IRMOF (= IsoReticular Metal-Organic Framework),[17] HKUST (= Hong Kong University of Science & Technology),[18] COF (= Covalent Organic Frameworks),[19] BAF (= BergAkademie Freiberg Framework)[20] MFU (= Metal–Organic Framework Ulm University)[21] TOF (= Thorium Organic Framework)[22] oder CAU (= Christian-Albrechts-Universität). Nicht jeder MOF muss also auch "MOF" heißen. Einige bekannte MOF-Strukturen sind MOF-5, MOF-177, HKUST-1, MIL-53, BAF-4 und MFU-1.
Vergleich zu Zeolithen
Im Gegensatz zu Zeolithen, also anorganischen Kristallen mit Poren ähnlicher Größe, sind MOF weniger temperaturbeständig. Allerdings wird erwartet, dass die vielfältigen Möglichkeiten der organischen Chemie zu einer größeren Vielfalt von Materialien als bei Zeolithen führen wird, und auch die geringere Massendichte ist für manche Anwendungen von Vorteil.
Anwendungen
Für mögliche Anwendungen als Katalysatoren ist die große innere Oberfläche (bis über 4500 m2/g beim MOF-177) von Bedeutung. Die Porengröße kann über die Größe der organischen Liganden exakt festgelegt werden, so dass nur Reaktanten einer bestimmten Größe hinein passen. Dadurch kann eine hohe Selektivität erwartet werden.
Einige MOFs weisen sehr gute Adsorptionseigenschaften auf, diese machen sie interessant für den Einsatz in Adsorptionskältemaschinen. In einer Adsorptionskältemaschine wird Wärme, bzw. Kälte durch Adsorption bzw. Verdampfen eines Lösungsmittels erzeugt. Dazu wird das System in zwei Teilsysteme geteilt, in dem einen befindet sich ein Lösungsmittel (z. B. Wasser) und in dem anderen der MOF. Beide Teilsysteme sind durch ein Verbindungsrohr mit Ventil verbunden, wird das Ventil geöffnet, so kann Lösungsmittel verdampfen und entzieht der Umgebung Wärme (Verdampfungsenthalpie), während bei der Adsorption des Lösungsmittels am MOF Wärme frei wird (Adsorptionsenthalpie).[23]
Varianten
Am besten untersucht ist MOF-5, dessen Formel Zn4O(BDC)3 ist. Die Elementarzelle besteht aus einem Zn4O-Tetraeder. An jede Kante des Tetraeders bindet ein organischer Ligand (1,4-Benzoldicarboxyl, kurz BDC), das ergibt sechs BDC-Moleküle an jedem Zn4O-Cluster. Mit den anderen Enden binden die BDC-Moleküle an andere Zn4O-Cluster. Dadurch kommt ein regelmäßiges, kubisches Gitter zustande, bei dem die Zn4O-Cluster die Eckpunkte der Würfel und die BDC-Moleküle die Kanten bilden. In den Hohlräumen im Inneren der Würfel bleiben Moleküle des Lösungsmittels, das zur Synthese verwendet wird, zurück. Das Lösungsmittel wird durch Erhitzen entfernt.
Analoge 2D-Strukturen sind auch auf Oberflächen direkt mit Rastertunnelmikroskopie beobachtbar.[24]
Ein neues Verfahren zur Herstellung metallorganischer Gerüste (MOFs) haben Forscher des Instituts für Funktionelle Grenzflächen (IFG) des KIT, der Jacobs University Bremen und weiterer Einrichtungen entwickelt. Hierbei wachsen die MOF-Strukturen epitaktisch, das heißt schichtweise, auf der Oberfläche von Substraten (SURMOFs – Surface Mounted Metal Organic Frameworks). So lassen sich Größe und Form der Poren ebenso wie deren chemische Funktionalität für die jeweilige Anwendung maßschneidern. Eine spezielle Methode, die sogenannte Flüssigphasen-Epitaxie (LPE – Liquid Phase Epitaxy) gestattet es, auch Gerüststrukturen herzustellen, die sich mit den normalen nasschemischen Methoden nicht erzeugen lassen. Zur Herstellung dieser neuartigen, als SURMOFs 2 bezeichneten Serie von MOFs synthetisierten die Wissenschaftler verschiedene organische Moleküle unterschiedlicher Länge. Die Porengröße der neuen metallorganischen Gerüstverbindungen beträgt bis zu drei mal drei Nanometer. Die Forscher arbeiten daran, die Länge der organischen Streben noch weiter zu vergrößern, um noch größere Proteine und im nächsten Schritt sogar metallische Nanopartikel in die Gerüststrukturen einzubetten, was interessante Anwendungen in der Optik und Photonik ermöglichen würde.[25]
Charakterisierung
Zur Charakterisierung eines MOFs stehen unter anderem folgende Methoden zur Verfügung:
- Schwingungsspektroskopie
- Röntgenpulverbeugung
- CHNS-Elementaranalyse
- Thermogravimetrie
- Sorptionsmessung
Besondere Merkmale
IR-Spektroskopie
Treten in der anorganischen Baueinheit des MOFs verbrückende Hydroxidgruppen auf (μ-OH) so ist eine scharfe OH-Bande bei ca. 3500 cm−1 zu beobachten. Ist die verbrückende Hydroxidgruppe darüber hinaus in Wasserstoffbrückenbindungen involviert so verbreitert sich die Bande (z. B. bei CAU-11 der Fall, dort werden die Schichten des MOFs durch Wasserstoffbrückenbindungen zwischen verbrückenden Hydroxid-Ionen und Sulfonylgruppen zusammengehalten.[26])
Literatur
- Stefan Kaskel: Poren per Baukasten. ( vom 6. Oktober 2007 im Internet Archive) In: Nachrichten aus der Chemie. 53, April 2005, S. 394–399.
- A. Breitruck, H. E. Hoster, R. J. Behm: Short-range order in a metal-organic network. In: J. Phys. Chem. C. 113, 2009, S. 21265–21268.[24]
Weblinks
Einzelnachweise
- ↑ a b c d e Sebastian Bauer, Norbert Stock: MOFs – Metallorganische Gerüststrukturen. Funktionale poröse Materialien. In: Chemie in unserer Zeit. Band 42, Nr. 1, Februar 2008, ISSN 0009-2851, S. 12–19, doi:10.1002/ciuz.200800434.
- ↑ a b c Stuart R. Batten, Neil R. Champness, Xiao-Ming Chen, Javier Garcia-Martinez, Susumu Kitagawa: Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013). In: Pure and Applied Chemistry. Band 85, Nr. 8, 31. Juli 2013, ISSN 1365-3075, S. 1715–1724, doi:10.1351/pac-rec-12-11-20 (degruyter.com [abgerufen am 16. Oktober 2018]).
- ↑ Ulrich Stoeck: Neue, poröse metallorganische Gerüstverbindungen und organometallische Koordinationspolymere: Darstellung, Charakterisierung und Evaluierung ihres Potentials für die Gasspeicherung und Katalyse. Hrsg.: Lehrstuhl für anorganische Chemie I der Technischen Universität zu Dresden. Dresden Juni 2013, S. 5.
- ↑ IUPAC Provisional Recommendations on Metal-Organic Framework and Coordination Polymer Terminology – CrystEngComm Blog. Abgerufen am 26. August 2018 (amerikanisches Englisch).
- ↑ a b Sebastian Bauer, Norbert Stock: Hochdurchsatz-Methoden in der Festkörperchemie. Schneller zum Ziel. In: Chemie in unserer Zeit. Band 41, Nr. 5, Oktober 2007, ISSN 0009-2851, S. 390–398, doi:10.1002/ciuz.200700404.
- ↑ a b c Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Wiley, 2016, ISBN 978-3-527-69308-5, S. 6–7.
- ↑ Sunirban Das, Hyunuk Kim, Kimoon Kim: Metathesis in Single Crystal: Complete and Reversible Exchange of Metal Ions Constituting the Frameworks of Metal−Organic Frameworks. In: Journal of the American Chemical Society. Band 131, Nr. 11, 25. März 2009, ISSN 0002-7863, S. 3814–3815, doi:10.1021/ja808995d (acs.org [abgerufen am 30. Juli 2018]).
- ↑ a b c d Elham Bagherzadeh, Seyed Mojtaba Zebarjad, Hamid Reza Madaah Hosseini: Morphology Modification of the Iron Fumarate MIL-88A Metal-Organic Framework Using Formic Acid and Acetic Acid as Modulators. In: European Journal of Inorganic Chemistry. Band 2018, Nr. 18, 11. Mai 2018, ISSN 1434-1948, S. 1909–1915, doi:10.1002/ejic.201800056.
- ↑ a b Thierry Loiseau, Christophe Volkringer, Mohamed Haouas, Francis Taulelle, Gérard Férey: Crystal chemistry of aluminium carboxylates: From molecular species towards porous infinite three-dimensional networks. In: Comptes Rendus Chimie. Band 18, Nr. 12, Dezember 2015, ISSN 1631-0748, S. 1350–1369, doi:10.1016/j.crci.2015.08.006.
- ↑ a b c Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Band 1. Wiley, 2016, ISBN 978-3-527-69308-5, S. 11–12.
- ↑ a b c d e Stephen J.I. Shearan, Norbert Stock, Franziska Emmerling, Jan Demel, Paul A. Wright, Konstantinos D. Demadis, Maria Vassaki, Ferdinando Costantino, Riccardo Vivani, Sébastien Sallard, Inés Ruiz Salcedo, Aurelio Cabeza, Marco Taddei: New Directions in Metal Phosphonate and Phosphinate Chemistry. In: Crystals. Band 9, Nr. 5, 24. Mai 2019, S. 270, doi:10.3390/cryst9050270.
- ↑ Alex Aziz, A. Rabdel Ruiz-Salvador, Norge C. Hernández, Sofia Calero, Said Hamad: Porphyrin-based metal-organic frameworks for solar fuel synthesis photocatalysis: band gap tuning via iron substitutions. In: Journal of Materials Chemistry A. Band 5, Nr. 23, 2017, ISSN 2050-7488, S. 11894–11904, doi:10.1039/C7TA01278K (rsc.org [abgerufen am 21. Juni 2019]).
- ↑ Ying-Ya Liu, Roel Decadt, Thomas Bogaerts, Karen Hemelsoet, Anna M. Kaczmarek: Bipyridine-Based Nanosized Metal–Organic Framework with Tunable Luminescence by a Postmodification with Eu(III): An Experimental and Theoretical Study. In: The Journal of Physical Chemistry C. Band 117, Nr. 21, 30. Mai 2013, ISSN 1932-7447, S. 11302–11310, doi:10.1021/jp402154q.
- ↑ a b Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Band 1. Wiley, 2016, ISBN 978-3-527-69308-5, S. 127–128.
- ↑ C. Livage, C. Egger, G. Férey: In: Chem. Mater. 11, 1999, S. 1546–1550.
- ↑ H. Hayashi, A. P. Côté, H. Furukawa, M. O'Keeffe, O. M. Yaghi: In: Nature Materials. 6, 2007, S. 501–506.
- ↑ M. Eddaoudi, J. Kim, N. Rosi, D. Vodak, J. Wachter, M. O'Keeffe, O. M. Yaghi: In: Science. 295, 2002, S. 469–472.
- ↑ S. S.-Y. Chui, S. M.-F. Lo, J. P. H. Charmant, A. G. Orpen, I. D. Williams: In: Science. 283, 1999, S. 1148–1150.
- ↑ L. Zhao, C. Zhong: In: J. Phys. Chem. C. 113, 2009, S. 16860–16862.
- ↑ S. Hausdorf, W. Seichter, E. Weber, F. Mertens: Dalton Transactions. 2009, S. 1107–1113.
- ↑ M. Tonigold, Y. Lu, B. Bredenkötter, B. Rieger, S. Bahnmüller, J. Hitzbleck, G. Langstein, D. Volkmer: In: Angew. Chem. Int. Ed. 48, 2009, S. 7546–7550.
- ↑ K. M. Ok, J. Sung, G. Hu, R. M. J. Jacobs, D. O'Hare: In: J. Am. Chem. Soc. 130, 2008, S. 3762–3763.
- ↑ Dominik Fröhlich, Evangelia Pantatosaki, Panagiotis D. Kolokathis, Karen Markey, Helge Reinsch: Water adsorption behaviour of CAU-10-H: a thorough investigation of its structure–property relationships. In: Journal of Materials Chemistry A. Band 4, Nr. 30, 26. Juli 2016, ISSN 2050-7496, S. 11859–11869, doi:10.1039/c6ta01757f (rsc.org [abgerufen am 26. Januar 2018]).
- ↑ a b A. Breitruck, H. E. Hoster, R. J. Behm: Short-range order in a metal-organic network. In: J. Phys. Chem. C. 113, 2009, S. 21265–21268 (PDF; 7,2 MB) ( vom 25. Mai 2010 im Internet Archive)
- ↑ Jinxuan Liu, Binit Lukose, Osama Shekhah, Hasan Kemal Arslan, Peter Weidler, Hartmut Gliemann, Stefan Bräse, Sylvain Grosjean, Adelheid Godt, Xinliang Feng, Klaus Müllen, Ioan‐Bogdan Magdau, Thomas Heine, Christof Wöll: A novel series of isoreticular metal organic frameworks: realizing metastable structures by liquid phase epitaxy. In: Nature Scientific Reports 2, Article number: 921. 2012, doi:10.1038/srep00921.
- ↑ Nele Reimer, Helge Reinsch, A. Ken Inge, Norbert Stock: New Al-MOFs Based on Sulfonyldibenzoate Ions: A Rare Example of Intralayer Porosity. In: Inorganic Chemistry. Band 54, Nr. 2, 24. Dezember 2014, ISSN 0020-1669, S. 492–501, doi:10.1021/ic502242j (acs.org [abgerufen am 13. November 2018]).









