„Metallorganische Gerüstverbindung“ – Versionsunterschied
| [ungesichtete Version] | [gesichtete Version] |
Elrond (Diskussion | Beiträge) Änderung 175718606 von 79.220.183.32 rückgängig gemacht; Löslichkeit ist so nicht korrekt, da war der ursprüngliche Begriff schon besser, wenn auch nicht optimal Markierung: Rückgängigmachung |
|||
| Zeile 3: | Zeile 3: | ||
== Darstellung == |
== Darstellung == |
||
[[Datei:MOF Herstellungsverfahren.png|mini|Flussdiagramm der MOF-Synthese auf solvothermalem und elektrochemischem Weg.]] |
[[Datei:MOF Herstellungsverfahren.png|mini|Flussdiagramm der MOF-Synthese auf solvothermalem und elektrochemischem Weg.]] |
||
MOFs werden üblicherweise mittels [[Solvothermalsynthese]]n dargestellt. Solvothermalsynthesen finden in abgeschlossenen Reaktionsgefäßen, bei Temperaturen oberhalb des Siedepunktes des Lösungsmittels und hohen Drücken statt. Durch diese Bedingungen wird die |
MOFs werden üblicherweise mittels [[Solvothermalsynthese]]n dargestellt. Solvothermalsynthesen finden in abgeschlossenen Reaktionsgefäßen, bei Temperaturen oberhalb des Siedepunktes des Lösungsmittels und hohen Drücken statt. Durch diese Bedingungen wird die Lösefähigkeit des Lösungsmittels erhöht, so dass auch schwer lösliche Stoffe für die Synthese verwendet werden können. In der Solvothermalsynthese können molekulare Baueinheiten verwendet werden und komplexe, metastabile Produkte wie MOFs erzeugt werden. |
||
== Nomenklatur == |
== Nomenklatur == |
||
Version vom 4. April 2018, 16:25 Uhr

Metall-organische Gerüste (engl.: metal-organic frameworks, MOF) sind mikroporöse kristalline Materialien, die aus metallischen Knotenpunkten, den sogenannten SBUs (Secondary Building Units) und organischen Molekülen (Linkern) als Verbindungselementen zwischen den Knotenpunkten aufgebaut sind. Es können ein-, zwei- und dreidimensional Netzwerke ausgebildet werden, wobei ein- und zweidimensionale Strukturen eher als Koordinationspolymere anzusehen sind, da sie keine Poren wie die dreidimensionalen Strukturen besitzen. Die Poren sind nach der Synthese mit Gastmolekülen (z. B. Lösungsmittel oder nicht umgesetzten Linkern) gefüllt. Durch die Entfernung der Gastmoleküle können die Poren zugänglich gemacht werden, wodurch jedoch auch einige Netzwerke kollabieren. Potentielle Anwendungsgebiete finden sich in Gasspeicherung (z. B. Wasserstoff, Methan), Stofftrennung, Sensorik und Katalyse.
Darstellung
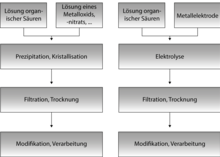
MOFs werden üblicherweise mittels Solvothermalsynthesen dargestellt. Solvothermalsynthesen finden in abgeschlossenen Reaktionsgefäßen, bei Temperaturen oberhalb des Siedepunktes des Lösungsmittels und hohen Drücken statt. Durch diese Bedingungen wird die Lösefähigkeit des Lösungsmittels erhöht, so dass auch schwer lösliche Stoffe für die Synthese verwendet werden können. In der Solvothermalsynthese können molekulare Baueinheiten verwendet werden und komplexe, metastabile Produkte wie MOFs erzeugt werden.
Nomenklatur

Für Materialien, die der Klasse der porösen Metall-organischen Gerüstverbindungen angehören hat sich etabliert, statt der wenig aussagekräftigen Summenformeln Akronyme zu verwenden. Neben dem Akronym MOF gibt es noch eine große Vielfalt an anderen Kurzbezeichnungen, die oft aus der Bezeichnung der Forschungseinrichtung, der Orte derselben, Firmennamen oder der Ligandengruppen bestehen. So steht z. B. MIL für Matériaux de l'Institut Lavoisier[1], ZIF (= Zeolitic Imidazolate Frameworks)[2], IRMOF (= IsoReticular Metal-Organic Framework)[3], HKUST (= Hong Kong University of Science & Technology)[4],COF (= Covalent Organic Frameworks)[5], BAF (= BergAkademie Freiberg Framework)[6], MFU (= Metal–Organic Framework Ulm University)[7], TOF (= Thorium Organic Framework)[8] oder CAU (= Christian-Albrechts-Universität). Nicht jeder MOF muss also auch "MOF" heißen. Einige bekannte MOF-Strukturen sind MOF-5, MOF-177, HKUST-1, MIL-53, BAF-4 und MFU-1.
Vergleich zu Zeolithen
Im Gegensatz zu Zeolithen, also anorganischen Kristallen mit Poren ähnlicher Größe, sind MOF weniger temperaturbeständig. Allerdings wird erwartet, dass die vielfältigen Möglichkeiten der organischen Chemie zu einer größeren Vielfalt von Materialien als bei Zeolithen führen wird, und auch die geringere Massendichte ist für manche Anwendungen von Vorteil.
Anwendungen

Für mögliche Anwendungen als Katalysatoren ist die große innere Oberfläche (bis über 4500 m2/g beim MOF-177) von Bedeutung. Die Porengröße kann über die Größe der organischen Liganden exakt festgelegt werden, so dass nur Reaktanten einer bestimmten Größe hinein passen. Dadurch kann eine hohe Selektivität erwartet werden.
Einige MOFs weisen sehr gute Adsoptionseigenschaften auf, diese machen sie interessant für den Einsatz in Adsorptionskältemaschinen. In einer Adsorptionskältemaschine wird Wärme, bzw. Kälte durch Adsorption bzw. Verdampfen eines Lösungsmittels erzeugt. Dazu wird das System in zwei Teilsysteme geteilt, in dem einem befindet sich ein Lösungsmittel (z. B. Wasser) und in dem anderen der MOF. Beide Teilsysteme sind durch ein Verbindungsrohr mit Ventil verbunden, wird das Ventil geöffnet, so kann Lösungsmittel verdampfen und entzieht der Umgebung Wärme (Verdampfungsenthalpie), während bei der Adsorption des Lösungsmittels am MOF Wärme frei wird (Adsorptionsenthalpie).[9]
Varianten
Am besten untersucht ist MOF-5, dessen Formel Zn4O(BDC)3 ist. Die Elementarzelle besteht aus einem Zn4O-Tetraeder. An jede Kante des Tetraeders bindet ein organischer Ligand (1,4-Benzoldicarboxyl, kurz BDC), das ergibt sechs BDC-Moleküle an jedem Zn4O-Cluster. Mit den anderen Enden binden die BDC-Moleküle an andere Zn4O-Cluster. Dadurch kommt ein regelmäßiges, kubisches Gitter zustande, bei dem die Zn4O-Cluster die Eckpunkte der Würfel und die BDC-Moleküle die Kanten bilden. In den Hohlräumen im Inneren der Würfel bleiben Moleküle des Lösungsmittels, das zur Synthese verwendet wird, zurück. Das Lösungsmittel wird durch Erhitzen entfernt.
Analoge 2D-Strukturen sind auch auf Oberflächen direkt mit Rastertunnelmikroskopie beobachtbar.[10]
Ein neues Verfahren zur Herstellung metallorganischer Gerüste (MOFs) haben Forscher des Instituts für Funktionelle Grenzflächen (IFG) des KIT, der Jacobs University Bremen und weiterer Einrichtungen entwickelt. Hierbei wachsen die MOF-Strukturen epitaktisch, das heißt schichtweise, auf der Oberfläche von Substraten (SURMOFs – Surface Mounted Metal Organic Frameworks). So lassen sich Größe und Form der Poren ebenso wie deren chemische Funktionalität für die jeweilige Anwendung maßschneidern. Eine spezielle Methode, die sogenannte Flüssigphasen-Epitaxie (LPE – Liquid Phase Epitaxy) gestattet es, auch Gerüststrukturen herzustellen, die sich mit den normalen nasschemischen Methoden nicht erzeugen lassen. Zur Herstellung dieser neuartigen, als SURMOFs 2 bezeichneten Serie von MOFs synthetisierten die Wissenschaftler verschiedene organische Moleküle unterschiedlicher Länge. Die Porengröße der neuen metallorganischen Gerüstverbindungen beträgt bis zu drei mal drei Nanometer. Die Forscher arbeiten daran, die Länge der organischen Streben noch weiter zu vergrößern, um noch größere Proteine und im nächsten Schritt sogar metallische Nanopartikel in die Gerüststrukturen einzubetten, was interessante Anwendungen in der Optik und Photonik ermöglichen würde.[11]
Literatur
- Stefan Kaskel: Poren per Baukasten ( vom 6. Oktober 2007 im Internet Archive), Nachrichten aus der Chemie, 53, April 2005, 394-399.
- A. Breitruck, H.E. Hoster, R.J. Behm, J. Phys. Chem. C, 113, 2009 21265-21268 Short-range order in a metal-organic network[10]
Weblinks
Einzelnachweise
- ↑ C. Livage, C. Egger, G. Férey, Chem. Mater., 1999, 11, 1546–1550
- ↑ H. Hayashi, A. P. Côté, H. Furukawa, M. O'Keeffe, O. M. Yaghi, Nature Materials, 2007, 6, 501-506
- ↑ M. Eddaoudi, J. Kim, N. Rosi, D. Vodak, J. Wachter, M. O'Keeffe, O. M. Yaghi, Science, 2002, 295, 469-472
- ↑ S. S.-Y. Chui, S. M.-F. Lo, J. P. H. Charmant, A. G. Orpen, I. D. Williams, Science, 1999, 283, 1148-1150
- ↑ L. Zhao, C. Zhong, J. Phys. Chem. C, 2009, 113, 16860–16862
- ↑ S. Hausdorf, W. Seichter, E. Weber, F. Mertens, Dalton Transactions, 2009, 1107-1113
- ↑ M. Tonigold, Y. Lu, B. Bredenkötter, B. Rieger, S. Bahnmüller, J. Hitzbleck, G. Langstein, D. Volkmer, Angew. Chem. Int. Ed., 2009, 48, 7546–7550
- ↑ K. M. Ok, J. Sung, G. Hu, R. M. J. Jacobs, D. O'Hare, J. Am. Chem. Soc., 2008, 130, 3762–3763
- ↑ Dominik Fröhlich, Evangelia Pantatosaki, Panagiotis D. Kolokathis, Karen Markey, Helge Reinsch: Water adsorption behaviour of CAU-10-H: a thorough investigation of its structure–property relationships. In: Journal of Materials Chemistry A. Band 4, Nr. 30, 26. Juli 2016, ISSN 2050-7496, S. 11859–11869, doi:10.1039/c6ta01757f (rsc.org [abgerufen am 26. Januar 2018]).
- ↑ a b A. Breitruck, H.E. Hoster, R.J. Behm, J. Phys. Chem. C, 113, 2009 21265-21268 Short-range order in a metal-organic network (PDF; 7,2 MB)
- ↑ Jinxuan Liu, Binit Lukose, Osama Shekhah, Hasan Kemal Arslan, Peter Weidler, Hartmut Gliemann, Stefan Bräse, Sylvain Grosjean, Adelheid Godt, Xinliang Feng, Klaus Müllen, Ioan‐Bogdan Magdau, Thomas Heine, Christof Wöll: A novel series of isoreticular metal organic frameworks: realizing metastable structures by liquid phase epitaxy. In: Nature Scientific Reports 2, Article number: 921. 2012, doi:10.1038/srep00921.full text




