„Glyphosat“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Katach (Diskussion | Beiträge) K →Umweltverhalten: grammatik |
Katach (Diskussion | Beiträge) zusammenfassung von geschichte, verbreitung, umweltverhalten und toxikologie in der einleitung, über review belegt |
||
| Zeile 30: | Zeile 30: | ||
}} |
}} |
||
'''Glyphosat''' ist eine biologisch wirksame Hauptkomponente von [[Herbizid|Breitbandherbiziden]]. |
'''Glyphosat''' ist eine biologisch wirksame Hauptkomponente von [[Herbizid|Breitbandherbiziden]]. Es wird seit über 30 Jahren weltweit zur Unkrautkontrolle eingesetzt. Glyphosat hat einzigartige und günstige umweltbezogene und toxikologische Eigenschaften.<ref name=glyphrev></ref> |
||
Verschiedene Glyphosat-Produkte unterscheiden sich in der Salzformulierung, dem Medium (Lösung oder Granulat) sowie der Wirkstoffkonzentration. Beispiele für Formulierungen sind das Glyphosat-Ammonium-Salz und das Glyphosat-Isopropylammonium-Salz. |
Verschiedene Glyphosat-Produkte unterscheiden sich in der Salzformulierung, dem Medium (Lösung oder Granulat) sowie der Wirkstoffkonzentration. Beispiele für Formulierungen sind das Glyphosat-Ammonium-Salz und das Glyphosat-Isopropylammonium-Salz. |
||
Version vom 17. Juni 2011, 17:00 Uhr
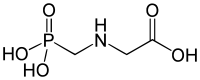
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Glyphosat | |||||||||
| Andere Namen |
N-(Phosphonomethyl)glycin | |||||||||
| Summenformel | C3H8NO5P | |||||||||
| Kurzbeschreibung |
farbloser, geruchloser Feststoff [1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 169,07 g·mol−1 [1] | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,71 g·cm−3 [1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
schlecht in Wasser (10,1 g·l−1 bei 20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Glyphosat ist eine biologisch wirksame Hauptkomponente von Breitbandherbiziden. Es wird seit über 30 Jahren weltweit zur Unkrautkontrolle eingesetzt. Glyphosat hat einzigartige und günstige umweltbezogene und toxikologische Eigenschaften.[4]
Verschiedene Glyphosat-Produkte unterscheiden sich in der Salzformulierung, dem Medium (Lösung oder Granulat) sowie der Wirkstoffkonzentration. Beispiele für Formulierungen sind das Glyphosat-Ammonium-Salz und das Glyphosat-Isopropylammonium-Salz.
Geschichte
John Franz, ein für Monsanto tätiger Wissenschaftler, entdeckte die herbizide Wirkung von Glyphosat im Jahre 1970. Die Substanz kam erstmals 1974 als Wirkstoff des Herbizids Roundup auf den Markt. Zunächst benutzten es die Bauern als billiges Mittel, um die Felder vor der Aussaat von Unkraut zu befreien, da es nichtselektiv wirkte. 1996 führte dann Monsanto genetisch verändertes Saatgut ein, das resistent gegen Glyphosat ist. Mit diesem neuen Saatgut konnten die Bauern Roundup vor, während und nach der Pflanzung einsetzen.[5]
Monsantos Patente auf Glyphosat sind in den meisten Staaten mittlerweile abgelaufen. Etwa die Hälfte des Angebots stammt heute (2010) aus China.[6] Neben Roundup sind Dutzende anderer glyphosathaltiger Herbizide auf dem Markt, z.B. Touchdown von Syngenta oder GlyphoMAX von Dow AgroSciences.[4][7]
Eigenschaften
Industriell hergestelltes Glyphosat hat im Mittel einen Reinheitsgrad von 96 % Trockengewicht. Der Rest verteilt sich auf einige Nebenprodukte der Synthese, ihr jeweiliger Anteil liegt unter einem Prozent.
Glyphosat ist eine amphotere Verbindung und hat daher mehrere pKa-Werte. Wegen ihrer hohen Polarität ist die Substanz in organischen Lösungsmitteln praktisch unlöslich. Eine typische Glyphosat-Formulierung enthält 356 g/l Glyphosat oder 480 g/l Isopropylamin-Glyphosat sowie ein Netzmittel, um das Eindringen durch die Pflanzenoberfläche zu verbessern.[8]
Verwendung und Wirkungsweise
Glyphosat ist ein nicht-selektives Blattherbizid mit systemischer Wirkung, das über grüne Pflanzenteile aufgenommen wird. Es wird gegen einkeim- und zweikeimblättrige Unkräuter im Acker-, Wein- und Obstbau, beim Anbau von Zierpflanzen, auf Wiesen, Weiden und Rasenflächen sowie im Forst verwendet.[9] In Deutschland, Österreich und in der Schweiz sind Glyphosat enthaltende Herbizide zugelassen.[10] Glyphosat ist eine strukturanaloge Verbindung des Phosphoenolpyruvats (PEP) und blockiert das Enzym 5-Enolpyruvylshikimat-3-phosphat-Synthase (EPSPS), das zur Synthese der aromatischen Aminosäuren Phenylalanin, Tryptophan und Tyrosin über den Shikimatweg benötigt wird.[11]
Glyphosat erhöht den Befall mit Wurzelpilzen (Fusarium) und behindert die Ansammlung von Knöllchenbakterien, was negative Folgen für die Pflanzenverfügbarkeit von Mangan und Stickstoff hat.[12]
Umweltverhalten
Die geringe Flüchtigkeit und hohe Dichte von Glyphosat verhindern, dass es evaporiert und sich mit dem Wind verteilt oder in der Luft verbleibt. Glyphosat ist stabil gegenüber Hydrolyse in sterilem Wasser unter den meisten relevanten pH-Werten und gegenüber Photolyse bei natürlichen Lichtquellen. Glyphosat ist biologisch abbaubar und wird durch Mikroorganismen sowohl unter aeroben als auch unter anaeroben Bedingungen zu Kohlenstoffdioxid und dem Hauptmetabolit AMPA abgebaut. AMPA wird ebenfalls von der Bodenmikroflora zu Kohlenstoffdioxid zersetzt, allerdings mit einer langsameren Abbaurate. Studien zeigen, dass 79–86 % von Glyphosat nach 6 Monaten zersetzt ist. Bei 93 in Europa und Nordamerika durchgeführten Feldversuchen betrug die Halbwertszeit in allen Fällen weniger als 1 Jahr und typischerweise weniger als 38 Tage. Zudem akkumuliert sich Glyphosat nicht und hat eine geringe Bodenaktivität. Die Aufnahme von Glyphosat durch Folgepflanzen der Fruchtfolge betrug in allen vorhandenen Studien weniger als 1 %.[4]
Wirkung auf Nichtzielorganismen
Die Wirkung von Glyphosat auf Nichtzielorganismen wurde umfangreich untersucht, unter anderem durch die EPA, die WHO, die EU, und vielen anderen Ländern und Wissenschaftlern.[4]
Toxikologie
Die Giftigkeit von Glyphosat ist für Nichtzielorganismen (Säugetiere, Vögel, Fische, und Wirbellose) gering, da das gehemmte Enzym EPSPS nur in pflanzlichen Zellen vorhanden ist. Die Toxizität von Glyphosat-basierten Produkten weicht davon in Abhängigkeit der Rezeptur ab. So führt beispielsweise die Verwendung von Netzmitteln (wie bei Roundup) zu einer höheren Toxizität, insbesondere bei Wassertieren. In Salzform ist Glyphosat weniger toxisch.[4] Von Tieren wird aufgenommenes Glyphosat schnell und unmetabolisiert wieder ausgeschieden.[9]
Als akute orale LD50 wurden bei der Ratte 4275 mg a.e./kg Körpergewicht (a.e. für acid equivalent) für Glyphosatsäure und 1550 mg a.e./kg für das ursprüngliche Roundup-Produkt (MON 2139) bestimmt. Bei einer zweijährigen Fütterungsstudie an Ratten und Hunden wurden bei der höchsten untersuchten Dosis von 300 mg/kg Futter keine schädlichen Wirkungen festgestellt. Die akute orale LD50 für die Virginiawachtel liegt bei 4971 mg a.e./kg für Glyphosatsäure und 1742 mg a.e./kg für das ursprüngliche Roundup-Produkt. Im 8-Tage-Fütterungstest wurde die LC50 bei Wachtel und Stockente mit > 4640 mg/kg Futter bestimmt. Bei der Honigbiene liegt die letale Dosis für Glyphosatsäure und das ursprüngliche Roundup-Produkt bei mehr als 100 bzw. 30 µg/Biene, beim Kompostwurm bei mehr als 2300 bzw. 1550 mg a.e./kg Erde für Glyphosatsalz bzw. das ursprüngliche Roundup-Produkt. Fische reagieren empfindlicher auf Glyphosat, als LC50 (96 Stunden) wurden bei der Forelle 86 mg/l Wasser und beim Sonnenbarsch 120 mg/l festgestellt.[9][13][4]
Glyphosatsalz gilt als praktisch nicht toxisch für alle untersuchten Tierarten. Glyphosatsäure gilt als praktisch nicht toxisch für den großen Wasserfloh, Ratten und Honigbienen, und leicht toxisch für Regenbogenforelle, den blauen Sonnenbarsch, und die Virginiawachtel. Das ursprüngliche Roundup-Produkt gilt als nicht toxisch für Honigbiene und Kompostwurm, leicht toxisch für Ratte und Virginiawachtel, und moderat toxisch für Regenbogenforelle, blauen Sonnenbarsch und Wasserfloh.[4]
Die Toxizität von Glyphosat für Amphibien wurde für 20 Arten aus drei Kontinenten getestet. Die geringste festgestellte letale Dosis (bei der empfindlichsten Art im empfindlichsten Entwicklungsstadium) beträgt 0,88 mg a.e./l (a.e. für acid equivalent) für den Krallenfrosch. Der niedrigste Wert aus Zulassungsstudien beträgt 1,7 mg/l für eine Fischart. Toxische Stoffe werden nur zugelassen, wenn die erwartbare Exposition mindestens zehnmal (USA) bzw. hundertmal (EU) geringer ist als die geringste in Zulassungsstudien gefundene letale Dosis. Der Schutz für Fische deckt somit auch Amphibien ab.[4]
Tatsächlich beobachtete Expositionswerte liegen jedoch deutlich unter den geringsten letalen Dosen. Die in einer 2002 durchgeführten Untersuchung von 51 Gewässern im mittleren Westen der USA maximal gemessene Expositionswert betrug 8,7 µg a.e./l und 95 % der Werte lagen zwischen 0,45 und 1,5 µg a.e./l. An 30 in 2004 und 2005 untersuchten Standorten im südlichen Ontario betrug der maximale beobachtete Expositionswert 40,8 µg a.e./l. In Feuchtgebieten mit bekannten Amphibienpopulationen liegen die Werte typischerweise unter 21 µg a.e./l. Die in der Natur gemessenen Expositionswerte liegen damit deutlich unter den im Labor festgestellten letalen Dosen.[4]
Zudem werden Netzmittel schnell abgebaut. Laut einer Studie beträgt die Halbwertszeit weniger als einen Tag.[4]
Die in detaillierten Studien zur Exposition von Landwirten beobachtete maximale systemische Exposition beträgt 0,004 mg/kg. Der maximale Wert ohne toxische Wirkung (NOEL) beträgt 175 mg/kg.[4] Für menschliche Plazentazellkulturen liegt die letale Dosis von Glyphosat und Roundup laut einer Studie bei 4,54 bzw. 2,52 g/l.[14] Die halbmaximale Inhibitionskonzentration (IC50) von Progesteron bei Mäusezellkulturen liegt nach einer Studie bei 24,4 mg/l für Roundup.[15]
Die generell niedrige Toxizität für Nichtzielorganismen aufgrund des nicht vorhandenen Enzyms EPSPS, der schnelle Abbau von Netzmitteln, und der große Abstands zwischen der mit dem Sicherheitsfaktor multiplizierten geringsten letalen Dosis und den in Studien beobachteten Expositionswerten in der Umwelt deuten darauf hin, dass Glyphosatapplikationen bei ordnungsgemäßer Anwendung keine Risiken für Nichtzielorganismen mit sich bringen.[4]
Kanzerogenität
Umfassende Laborstudien an Versuchstieren haben gezeigt, dass es keine Hinweise für Kanzerogenität, Mutagenität, Neurotoxizität, Reproduktionstoxizität, oder Teratogenität gibt. Für die EPA fällt Gylphosat unter eine Stoffgruppe, für die Beweise vorliegen, dass keine Kanzerogenität für den Mensch besteht. Die WHO geht davon aus, dass Glyphosat wahrscheinlich kein Karzinogen ist.[4][16]
Glyphosat wirkt durch Verzögerung einer am Zellzyklus beteiligten Cyclin-abhängigen Kinase auf den Zellteilungsprozess bei Seeigelembryonen. Ein Einatmen von Glyphosat bei der Ausbringung wird daher nicht empfohlen.[17] Eine epidemiologische Kohortenstudie mit 57.311 Landwirten aus Iowa und North Carolina, die Glyphosat verwenden, zeigte keinen Zusammenhang zwischen Glyphosatexposition und Inzidenz von Krebs oder den meisten Krebsunterarten, wenngleich eine Verbindung zwischen Glyphosat und Multiplem Myelom möglich erscheint.[18]
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Glyphosat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b IUCLID Datasheet.
- ↑ Datenblatt Glyphosate bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ a b c d e f g h i j k l m Gerald M. Dill, R. Douglas Sammons, Paul C. C. Feng, Frank Kohn, Keith Kretzmer, Akbar Mehrsheikh, Marion Bleeke , Joy L. Honegger, Donna Farmer, Dan Wright, Eric A. Haupfear (2010): Glyphosate: Discovery, Development, Applications, and Properties. In (Vijay K. Nandula, Hrsg.): Glyphosate Resistance in Crops and Weeds: History, Development, and Management. Wiley, 2010. S. 1–33.
- ↑ Chemical Engineering News, 20. Juli 2009.
- ↑ chiefexecutive.net: Monsanto's Hugh Grant, CEO of the Year 2010 (Interview, engl.)
- ↑ Vorlage:HPD.
- ↑ G. M. Williams, R. Kroes, I. C. Munro: Safety Evaluation and Risk Assessment of the Herbicide Roundup and Its Active Ingredient, Glyphosate, for Humans. Regulatory Toxikology and Pharmacology 31 (2000), S. 117–165.
- ↑ a b c Werner Perkow: Wirksubstanzen der Pflanzenschutz- und Schädlingsbekämpfungsmittel. 2. Auflage, Verlag Paul Parey, 2. Ergänzungslieferung März 1988.
- ↑ Vorlage:PSM.
- ↑ J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 773–775; ISBN 978-3-8274-1800-5.
- ↑ Kremer, R. & Means, N. (2009): Glyphosate and glyphosate-resistant crop interactions with rhizosphere microorganisms. European Journal of Agronomy. Vol. 31, Nr. 3, S. 153–161; doi:10.1016/j.eja.2009.06.004.
- ↑ Extension Toxicology Network – Pesticide Information Profiles -Glyphosate.
- ↑ Richard, S., Moslemi, S., Sipahutar, H., Benachour, N., Seralini, G. (2005): Differential Effects of Glyphosate and Roundup on Human Placental Cells and Aromatase, Environmental Health Perspectives. Vol. 113, Nr.6, S. 716–720.
- ↑ Walsh LP, McCormick C, Martin C, Stocco DM: Roundup inhibits steroidogenesis by disrupting steroidogenic acute regulatory (StAR) protein expression. In: Environ. Health Perspect. 108. Jahrgang, Nr. 8, August 2000, S. 769–776, PMID 10964798, PMC 1638308 (freier Volltext) – (ehponline.org).
- ↑ Glyphosate (General Fact Sheet), National Pesticide Telecommunications Network, November 2000.
- ↑ Julie Marc, Odile Mulner-Lorillon, Robert Bellé: Glyphosate-based pesticides affect cell cycle regulation. Biology of the Cell, Volume 96, Issue 3, April 2004, S. 245–249.
- ↑ Anneclaire J. De Roos, Aaron Blair, Jennifer A. Rusiecki, Jane A. Hoppin, Megan Svec, Mustafa Dosemeci, Dale P. Sandler, Michael C. Alavanja (2005): Cancer Incidence among Glyphosate-Exposed Pesticide Applicators in the Agricultural Health Study. Environmental Health Perspectives. Vol. 113, Nr. 1, S. 49–54; PMC 1253709 (freier Volltext).






