Strobilurine

Strobilurine sind eine Klasse von Naturstoffen und ihren synthetischen Abkömmlingen (Analoga). Ihr Name ist von den Pilzen der Gattung Strobilurus (Zapfenrüblinge) abgeleitet. Synthetisch hergestellte Strobilurine haben als Fungizidwirkstoffe im Pflanzenschutz große Bedeutung erlangt.
Geschichte
Die fungizide Wirkung von Inhaltsstoffen des Kiefernzapfenrüblings wurde Mitte der 1970er Jahre von Timm Anke (Technische Universität Kaiserslautern) entdeckt. Die Aufklärung der chemischen Struktur des dafür verantwortlichen Strobilurin A erfolgte durch Wolfgang Steglich (Universität Bonn). Da sich natürliche Strobilurine unter Lichteinfluss rasch zersetzen, wurde bei ihren synthetischen Analoga die zentrale Doppelbindung ersetzt, beispielsweise durch einen Phenylring. Dadurch konnte die Photostabilität entscheidend verbessert werden.[1] Die ersten Strobilurin-Fungizide waren im Jahre 1996 erhältlich. Bereits 1999 wurden weltweit Strobilurine im Wert von 600 Millionen Dollar umgesetzt, was einem Anteil von 10 % am Fungizidmarkt entsprach.[2]
Naturstoffe
Natürlicherweise werden Strobilurine von Pilzen wie dem Kiefernzapfenrübling und einigen weiteren Ständerpilzen (Basidiomyceten) hergestellt. Die Naturstoffe werden im Allgemeinen als Strobilurin A, Strobilurin B und so weiter bezeichnet, für Strobilurin A gibt es den Trivialnamen Mucidin.

Der Krustige Kernpilz (Camarops lutea) produziert die Strobilurine F, G und H. Strobilurin I wurde aus einer äthiopischen Champignon-Art isoliert, Strobilurin K aus dem Winter-Helmling (Mycena tintinnabulum) und einer neuseeländischen Favolaschia-Art. Die Strobilurine D und G scheinen identisch zu sein.[4] Die Biosynthese von Strobilurinen geschieht über Phenylalanin auf dem Shikimisäure-Weg. Sie haben eine fungizide Wirkung, zum Teil wirken sie auch cytostatisch (Strobilurin E) und antiviral.
Wirkungsweise
Strobilurine wirken in den Mitochondrien des Pilzes und hemmen die Zellatmung. Das geschieht durch die Unterbrechung des Elektronentransports in der mitochondrialen Atmungskette am Cytochrom bc1-Komplex.[5]
Toxizität und Ökotoxizität
Die Toxizität von Strobilurinen für Pflanzen und Säugetiere ist gering. Bei Warmblütern werden Strobilurine rasch enzymatisch durch Spaltung an der Estergruppe zur Säure umgewandelt. Fische, Wasserflöhe und Algen reagieren dagegen empfindlich auf Strobilurine. Wegen des raschen Abbaus dieser Stoffe in Boden, Sedimenten und im Wasser sind bei sachgerechter Anwendung keine Schadwirkungen zu erwarten.[5]
Verwendung
Strobilurine wirken in der Regel protektiv und müssen daher vorbeugend eingesetzt werden. Zur Bekämpfung bereits vorhandener Schadpilze und zur Erweiterung des Wirkungsspektrums werden sie oft als Kombipräparate mit Fungizidwirkstoffen aus der Klasse der Azole verkauft.[6] Die Wirkungsdauer der Strobilurine ist mit ungefähr vier Wochen deutlich länger als bei anderen Fungiziden.
Weitere Wirkungen
Die Behandlung mit Strobilurinen führt bei Pflanzen, insbesondere Getreide, zu einer intensiveren Grünfärbung der Blätter. Man bezeichnet das als „Grüneffekt“. Er beruht zu einem großen Teil darauf, dass mit Strobilurinen behandelte Pflanzen weniger durch Pilze geschädigt werden oder weniger Energie in deren Abwehr investieren müssen. Weitere Gründe könnten in einer vermehrten Bildung wachstumsfördernder Phytohormone, einem Absenken des CO2-Kompensationspunkts oder einem Verzögern von Alterungsprozessen liegen. Strobilurine scheinen die Alterung der Pflanzen zu verzögern, indem sie ihren Protein- und Chlorophyllabbau verlangsamen.[5]
Bei Getreide kann das einerseits zu einer Ertragssteigerung führen, da länger Stärke in das Korn eingelagert werden kann. Andererseits kann unreifes, grünes Stroh schlecht gedroschen werden, weshalb Strobilurine nicht kurz vor der Ernte angewendet werden sollten.[6] In der Praxis liegen die Mehrerträge infolge des Grüneffekts zwischen 0 und 5 dt Korn/ha und würden für sich alleine genommen den Einsatz von Strobilurinen nicht lohnen.[7]
Nachteilig auswirken kann sich der Einsatz von Strobilurinen auf chemothermische Umwandlungen (Verbrennen, Verschwelen) des Strohs. Bei unterschiedlichen Reifezeiten von Stroh und Korn können zum Erntezeitpunkt höhere Chlorgehalte im Stroh vorliegen. Dies bewirkt eine Chlorkorrosion an den Armaturen der Verbrennungsanlage und senkt in Verbindung mit Alkalimetallen wie Kalium und Natrium den Ascheschmelzpunkt, was zu Ablagerungen bei der Verbrennung oder Vergasung führt.
Resistenzen
Zahlreiche Pilze haben Resistenzen gegen Strobilurine entwickelt, so dass sie nicht mehr wirksam mit ihnen bekämpft werden können.[8] Eine Liste resistenter Pilze[9] wird regelmäßig vom Fungicide Resistance Action Committee veröffentlicht.
Übersichtstabelle Strobilurin-Fungizide
Die folgende Tabelle enthält die derzeit (Stand: Februar 2016) erhältlichen Fungizidwirkstoffe aus der Gruppe der Strobilurine. Die Spalten D, A und CH zeigen die Zulassung in Deutschland, Österreich oder der Schweiz an.[10]
| Name | CAS-Nummer | Hersteller | Einsatzbereich | Handelsnamen | Resistenzen | D | A | CH |
|---|---|---|---|---|---|---|---|---|
| Azoxystrobin | 131860-33-8 | Syngenta | breites Spektrum | Amistar, Ortiva | X | X | X | |
| Dimoxystrobin | 149961-52-4 | BASF | Weizen- und Rapsanbau | X | X | |||
| Fluoxastrobin | 361377-29-9 | Bayer | Getreideanbau | X | X | X | ||
| Kresoxim-methyl | 143390-89-0 | BASF | breites Spektrum | Stroby, Discus | Apfelschorf (Bodensee, Niederelbe)[11] | X | X | X |
| Metominostrobin | 133408-50-1 | Shionogi | Reisanbau | |||||
| Orysastrobin | 248593-16-0 | BASF | Reisanbau | |||||
| Picoxystrobin | 117428-22-5 | DuPont | Getreideanbau | Acanto | X | X | X | |
| Pyraclostrobin | 175013-18-0 | BASF | breites Spektrum | X | X | X | ||
| Trifloxystrobin | 141517-21-7 | Bayer | breites Spektrum | Twist/Gem/Swift, Flint | Apfelschorf (Bodensee, Niederelbe) | X | X | X |
Galerie Strobilurin-Strukturen
| Strobilurin | Allgemeine Struktur | R1 | R2 | CAS-Nummer | PubChem |
|---|---|---|---|---|---|
| A | 
|
–H | –H | 52110-55-1 | 6437379 |
| B | –OCH3 | –Cl | 65105-52-4 | 6441102 | |
| C | –OCH2–CH=C(CH3)2 | –H | 87081-57-0 | 6439808 | |
| F-1 | –OH | –H | |||
| F-2 | –H | –OCH2–CH=C(CH3)2 | |||
| H | –OCH3 | –H | 129145-65-9 | 6441226 |
- Strukturen kommerzieller Wirkstoffe
-
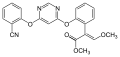
Azoxystrobin
-
Fluoxastrobin
-
Trifloxystrobin
-
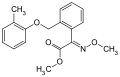
Kresoxim-methyl
-
Picoxystrobin
Galerie Oudemansin-Strukturen
| Oudemansin | Allgemeine Struktur | R1 | R2 | CAS-Nummer | PubChem |
|---|---|---|---|---|---|
| A | 
|
–H | –H | 73341-71-6 | 6438712 |
| B | –OCH3 | –Cl | 87081-56-9 | 6440791 | |
| X | –H | –OCH3 | 130640-32-3 | 6439301 |
Einzelnachweise
- ↑ Wirk- und Effektstoffe – Vom Naturstoff zum Pflanzenschutzmittel ( vom 15. März 2008 im Internet Archive). BASF AG; abgerufen am 28. April 2008.
- ↑ Bartlett et al.: Understanding the Strobilurin Fungicides. (PDF; 190 kB) In: Pesticide Outlook, August 2001, S. 143.
- ↑ Bernd Schäfer: Naturstoffe in der chemischen Industrie, Spektrum Akademischer Verlag, 2007, S. 479–480, ISBN 978-3-8274-1614-8.
- ↑ Veronika Hellwig, Johannes Dasenbrock, Dörte Klostermeyer, Stefan Kroiss, Tilman Sindlinger, Peter Spiteller, Bernd Steffan, Wolfgang Steglich, Michaela Engler-Lohr, Sylvia Semar, Timm Anke: New benzodioxepin type strobilurins from basidiomycetes. Structural revision and determination of the absolute configuration of strobilurin D and related beta-methoxyacrylate antibiotics. Tetrahedron, 1999, 55, 10101–10118, doi:10.1016/S0040-4020(99)00563-3
- ↑ a b c Kresoxim-methyl. Broschüre der BASF, etwa 1997.
- ↑ a b Wilhelm Bosse, Bernd Krieger: Neue Fungizide in der Praxis. In: DLG-Mitteilungen, 3/1998, S. 50–54.
- ↑ Jürgen Ceynowa, Henning Lindenberg: Neue Mittel – neue Strategien. In: DLG-Mitteilungen, 2/1997, S. 36–40.
- ↑ Dolores Fernández-Ortuño, Juan A. Torés, Antonio de Vicente, Alejandro Pérez-García: Mechanisms of resistance to QoI fungicides in phytopathogenic fungi (PDF; 149 kB). International Microbiology 11: 1–9, 2008.
- ↑ FRAC: Publications, dort unter „List of Resistant Plant Pathogens“.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 23. Februar 2016.
- ↑ Antiresistenzstrategien bei der Schorfbekämpfung, abgerufen am 20. April 2012.