Lorenzinische Ampullen
Als Lorenzinische Ampullen werden die Elektrorezeptoren der Knorpelfische (Haie, Rochen und Chimären) bezeichnet. Sie gehören zu den sogenannten ampullären Organen, einer bestimmten Art von Elektrorezeptoren, die man auch in vielen anderen Wirbeltier-Gruppen findet (z. B. bei basalen Strahlenflossern, Quastenflossern, Lungenfischen und im Wasser lebenden Amphibien). Durch sie können schwach elektrische Felder wahrgenommen werden. Dies ermöglicht die passive Elektroortung von Feinden und Beutetieren sowie die Orientierung am Erdmagnetfeld. Im Gegensatz dazu besitzen die meisten Knochenfische und an Land lebenden Wirbeltiere keine Elektrorezeptoren mehr.[1]
Entdeckung und Geschichte
Die ersten Untersuchungen an elektrorezeptiven Organen bei Fischen begannen im 17. Jahrhundert. Nach der ersten morphologischen Beschreibung der ampullären Organe bei Haien durch Stenonis (1664), folgte eine ausführliche Beschreibung durch Stefano Lorenzini im Jahr 1678, dem die Lorenzinischen Ampullen bis heute ihren Namen verdanken. Anfangs wurde ihnen eine mechanorezeptive Funktion zugesprochen, später wurden sie als Rezeptoren zur Messung der Temperatur oder des Salzgehaltes im Wasser angesehen. Ihre eigentliche Funktion als Elektrorezeptoren konnte erst in den 1960er Jahren durch die Arbeiten von Murray und Dijkgraaf & Kalmijn nachgewiesen werden.[2][3]
Aufbau



Eine Lorenzinische Ampulle besteht wie alle ampullären Organe aus zwei Teilen: Zum einen aus dem sogenannten „Ampullengang“, einem Kanal der meist parallel zur Körperoberfläche verläuft und in einer Pore auf der Haut mündet. An der Basis dieses Kanals, unter der Haut, liegt der zweite Teil des Organs, die sogenannte „Endampulle“. Diese besteht meist aus mehreren bläschenförmigen Aussackungen, die Alveolen genannt werden. Die Wand dieser Alveolen ist mit dem eigentlichen Sinnesepithel ausgekleidet, bestehend aus hunderten Rezeptorzellen und umgebenden Stützzellen.[1][3]
Zum Zentrum jeder Ampulle zieht ein Bündel afferenter Nervenendigungen, um so Informationen von den Elektrorezeptoren ans Gehirn zu senden. Efferente Fasern liegen nicht vor. Das heißt, dass nur Signale von den Sinneszellen zum Gehirn geleitet werden können, nicht aber vom Gehirn zurück an die Sinneszellen. Die Nervenfasern stammen dabei aus verschiedenen Ästen des vorderen Nervs des Seitenliniensystems (anteriorer Lateralisnerv; Äste des Lateralisnerv: Ramus superficialis ophthalmicus, R. buccalis, R. mandibularis), der auch die Neuromasten des Seitenliniensystems innerviert. Früher wurde die Innervierung der Lorenzinischen Ampullen fälschlicherweise dem Nervus trigeminus (V. Kopfnerv) und dem Nervus facialis (VII. Kopfnerv) zugeschrieben. Der Lateralisnerv wurde dabei als Ast dieser Kopfnerven und nicht als eigenständiger Nerv angesehen. Dies lag daran, dass die Wurzeln dieser drei Nerven im Gehirn sehr nah beieinander liegen. Der Lateralisnerv besitzt jedoch eigene Ganglien und zieht in andere Bereiche des Gehirns als der N. facialis und N. trigeminus und wird deshalb als eigenständiger Nerv angesehen.[4][6][1]
Zwei besondere Eigenschaften der Lorenzinischen Ampullen ermöglichen ihre Funktion als Elektrorezeptoren: Die Zellen, die Kanal und Ampulle auskleiden, sind durch sehr enge Zell-Zell-Verbindungen, sogenannte Tight Junctions, miteinander verbunden. Dadurch wird das innere des Ampullen-Lumens vom umgebenden Gewebe elektrisch isoliert. Mit bis zu 6 Mio. Ohm / cm halten die Kanalzellen der Lorenzinischen Ampullen den Rekord für den höchsten, jemals in einem tierischen Gewebe gemessenen elektrischen Widerstand. Das Lumen des Kanals und der Ampulle sind zudem mit einem klaren Gel aus Glykoproteinen gefüllt, das eine ähnliche Leitfähigkeit wie Wasser aufweist. Dadurch können Spannungsänderungen im Wasser in der Umgebung des Tiers über die Poren auf der Haut bis hin zu den Rezeptorzellen in den Ampullen ohne große zeitliche Verzögerung weitergeleitet werden.[6][2][3]
Nachdem ein Signal von einer Rezeptorzelle wahrgenommen und umgewandelt wurde, wird es an der Unterseite der Zelle über eine Synapse an ein afferentes Neuron weitergeleitet. Dessen Axon zieht über den vorderen Nerv des Seitenliniensystems bis ins Gehirn, wo es im dorsalen octavolateralen Nucleus (DON) in der Medulla oblongata des Rautenhirns endet. Vom DON ziehen aufsteigende Nervenbahnen zum kontralateralen Teil des Tectum Opticums und zu anderen Teilen des Mittelhirns und von dort wiederum weiter ins End- und Kleinhirn, zur weiteren Verarbeitung der wahrgenommenen Reize.[2]
-
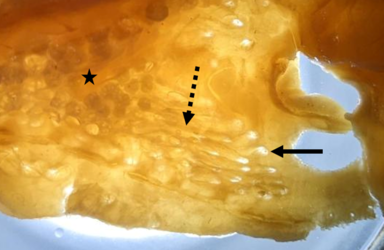
Rückseite eines Hautstücks von der ventralen Kopfseite des Dornhais (Squalus acanthias), neben der Nasenöffnung; zu erkennen sind die Poren der Lorenzinischen Ampullen (durchgezogener Pfeil), die Ampullengänge (gestrichelter Pfeil) und die Endampullen (Stern), bestehend aus vielen kleinen Alveolen. (Foto: Simon Bauerle)
-
Ventrales Ampullenfeld eines Fleckhais (Galeus melastomus); gut zu erkennen sind die mit Gallerte gefüllten Kanäle (Pfeil). (Foto: Simon Bauerle)
-
Vergrößerte Aufnahme (40x) von einem Cluster Lorenzinischer Ampullen des Dornhais (Squalus acanthias); zu erkennen sind zahlreiche Endampullen mit ihren bläschenförmigen Aussackungen, den Alveolen (durchgezogener Pfeil), sowie die Bündel afferenter Nervenfasern, die zu den Zentren jeder Ampulle ziehen (gestrichelter Pfeil). (Foto: Simon Bauerle)
Lage

Die Ampullen liegen stets in Clustern im Kopfbereich unter der Haut. In einem Cluster können bis zu 400 Ampullen vorkommen. Bei Haien und Chimären finden sich drei bis fünf, bei Rochen vier bis sechs solcher Cluster, die spiegelsymmetrisch angelegt sind. Die Kanäle strahlen ausgehend von diesen Ampullen-Clustern in alle Richtungen aus und bestimmen so die Form und Ausrichtung des elektrorezeptiven Felds. Bei Haien sind die Kanäle auf den Kopfbereich beschränkt, während sie bei Rochen bis in die Brustflossen ziehen.[8][2]
Beim Dornhai (Squalus acanthias) liegen fünf Ampullenfelder am Kopf vor. Das große Rezeptorfeld auf der Stirn des Dornhais wird durch den dorsal verlaufenden Ramus superficialis ophthalmicus innerviert. Die Porenfelder an der Unterseite der Schnauze und seitlich unter dem Auge werden durch den Ramus buccalis innerviert. Der hinter dem Spritzloch verlaufende Ramus mandibularis innerviert schließlich das zwischen Kiemen und Mund gelegene Porenfeld sowie das zwischen Spritzloch und Kiemen.[7][1]
-
Hautstück eines Dornhais (Squalus acanthias). A, Ansicht von außen auf die Hautoberfläche; zu erkennen sind die Poren der Lorenzinischen Ampullen (durchgezogener Pfeil) und die Poren des Seitenlinienkanals (gestrichelter Pfeil). B, Ansicht auf die Innenseite; zu erkennen sind die Ampullengänge der Lorenzinischen Ampullen (durchgezogener Pfeil), die unter der Haut von den Poren wegziehen, hin zu dem Cluster aus Endampullen (gestrichelter Pfeil). (Foto: Simon Bauerle)
-
Kopfbereich eines Dornhais (Squalus acanthias) mit abgezogener Haut. A, Ansicht von unten; zu erkennen ist der Ramus buccalis des vorderen Lateralisnervs (Pfeil) und die von ihm abgehenden Nervenfaserbündel, die zu den Lorenzinischen Ampullen ziehen. Diese wurden auf der linken Seite des Fotos, zusammen mit der Haut, abpräpariert. Auf der rechten Seite des Fotos ist das ventrale Porenfeld noch gut zu erkennen. B, Ansicht von oben; zu erkennen ist der Ramus superficialis ophthalmicus des vorderen Lateralisnervs (Pfeil) und die von ihm abgehenden Nervenfaserbündel, die zu den Lorenzinischen Ampullen des dorsalen Ampullenfelds ziehen. (Foto: Simon Bauerle)
Elektrorezeption und Physiologie
Die birnenförmigen Rezeptorzellen in den Lorenzinischen Ampullen der Knorpelfische besitzen einen zentralen Zellkern und ein einzelnes Kinocilium an der oberen (apikalen) Zellseite, welches in das Ampullen-Lumen ragt. Das Kinocilium weist dabei eine einzigartige Struktur aus 8 + 1 Mikrotubuli im Schaft und 9 + 0 Mikrotubuli an der Basis auf. Jede Rezeptorzelle ist von Stützzellen umgeben.[9][6][10]
Beim Großäugigen Hundshai (Iago omanensis), einer relativ kleinen Hai-Art (Männchen: 40 cm, Weibchen: 80 cm maximale Länge), konnten im Schnitt bis zu 9,3 Millionen dieser Sinneszellen pro Tier festgestellt werden.[3]
Die Sinneszellen geben im unerregten Zustand konstant eine gewisse Menge Neurotransmitter in den synaptischen Spalt ab. Dies bestimmt die Feuerrate, mit der das nachgeschaltete afferente Neuron Aktionspotentiale in Richtung Gehirn aussendet, man spricht von der Entladungsfrequenz in Ruhe. Nimmt die Sinneszelle nun eine positive Ladungsänderung wahr, verringert sich die Entladungsfrequenz des afferenten Neurons, während eine negative Ladungsänderung an der Sinneszelle zu einer Zunahme der Entladungsfrequenz führt. Die Feuerrate des Neurons nimmt dabei linear mit der Intensität des Stimulus zu. Die ankommenden Aktionspotentiale aller afferenter Neurone werden schließlich im Gehirn miteinander verrechnet, wodurch das Tier auch minimale Spannungsänderungen im elektrischen Feld um sich herum wahrnehmen kann.[2]
Stimuliert werden die Elektrorezeptoren durch schwache, negativ geladene Spannungen auf der Außenseite der Haut. Diese Spannungsänderungen werden über die Poren in der Haut an das Gel aus Glykoproteinen im Ampullenkanal und dadurch bis hin zu den Sinneszellen in den Alveolen weitergeleitet.[11][1][2] Kommen nun negative Ladungen über das extrazelluläre Gel bei einer Sinneszelle an, so wird zuerst der obere Teil der Zelle depolarisiert. Das heißt, dass das Zellinnere nun relativ zum extrazellulären Raum positiv geladen ist. Dadurch öffnen sich Spannungsgesteuerte Calcium-Kanäle, was zu einem Ca2+-Einstrom in die Sinneszelle führt. Durch den zunehmenden Einstrom positiv geladener Teilchen wird die gesamte Zellmembran nach und nach depolarisiert. Am unteren Ende der Zelle angekommen führt diese Depolarisation schließlich zur verstärkten Freisetzung von Neurotransmittern in den synaptischen Spalt. Die Neurotransmitter wiederum erhöhen die Feuerrate des nachgeschalteten, afferenten Neurons, das die Signale zum Gehirn sendet. Durch das einströmende Calcium öffnen sich mit der Zeit zudem immer mehr Calcium-gesteuerte Kalium-Kanäle, wodurch positiv geladene Kalium-Ionen (K+) aus der Zelle ausströmen. Dies führt schließlich zu einer Repolarisierung der Zellmembran hin zum Ruhepotential. Dadurch schließen sich die spannungsgesteuerten Ca2+-Kanäle. Die Rezeptorzelle liegt nun wieder in Ruhe vor und ein neuer Stimulus kann wahrgenommen werden.[2]
Funktion
Die Lorenzinischen Ampullen der Knorpelfische können sehr schwache, bioelektrische Spannungen von gerade mal 1 nV / cm wahrnehmen[2] und besitzen zwei Hauptfunktionen:
Zum einen dienen sie der passiven Elektroortung, also der Wahrnehmung schwach elektrischer Felder, die nicht vom Empfänger selbst erzeugt werden (daher „passiv“). Solche schwach elektrischen Felder werden beispielsweise von Beutetieren, Artgenossen oder Fressfeinden erzeugt. Auch im Sand vergrabene Beutetiere können so wahrgenommen werden, da deren Herz- und Atemmuskulatur unvermeidbar elektrische Ströme generieren. Dies konnte in zahlreichen Versuchen gezeigt werden.[11][1][2]
Die zweite Funktion der Lorenzinischen Ampullen bei Knorpelfischen ist die Navigation durch die Orientierung am Magnetfeld der Erde. So erzeugt das Schwimmen eines Hais im Meer beim Durchkreuzen des Erdmagnetfelds einen Spannungsvektor, der senkrecht zur Bewegungsrichtung und zum Magnetfeld gerichtet ist. Dieser, durch die Bewegung induzierte Stromfluss, kann durch die extrem sensitiven Lorenzinischen Ampullen wahrgenommen werden und dient dem Tier als eine Art Kompass. Auch dies wurde experimentell nachgewiesen.[11][1][2]
Evolution
Die Sinneszellen der Lorenzinischen Ampullen ähneln in ihrem Aufbau stark den Haarsinneszellen des Seitenliniensystems der Fische, die der Wahrnehmung mechanischer Reize dienen, und den Haarsinneszellen des Labyrinths, die unter anderem dem Hör- und Gleichgewichtssinn dienen.[11] Doch auch in der Embryonalentwicklung und der neuronalen Verschaltung finden sich große Ähnlichkeiten.
Vieles weist darauf hin, dass die Elektrorezeptoren im Laufe der Evolution aus den Haarsinneszellen des Seitenliniensystems hervorgegangen sind: So wird das Seitenliniensystem in der Embryonalentwicklung vor den Elektrorezeptoren angelegt. Außerdem ziehen die afferenten Nervenbahnen der Elektrorezeptoren zu evolutionär jüngeren Bereichen des Nachhirns (Medulla oblongata), während die mechanorezeptiven Nervenbahnen des Seitenliniensystems in ältere Teile des Nachhirns ziehen.[11]
Die Fähigkeit zur Elektrorezeption durch ampulläre Organe stellt dabei, ähnlich dem Seitenliniensystem, ein sehr altes sensorisches System dar. Da die meisten heute lebenden Fischgruppen elektrosensitiv sind (mit Ausnahme fast aller moderner Knochenfische) und bereits die ältesten Wirbeltiere, die sogenannten Ostracodermen, Elektrorezeptoren besaßen, wird die Elektrorezeption als ursprüngliches Merkmal der Wirbeltiere (Vertebraten) angesehen.[12][1][11] Das bedeutet, dass der letzte gemeinsame Vorfahre der Wirbeltiere bereits elektrosensitiv war. So finden wir auch heute noch bei fast allen im Wasser lebenden Wirbeltiergruppen Elektrorezeptoren: Angefangen bei den Neunaugen, den Knorpelfischen (z. B. Haie), den basalen Knochenfischen, Quastenflossern, Lungenfischen und im Wasser lebenden Amphibien. Die Schleimaale stellen dabei eine Ausnahme dar, da sie die Elektrorezeption vermutlich zusammen mit anderen ursprünglichen Merkmalen sekundär zurückgebildet haben.[8][11]
Die Vorfahren der Neopterygii (eine Gruppe moderner Knochenfische, zu denen die Knochen- und Kahlhechte, sowie alle Teleostier gehören) verloren im Laufe der Evolution ihre ampullären Organe und damit ihren elektrischen Sinn. Bis heute gibt es keine überzeugende evolutionäre Erklärung für diesen Verlust. Unabhängig davon ging die Elektrorezeption zudem in Fröschen und allen Amnioten (Reptilien, Vögeln & Säugetieren) verloren. Dies lässt sich durch das Leben an Land erklären, da Luft, anders als Wasser, keinen Strom leitet, wodurch Elektrorezeptoren hinfällig wurden.[1]
| Elektrorezeptoren |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die dargestellten phylogenetischen Verhältnisse basieren auf den Arbeiten von Irisarri et al., 2017[13] und Nelson et al., 2016[14]. Die Informationen zur Verbreitung der Elektrorezeptoren stammen aus den Arbeiten von Liem et al., 2001[1], von der Emde & Heiligenberg, 2001[11] und Zakon, 1988[8].
Nichtsdestotrotz liefert die Elektrorezeption eines der spannendsten Beispiele für konvergente Evolution (unabhängige Entstehung ähnlicher Merkmale in verschiedenen Gruppen durch einen ähnlichen Selektionsdruck). So kam es im Laufe der Evolution in drei verschiedenen Tiergruppen, unabhängig voneinander, zur Wiedergewinnung des elektrischen Sinns. Zum einen bei den Welsen (Siluriformes) und den mit ihnen verwandten Neuwelt-Messerfischen (Gymnotiformes), bei den Nilhechten (Mormyridae) und den Kloakentieren, einer Gruppe von Säugern, zu denen die Schnabeltiere und Schnabeligel zählen.[1]
Da die neu gewonnenen Elektrorezeptoren in den beiden Gruppen moderner Knochenfische (Messer- & Elefantenrüsselfische) kein einzelnes Kinocilium aufweisen, sondern eine Vielzahl an Mikrovilli,[11][12][1] und mit einer umgekehrten Polarisierung auf elektrische Reize reagieren, kann mit großer Sicherheit davon ausgegangen werden, dass keine Homologie zu den ursprünglichen Elektrorezeptoren (wie z. B. den Lorenzinischen Ampullen der Haie) besteht. Stattdessen handelt es sich hierbei um eine Neubildung. Bei den Kloakentieren gehen die Elektrorezeptoren aus umgewandelten Hautdrüsen hervor.[1]
Die Neuwelt-Messerfische und Nilhechte weisen neben den wiedergewonnen ampullären Organen zudem noch einen weiteren Typ von Elektrorezeptoren auf, sogenannte tuberöse Organe.[11][1]
Embryonalentwicklung
Die ampullären Organe gehen in der Embryonalentwicklung (Embryogenese) aus den neurogenen Plakoden des Seitenliniensystems hervor, die an den Seiten der Neuralfalte ausgebildet werden. Plakoden sind Verdickungen des Ektoderms, die in Wirbeltier-Embryonen angelegt werden und aus denen im Laufe der Embryonalentwicklung zahlreiche neuronale und nicht-neuronale Strukturen hervorgehen (z. B. die Haarzellen des Innenohrs oder die Augenlinse, aber auch Schuppen und Zähne). Zusammen mit den starken Ähnlichkeiten in Aufbau und Innervierung zwischen den Sinneszellen der Lorenzinischen Ampullen und den Haarsinneszellen des Seitenliniensystems unterstützt der gemeinsame embryonale Ursprung die Annahme, dass die Elektrorezeptoren aus den Mechanorezeptoren des Seitenliniensystems hervorgegangen sind.[1]
Einzelnachweise
- ↑ a b c d e f g h i j k l m n o p Karel F. Liem, Warren F., Jr. Walker: Functional anatomy of the vertebrates : an evolutionary perspective. 3rd ed Auflage. Harcourt College Publishers, Fort Worth 2001, ISBN 0-03-022369-5.
- ↑ a b c d e f g h i j Kyle C Newton, Andrew B Gill, Stephen M Kajiura: Electroreception in marine fishes: chondrichthyans. In: Journal of Fish Biology. 6. Juni 2019, ISSN 0022-1112, S. jfb.14068, doi:10.1111/jfb.14068 (wiley.com [abgerufen am 6. Februar 2023]).
- ↑ a b c d L. Fishelson, A. Baranes: Distribution, morphology, and cytology of ampullae of Lorenzini in the Oman shark, Iago omanensis (Triakidae), from the Gulf of Aqaba, Red Sea. In: The Anatomical Record. Band 251, Nr. 4, August 1998, ISSN 0003-276X, S. 417–430, doi:10.1002/(SICI)1097-0185(199808)251:4<417::AID-AR1>3.0.CO;2-P, PMID 9713980.
- ↑ a b K. H. Andres, M. von Düring: Chapter 14 Comparative anatomy of vertebrate electroreceptors. In: Progress in Brain Research (= Transduction and Cellular Mechanisms in Sensory Receptors). Band 74. Elsevier, 1. Januar 1988, S. 113–131, doi:10.1016/s0079-6123(08)63006-x (sciencedirect.com [abgerufen am 6. Februar 2023]).
- ↑ R. Douglas Fields, Theodore H. Bullock, G. David Lange: Ampullary Sense Organs, Peripheral, Central and Behavioral Electroreception in Chimeras (Hydrolagus, Holocephali, Chondrichthyes) (Part 1 of 2). In: Brain, Behavior and Evolution. Band 41, Nr. 6, 1993, ISSN 0006-8977, S. 269–278, doi:10.1159/000113849, PMID 8391892 (karger.com [abgerufen am 6. Februar 2023]).
- ↑ a b c Robert L. Boord, C. B. G. Campbell: Structural and Functional Organization of the Lateral Line System of Sharks. Oxford Academic, 1. August 2015, doi:10.1093/icb/17.2.431.
- ↑ a b Marinelli, W. & Strenger, A.: Vergleichende Anatomie und Morphologie der Wirbeltiere. Franz Deuticke Wien, 1959.
- ↑ a b c Jelle Atema: Sensory Biology of Aquatic Animals. Springer New York, New York, NY 1988, ISBN 1-4612-3714-9.
- ↑ Darryl L. Whitehead: Ampullary organs and electroreception in freshwater Carcharhinus leucas. In: Journal of Physiology-Paris. Band 96, Nr. 5, 1. September 2002, ISSN 0928-4257, S. 391–395, doi:10.1016/S0928-4257(03)00017-2 (sciencedirect.com [abgerufen am 6. Februar 2023]).
- ↑ Electroreceptors and Other Specialized Receptors in Lower Vertebrates. doi:10.1007/978-3-642-65926-3 (springer.com [abgerufen am 6. Februar 2023]).
- ↑ a b c d e f g h i j Josef Dudel, Reinhard Blickhan: Neurowissenschaft vom Molekül zur Kognition ; mit 32 Tabellen. 2., überarb. und aktualisierte Auflage. Berlin 2001, ISBN 3-540-41335-9.
- ↑ a b T. H. Bullock, D. A. Bodznick, R. G. Northcutt: The Phylogenetic Distribution of Electroreception: Evidence for Convergent Evolution of a Primitive Vertebrate Sense Modality. In: How do Brains Work? Papers of a Comparative Neurophysiologist. Birkhäuser, Boston, MA 1993, ISBN 1-4684-9427-9, S. 581–602, doi:10.1007/978-1-4684-9427-3_46.
- ↑ Iker Irisarri, Denis Baurain, Henner Brinkmann, Frédéric Delsuc, Jean-Yves Sire, Alexander Kupfer, Jörn Petersen, Michael Jarek, Axel Meyer, Miguel Vences, Hervé Philippe: Phylotranscriptomic consolidation of the jawed vertebrate timetree. In: Nature Ecology & Evolution. Band 1, Nr. 9, September 2017, ISSN 2397-334X, S. 1370–1378, doi:10.1038/s41559-017-0240-5, PMID 28890940, PMC 5584656 (freier Volltext) – (nature.com [abgerufen am 6. Februar 2023]).
- ↑ Joseph S. Nelson: Fishes of the world. Fifth edition Auflage. Hoboken, New Jersey 2016, ISBN 978-1-119-17484-4.