„HeLa-Zellen“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 2: | Zeile 2: | ||
'''HeLa-Zellen''' (HeLa-Linie; HeLa-Zellstamm) sind menschliche [[Epithel]]zellen eines [[Zervixkarzinom]]s ([[Gebärmutterhalskrebs]]) und die ersten menschlichen Zellen, aus denen eine permanente [[Zelllinie]] etabliert wurde. Die Zellen waren vom [[Humanes Papillomvirus|humanen Papillomvirus]] 18 (HPV18) befallen. Der Gendefekt konnte inzwischen aufgeklärt werden: Die Zellen waren sowohl durch ein virales Protein (Onkogen E6 oder E7), das den [[p53]]-Tumorsuppressor inaktiviert, als auch durch eine Mutation im Humanen Leukozyten-Antigen ([[Human Leukocyte Antigen|HLA]]) der Supergenfamilie auf [[Chromosom 6 (Mensch)|Chromosom 6]] zu Tumorzellen entartet. |
'''HeLa-Zellen''' (HeLa-Linie; HeLa-Zellstamm) sind menschliche [[Epithel]]zellen eines [[Zervixkarzinom]]s ([[Gebärmutterhalskrebs]]) und die ersten menschlichen Zellen, aus denen eine permanente [[Zelllinie]] etabliert wurde. Die Zellen waren vom [[Humanes Papillomvirus|humanen Papillomvirus]] 18 (HPV18) befallen. Der Gendefekt konnte inzwischen aufgeklärt werden: Die Zellen waren sowohl durch ein virales Protein (Onkogen E6 oder E7), das den [[p53]]-Tumorsuppressor inaktiviert, als auch durch eine Mutation im Humanen Leukozyten-Antigen ([[Human Leukocyte Antigen|HLA]]) der Supergenfamilie auf [[Chromosom 6 (Mensch)|Chromosom 6]] zu Tumorzellen entartet. |
||
== |
== Ursprung der Zellen == |
||
Siehe auch: [[Henrietta Lacks]] |
|||
Die HeLa-Zellen wurden aus einer Gewebeprobe aus einem Cervixtumor der [[Afroamerikanisch|afroamerikanischen]] Patientin Henrietta Lacks, geborene Pleasant (* 1. August 1920 in Roanoke (Virginia), † 4. Oktober 1951 in Baltimore (Maryland))<ref>Rebecca Skloot: ''Die Unsterblichkeit der Henrietta Lacks.'' Goldmann Verlag, München 2013, S. 35 (ISBN 978-3-442-15750-1)</ref> (fälschlicherweise auch als Henrietta Lakes, Helen Lane oder Helen Larson benannt) etabliert. Nach dem Tod ihrer Mutter war Henrietta Lacks in ärmlichen Verhältnissen bei ihrem Großvater auf einer Tabakplantage in Clover (Virginia) aufgewachsen. Sie hatte 1941 ihren Cousin David Lacks geheiratet, mit dem sie später nach Maryland zog, wo dieser auf der Sparrow Point Schifswerft arbeitete. |
|||
Am 9. Februar 1951 entfernte Howard Jones, damals gynäkologischer Assistenzarzt, bei der Patientin '''He'''nrietta '''La'''cks (vom Krankenhaus zur Anonymisierung '''He'''len '''La'''ne genannt, daher der Name), einer 30-jährigen [[Afroamerikanisch|afroamerikanischen]] Frau aus [[Baltimore]], in der Frauenklinik des [[Johns Hopkins Hospital]]s einige dieser [[Zelle (Biologie)|Zellen]] aus einem [[Karzinom]] am [[Muttermund]], um sie auf ihre [[Dignität (Medizin)|Malignität]] zu untersuchen. Die Patientin verstarb acht Monate später am 4. Oktober 1951 an ihrer Tumorerkrankung. |
|||
Nach der Geburt ihres fünften Kindes litt Henrietta Lacks an starken unregelmäßigen Unterleibsblutungen. Ihr Hausarzt überwies sie zur Untersuchung an das Johns Hopkins Hospital in Baltimore. Johns Hopkins war in den 1950er-Jahren das einzige Krankenhaus in der weiteren Umgebung, das Schwarze behandelte.<ref>D. Keiger: [http://archive.magazine.jhu.edu/2010/06/immortal-cells-enduring-issues/ ''Immortal Cells, Enduring Issues.''] In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014 </ref> Im Johns Hopkins Hospital stellte der Gynäkologe Howard W. Jones ein 2 - 3 cm großes Geschwulst an ihrem Gebährmutterhals fest.<ref>B. P. Lucey:''Henrietta Lacks, HeLa Cells, and Cell Culture Contamination.'' In: Arch Pathol Lab Med. Vol. 133, September 2009, S. 1463 - 1467 </ref> Weder bei der nur 4 1/2 Monate zurückliegenden Geburt ihres jüngsten Sohn noch bei der gynäkologischen Untersuchungen sechs Wochen nach der Geburt waren den Ärzten pathologische Veränderungen an der Zervix aufgefallen. |
|||
Ein Teil der Zellen aus der Biopsie wurde an George Otto Gey geschickt, den damaligen Leiter des Zellkulturlabors am Johns Hopkins Hospital. Die Zellen ließen sich kultivieren und vermehrten sich in Zellkultur so gut, dass sie seitdem vielfach in der Forschung eingesetzt werden. Die HeLa-Zellen wurden u. a. bei der Etablierung des ersten Impfstoffes gegen [[Kinderlähmung]] durch [[Jonas Salk]] verwendet. Auch die Aufklärung der Funktion der [[Polymerase]]-Enzyme gelang an HeLa-Zellen. |
|||
Jones entnahm ein Gewebeprobe des Tumors, bei deren pathohistologischer Untersuchung ein Plattenepithelkarzinom der Zervix diagnostiziert wurde, wobei der Tumor später als ein Adenokarzinom identifiziert wurde.<ref>[http://www.dsmz.de/catalogues/details/culture/ACC-57.html?tx_dsmzresources_pi5 Eintrag zu HeLa-Zellen] auf der Homepage des [[Deutsche Sammlung von Mikroorganismen und Zellkulturen|DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH]]</ref> |
|||
HeLa-Zellen wurden inzwischen in vielen Labors der Welt so häufig vermehrt, dass ihre Gesamtmasse die Körpermasse von Henrietta Lacks um mehr als das Hundertfache übertrifft. HeLa-Zellen fanden Verwendung bei Arbeiten, die zu mehr als 75.000 wissenschaftlichen Publikationen und zu mehr als 11.000 Patenten führten. Die Kulturzellen wurden später auch vermarktet und der Erlös aus dem weltweiten Verkauf von HeLa-Zellen legt nahe, dass Henrietta Lacks wahrscheinlich das „wertvollste“ menschliche Individuum war, das bisher gelebt hat.<ref>Terry Sharrer: ''HeLa Herself.'' In ''The Scientist'' Band 20, Nummer 7, Juli 2006, S. 22.</ref> Allerdings hat weder sie noch ihre Familie von dieser Nutzung profitiert, da sie entsprechend den damaligen Gepflogenheiten über die Weiterverwendung ihrer Zellen weder befragt worden war noch zugestimmt hatte. |
|||
Henrietta Lacks wurde mit internen und externen Bestrahlungen therapiert. Am 9. Februar 1951 entnahm Jones während einer dieser Bestrahlungssitzungen weitere Gewebeproben aus dem Gebärmutterhals.<ref>D. Keiger: [http://archive.magazine.jhu.edu/2010/06/immortal-cells-enduring-issues/ ''Immortal Cells, Enduring Issues.''] In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014 </ref> Diese Proben gab er an Dr. George Otto Gey weiter, der am Johns Hopkins Hospital daran arbeitete, eine potentiell unsterbliche Zellinie zu erschaffen. Aus diesen Zellen entstand schließlich die potentiell unsterbliche HeLa-Zelllinie. |
|||
Erst 1971 wurde die Anonymität aufgehoben und der Name der Patientin veröffentlicht und erst 1973 erfuhren die Kinder von Henrietta Lacks von der weltweiten Nutzung der Zellkulturen durch Anrufe von Wissenschaftlern, die einen Genabgleich zwischen den Kulturzellen und dem Genom der Kinder durchführen wollten. Abgesehen von einer ehrenvollen Anerkennung und posthumen Ehrung der Patientin gab es aber keine finanzielle Kompensation. Die Entnahme und wissenschaftliche Weiterverwendung von Proben war damals auch ohne Zustimmung oder Information rechtens.<ref>Jean-Michel Debry: ''Cellules HeLa: l'autre visage d'un extraordinaire histoire biomédicale'' Le Journal du Médecin (Belgique), No. 2334 vom 4. Oktober 2013, Seite 28.</ref> |
|||
Am 8. August 1951 stellte sich Henrietta Lacks wieder im John Hopkins Hospital vor. Ihr Gesundheitszustand hatte sich deutlich verschlechtert und sie litt unter starken Schmerzen, weshalb die Ärzte entschieden, die stationär zu behandeln. Sie verstarb am 4. Oktober 1951 im Alter von 31 Jahren an akutem Nierenversagen mit Urämie. Zwischen der Diagnose und dem Tod lagen nur acht Monate. |
|||
Um die Abweichungen und Defekte der HeLa-Zellen genauer bestimmen zu können, wurde die Kyoto-Linie im März 2013 von einer Forschungsgruppe des [[European Molecular Biology Laboratory]] in Heidelberg und des Instituts für Humangenetik der [[Ruprecht-Karls-Universität Heidelberg|Universität Heidelberg]] [[Gensequenzierung|sequenziert]].<ref>Jonathan J. M. Landry et al: ''The Genomic and Transcriptomic Landscape of a HeLa Cell Line''. In: G3, 1. August 2013, Bd. 3 Nr. 8, S. 1213-1224, {{Doi|10.1534/g3.113.005777}}</ref> |
|||
<ref>Ewen Callaway: ''Most popular human cell in science gets sequenced''. In: ''Nature News'', 15. März 2013, {{Doi|10.1038/nature.2013.12609}}</ref> |
|||
Henrietta Lacks Körper wurde nach ihrem Tod obduziert, wobei die Ärzte feststellten, dass der Krebs bereits im gesamten Körper Metastasen gebildet hatten.<ref>D. Keiger: [http://archive.magazine.jhu.edu/2010/06/immortal-cells-enduring-issues/ ''Immortal Cells, Enduring Issues.''] In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014 </ref> |
|||
In der Folge kam es zu einer Diskussion in Hinblick auf die ethischen Implikationen der Nutzung der [[Genom]]daten, an der sich auch die Nachkommen von Henrietta Lacks beteiligten. |
|||
Im August 2013 wurde von [[Francis Collins]], dem Direktor der US-amerikanischen [[National Institutes of Health]], bekanntgegeben, dass man sich auf ein Verfahren geeinigt habe, bei dem die Weitergabe und Nutzung der Genomdaten durch ein Gremium kontrolliert wird, in dem auch die Nachkommen von Henrietta Lacks repräsentiert sind.<ref>[http://www.spiegel.de/wissenschaft/medizin/hela-regeln-zum-umgang-mit-erbgut-der-zellen-erstellt-a-915580.html "HeLa"-Zelllinie: Forscher beschließen Regeln für historische Krebszellen], [[Spiegel Online]], 8. August 2013</ref> |
|||
== Etablierung der HeLa-Zellen == |
|||
[[Datei:HeLa-II.jpg|mini|HeLa-II]] |
|||
Eine aus Henrietta Lacks Tumor entnommene Gewebeprobe wurde an den Wissenschaftler George Otto Gey übergeben. Der Krebsforscher Grey arbeitete zusammen mit seiner Frau Margaret am Johns Hopkins Hospital bereits seit fast 30 Jahren daran, eine potentiell unsterbliche menschliche Zelllinie zu etablieren, um daran Erkenntnisse zum Wachstumsverhalten von entarteten Zellen studieren zu können.<ref>R. Skoolt: [http://www.pittmag.pitt.edu/mar2001/culture.html ''An Obsession on Culture.''] In: Pitt Magazin. März 2001, abgerufen am 27.12.2014</ref> Bis zu diesem Zeitpunkt war es Wissenschaftlern zwar gelungen, permanente Zelllinien von tierischen Zellen zu erzeugen, alle bis zu dem Zeitpunkt kultivieren humanen Zellen stellten aber nach maximal 30 bis 50 Teilungen das Wachstum ein und starben ab. |
|||
Grey isolierte einzelne Zellen aus dem Tumorgewebe und brachte sie in Kultur. Unter ihnen war eine Zelle, deren Wachstums- udn Teilungverhalten sich von dem der anderen Zelen unterschied. Sie teilte sich mit besonders hoher Geschwindigkeit und starb selbst nach einer großen Anzahl duchgemachter Zellteilungen nicht ab. Grey erkannte, dass diese Zelllinie potentiell unsterblich war, vermehrte sie und etablierte so eine humane Zellinie, die er zur Anonymisierung nach den Namensinitialen der Spenderin Henrietta Lacks ''HeLa'' nannte. Später wurde der Name der Zellline fälschlicherweise auf die Namen ''Henrietta Lakes'', ''Helen Lane'' und ''Helen Larson''. |
|||
Der Immunologe [[Jonas Salk]] hatte Anfang des Jahres 1952 den ersten Impfstoff gegen [[Kinderlähmung|Kinderlähmung (Poliomyelitis)]] entwickelt. Gey und seine Kollegen am Johns Hopkins Hospital stellten fest, dass die HeLa-Zellen sich mit dem Polio-Virus infizieren liessen und sehr viel sensibler gegenüber einer Infektion mit dem [[Poliovirus]] waren, als die bis dahin für die Impfstofftestung verwendeten Primaten-Zellen. Da von dieser Entdeckung an für die Testung von Polio-Impfstoffen HeLa-Zellen in großem Umfang benötigt wurden, gründete die [[National Foundation for Infantile Paralysis]] 1952 eine am [[Tuskegee Institute]] angesiedelte Abteilung für die Massenproduktion von HeLa-Zellen.<ref> R. W. Brown, J. H. Henderson: ''The mass production and distribution of HeLa cells at Tuskegee Institute, 1953-55.'' In: Journal of the History of Medicine and Allied Sciences. 38 (4), 1983, S. 415 - 431. </ref> Das Institut verband damit keine kommerziellen Interessen und stellte die Zellen Laboren und Wissenschaftlern zur Verfügung. Auch George Otto Gey verbreitete die Zellen durch großzügige Weitergabe unter Wissenschaftlern.<ref>R. Skoolt: [http://www.pittmag.pitt.edu/mar2001/culture.html ''An Obsession on Culture.''] In: Pitt Magazin. März 2001, abgerufen am 27.12.2014</ref> |
|||
Später war die Firma Microbiological Associates die erste Unternehmen, das HeLa-Zellen kommerziell produzierte und vermarktete.<ref>E. Brown: [http://www.washingtonpost.com/wp-dyn/content/article/2011/03/07/AR2011030704100.html ''Monroe M. 'Monty' Vincent, early leader in cell-production industry, dies at 98.''] In: Washington Post 7. März 2011, abgerufen am 28. Dezember 2014</ref> |
|||
Es wird geschätzt, dass Wissenschaftler bisher ca. 20 Tonnen HeLa-Zellen gezüchtet haben. |
|||
==Forschung mit HeLa-Zellen== |
|||
[[Datei:HeLa-IV.jpg|mini|Elektronenmikroskopische Aufnahme einer apoptotischen HeLa-Zelle]] |
|||
Auf wissenschaftlichen Erkenntnissen aus Experimenten mit HeLa-Zellen basieren weltweit ca. 11.000 angemeldete Patente. In der medizinisch-naturwissenschatlichen Datenbank [[PubMed]] sind mehr als 75.000 wissenschaftliche Artikel registriert, die auf Experimenten mit HeLa-Zellen beruhen.<ref>E. Callaway: ''[http://www.nature.com/news/deal-done-over-hela-cell-line-1.13511 Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data].'' In: Nature, Vol. 500, 8. August 2013, S. 132 -133</ref> Es wird geschätzt, dass Wissenschaftler bisher ca. 50 Tonnen HeLa-Zellen gezüchtet haben.(Stand: 2010)<ref>Lisa Margonelli: ''[http://www.nytimes.com/2010/02/07/books/review/Margonelli-t.html?pagewanted=all&_r=0 Eternal Life.]'' In: The New York Times. 5. Februar 2010, abgerufen am 27. Juni 2015</ref> |
|||
Neben der Testung des Polio-Impfstoffes wurden HeLa-Zellen bald für zahlreiche verschiedene Zellkulturexperimente in der naturwissenschaftlichen Forschung eingesetzt. Der Bedarf an HeLa-zellen stieg schnell an. Nachdem sie in Massenfertigung hergestellt wurden, wurden sie in die ganze Welt verschickt. Im Jahr 1955 waren HeLa-Zellen die ersten humanen Zellen, die erfolgreich geklont wurden. Sie wurden zur Erforschung von Krebs, AIDS, die Auswirkungen von radioaktiver Strahlung und toxischen Substanzen, die die Genkartierung und andere wissenschaftliche eingesetzt. HeLa-Zellen werden verwendet, um die menschliche Empfindlichkeit gegen Pflaster, Klebstoff, Kosmetik und viele andere Produkte zu testen. Auch die Aufklärung der Funktion der [[Polymerase]]-Enzyme gelang an HeLa-Zellen. |
|||
Bisher wurden vier Nobelpreise für Forschungsarbeiten verliehen, bei denen HeLa-Zellen eingesetzt wurden: |
|||
* Nobelpreis für Physiologie oder Medizin 2008 an [[Richard Axel]] und [[Linda B. Buck]] „für die Erforschung der Riechrezeptoren und der Organisation des olfaktorischen Systems“ |
|||
* Nobelpreis für Physiologie oder Medizin 2008 an [[Harald zur Hausen]] „für seine Entdeckung der Auslösung von Gebärmutterhalskrebs durch humane Papillomviren“ |
|||
* Nobelpreis für Physiologie oder Medizin 2009 an [[Elizabeth Blackburn]], [[Carol W. Greider]] und [[Jack Szostak]] für die Entdeckung, „wie [[Chromosomen]] durch [[Telomere]] und das Enzym [[Telomerase]] geschützt werden“ |
|||
* Nobelpreisträger für Chemie 2014 an [[Eric Betzig]], [[Stefan Hell]] und [[William Moerner]] für die „für die Entwicklung von superauflösender Fluoreszenzmikroskopie“ ([[Photoactivated Localization Microscopy]], [[STED-Mikroskop]]) |
|||
==Verunreinigung von Zellkulturen durch HeLa-Zellen== |
|||
Im Jahr 1966 stellte der Wissenschaftler [[Stanley Michael Gartler]] fest, dass HeLa-Zellen offenbar weltweit zahlreiche Zellkulturansätze mit humanen kontaminiert hatten.<ref>S. M. Gartler: ''Apparent Hela cell contamination of human heteroploid cell lines.'' In: Nature. 24. Februar 1968 (5130), S. 750 - 751. PMID:5641128</ref> Aufgrund der hohen Teilungsrate und der dadurch bedingten hohen Vermehrungsrate kann eine einzige HeLa-Zelle, die als Verunreinigung in eine bestehende Zellkultur eingebracht wird, die bestehende Kultur überwachsen. In den 1960er-Jahren hatten Wissenschaftler nur sehr eingeschränkte Möglichkeiten, die Kontamination einer Zellkulturansatzes mit Zellen der gleichen Spezies zu erkannen, da es noch keine genetischen Analysemethoden gab. Gartler hatte mittels Elektrophorese ein spezifisches Enzymmuster der jeweiligen Zelllinien bestimmt und konnte nachweisen, dass dieses bei vielen der von ihm untersuchten Zellinien identisch war und gleichzeitig eindeutig dem einer schwarzen Spenderperson zugeordnet werden konnte, obwohl viele der unersuchten Zelllinien angeblich von weißen Spendern abstammen sollten. |
|||
Gartlers Feststellung wurde im Nachhinein oft als die HeLa-Bombe bezeichnet,<ref>A. del Carpio: [http://berkeleysciencereview.com/article/good-bad-hela/ ''The good, the bad, and the HeLa - Perspectives on the world’s oldest cell line.''] In: Berkley Science Review. 27. April 2014, abgerufen am 28. Dezember 2014</ref> da damit zahlreiche der innerhalb von eineinhalb Jahrzehnten an Zellkulturlinien erarbeiteten wissenschaftliche Kenntnisse in Frage gestellt wurden, da im Nachhinein nicht mehr festgestellt werden konnte, ob Experimente jeweils tatsächlich an humanen Zellen spezifischer Organe oder aber an den von Krebszellen abstammenden HeLa-Zellen durchgeführt worden waren. |
|||
==Juristische und ethische Kontroverse== |
|||
Weder Henrietta Lacks noch ihre Familie hatten ihrem Arzt die Erlaubnis zur Entnahme der Zellen erteilt. Zu der Zeit der zellentnahme war die Einverständnis des Patienten weder zwingend notwendig noch war es üblich, diese einzuholen. Die Angehörigen und Nachkommen von Henrietta Lacks wussten über mehrere Jahrzehnte nicht, dass aus den entnommenen Tumorzellen die HeLa-Zellen kultiviert worden waren und diese weltweit wissenschaftlich genutzt und kommerziell vermarktet wurden.<ref>H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148</ref> Das Johns Hopkins Hospital war in den 1950er Jahren eines der wenigen Krankenhäuser in der Gegend, das überhaupt scharze Patienten behandelte. Die medizinische Versorgug wurde kostenlos gewärt, war aber mit der stillschweigenden Einverständnis zur Teilnahme an wissenschaftlichen Studien verbunden.<ref>J. L. Stump:Henrietta Lacks and The HeLa Cell: Rights of Patients and Responsibilities of Medical Researchers. In: The History Teacher. Vol. 48 (1) 2014, S. 127 - 180</ref> |
|||
Nachdem die Kontamination zahlreicher Zellkulturlinien durch HeLa-Zellen bekannt geworden waren, kontaktierten Wissenschaftler David Lacks, den Witwer Henrietta, um von ihm und weiteren Angehörigen Blutproben zu nehmen.<ref>E. Callaway: Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data. In:Nature, Vol. 500, 8. August 2013, S. 132 -133</ref> Sie erhofften sich, über die Analyse der DNA der Angehörigen eine genetische Karte der HeLa-Zellen erstellen zu können, um so Marker zu finden, mit denen HeLa-Zellen eindeutig identifiziert werden konnten. Die Angehörigen erfuhren erst dadurch davon, dass Zellen von Henrietta Lacks lebten und weltweit in Laboren für Experimente eingesetzt wurdem.<ref>S. Zielinski: [http://www.smithsonianmag.com/science-nature/henrietta-lacks-immortal-cells-6421299/?fb_locale=es_LA&page=1 Henrietta Lacks’ 'Immortal' Cells.] Smithonian.com, 22. Januar 2010. abgerufen am 28. Dezember 2014</ref> Auf die Bitte um eine Erklärung, wurde der Familie ein Lehrbuch über Zellbiologie mit dem Hinweis, die Erklärung befinde sich in diesem Buch, überreicht. Da kein Familienangehöriger über medizinisches Grundwissen verfügte, konnte die Familie aus dem Buch keine Informationen gewinnen.<ref>E. Callaway: Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data. In:Nature, Vol. 500, 8. August 2013, S. 132 -133</ref> Nährer Informationen über die Zellen erhielt die Familie erst, erst durch den Reporter Michael Gold, der die Familie bei der Recherche an eine Artikel über HeLa-Zellen für das Rolling Stone-Magazin kontaktierte.<ref>R. E. Kisner , E. F. Granton: "Family Talks About Dead Mother Whose Cells Fight Cancer.''' In: Jet Magazine, 1 April 1976, S. 16-18, 53</ref> |
|||
Bei ihren Nachforschungen erfuhr die Familie, dass mit der weltweiten Vermarktung der HeLa-Zellen jedes Jahr einen Umsatz von mehreren Millionen US-Doller erzielt wurde, während Henrietta Lacks Nachkommen weiterhin in Armut lebten und sich zum Teil nicht einmal die Beiträge für eine Krankenversicherung leisten konnten. |
|||
In den 1980er- und 1990er-Jahren wurden Auszüge aus der Patientenakte von Henrietta Lacks und von Angehörigen der Familie ohne deren Einverständnis veröffentlicht.<ref>H. W. Jones: ''Record of the first physician to see Henrietta Lacks at the Johns Hopkins Hospital: history of the beginning of the HeLa cell line.'' In: Am J Obstet Gynecol. (176) 1997, S. 227 – 228</ref> Ein ähnlicher Fall wurde vor dem Supreme Court of California verhandelt: im Fall Moore gegen die University of California entschiet das Gericht am 9. Juli 1990, dass das einer Person entfernte Gewebe oder Zellen nicht deren Eigentum sei und deshalb kommerziell verwertet werden darf. |
|||
Im Jahr 2013 wurde das [[Genom]] eines Stammes der HeLa-Zellen durch Wissenschaftler des [[European Molecular Biology Laboratory]] vollständig [[DNA-Sequenzierung|sequenziert]] <ref>J. Landry et al.: The Genomic and Transcriptomic Landscape of a HeLa Cell Line. In: 3G Genes Genomes Genetics. Volume 3, August 2013, S. 1213 - 1224; doi: 10.1534/g3.113.005777</ref> Der üblichen Vorgehensweise entsprechend, wurde die gesamte Gebomsequenz in den frei zugänglichen Datenbanken des [[European Bioinformatics Institute]] sowie des [[National Center for Biotechnology Information|National Center for Biotechnology Information (NCBI)]] veröffentlicht, um sie anderen Wissenschaftlern für deren Forschungsarbeiten zur Verfügung zu stellen. |
|||
Die Veröffentlichung löste eine weltweite Debatte unter Wissenschaftlern und Bioethikern aus, da die veröffentlichte DNA-Sequenz Rückschlüsse auf die genetische Information lebender und der Öffentlichkeit bekannte Nachfahren von Henrietta Lacks zuläßt.<ref>H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148</ref> Obwohl die Wissenschaftler nicht gegen die gültige Rechtsgebung verstoßen hatten wurde diese Vorgehen international stark kritisiert.<ref>R. Skloot: [http://www.nytimes.com/2013/03/24/opinion/sunday/the-immortal-life-of-henrietta-lacks-the-sequel.html?pagewanted=all&_r=0 The Immortal Life of Henrietta Lacks, the Sequel.] In: The New Yorck Times, 23. März 2013, abgerufen am 30. Dezember 2014</ref> |
|||
Lars Steinmetz, der Leiter der Forschungsgruppe, die das Genom sequenziert hatte, ließ die im Internet veröffentlichte DNA-Sequenz löschen und nahm über Rebecca Skloot, die Autorin der Biografie über Henrietta Lacks, Kontakt zur Familie Lacks auf, um sich zu entschuldigen. Er bot der Famnilie eine Zusammenarbeit an, um einen Weg zu finden, die wissenschaftlich bedeutende Information zu veröffentlichen und gleichzeitig die Privatsphäre der Familie Lacks zu respektieren.<ref>H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148</ref> |
|||
Am 7. August 2013 wurde schließlich eine Vereinbahrung zwischen der Familie Lacks und dem National Institutes of Health geschlossen, die der Familie einige Kontrollrechte über den Zugang zu dem DNA-Code der Zellen sowie die Erwähnung von Henrietta Lacks in wissenschaftlichen Veröffentlichungen zusicherte.<ref>K. L. Hudson, F. S. Collins: Biospecimen policy: Family matters. Nature 500, 8. August 2013, S. 141–142; doi:10.1038/500141a</ref> Zusätzlich erhielten zwei Familienmitglieder Sitze in dem sechsköpfigen Kommitee , das über den Zugang von Wissenschaftlern zu dem DNA-Code entscheidet. |
|||
[[Datei:Henrietta Lacks historical marker; Clover, VA; 2013-07-14.JPG|mini|Gedenktafel für Henrietta Lacks in Clover, Virginia]] |
|||
Nach dem Bekanntwerden der Identität der Spenderin der HeLa-Zelllienie wurden Henriette Lacks Jahrzehnte nach ihrem Tod zahlreiche Ehrungen zuteil. So veranstaltet das Johns Hopkin Hospital in Baltimore seit dem Jahr 2010 jährlich die ''Henrietta Lacks Memorial Lecture'', mit der Henrietta Lacks und der bedeutende Beitrag der Hela-Zellen für die biomedizinische Forschung geehrt werden sollen.<ref>M. Adams: [http://blogs.nursing.jhu.edu/first-annual-henrietta-lacks-memorial-lecture-at-johns-hopkins/ ''First Annual Henrietta Lacks Memorial Lecture at Johns Hopkins.''] veröffentlicht auf der Homepage des Johns Hopkins Hospital am 3. Oktober 2010, abgerufen am 25. Dezember 2014</ref> Fas Krankenhaus vergibt außerdem jährlich das mit 40.000 US-Dollar dotierte ''Henrietta Lacks East Baltimore Health Sciences''-Stipendium für einen Studenten der Paul Laurence Dunbar High School sowie den den mit 15.000 US-Dollar dotierten ''Henrietta Lacks Community Academic Partnership Award''.<ref>M. Adams: [http://blogs.nursing.jhu.edu/first-annual-henrietta-lacks-memorial-lecture-at-johns-hopkins/ ''First Annual Henrietta Lacks Memorial Lecture at Johns Hopkins.''] veröffentlicht auf der Homepage des Johns Hopkins Hospital am 3. Oktober 2010, abgerufen am 25. Dezember 2014</ref> Im Jahr 2014 erhielt Henrietta Lacks einen Platz in der Maryland Women's Hall of Fame. In der Würdigung wurde besonders hervorgehoben, dass durch Henrietta Lacks Geschichte die Bedeutung ethischen Handelns in in der modernen Wissenschaft aufgezeigt wird.<ref>[http://msa.maryland.gov/msa/educ/exhibits/womenshall/html/lacks.html Eintrag von Henrietta Lacks] auf der Homepage der Maryland Women's Hall of Fame, abgerufen am 27. Juni 2015</ref> |
|||
2011 gründete die Familie von Henrietta Lacks ''Lacks Family HeLa Foundation'', eine Stiftung zur finanziellen Unterstützung bedürftiger, an Krebs erkrankter Patienten.<ref>J. Franzos: An immortal legacy - Hopkins and the community reflect on contributions of Henrietta Lacks at second annual lecture. In: Inside Hopkins. News bulletin for employees throughout Johns Hopkins Medicine. 13. Oktober 2011</ref> |
|||
An ihrem führeren Wohnort Clover (Virgina) und an dem ehemaligen Wohnhaus der Familie Lacks in Maryland erinnern Gedenktafeln an Henrietta Lacks.<ref> M. Stefano, N. King: [http://www.citypaper.com/news/cityfolk/bcp-cms-1-1657015-migrated-story-cp-20140326-cityf-20140326,0,7775007.story ''Days of our lives.''] March 26, 2014, abgerufen am 27. Dezember 2014</ref> |
|||
== Literatur == |
== Literatur == |
||
| Zeile 23: | Zeile 80: | ||
== Weblinks == |
== Weblinks == |
||
{{Commons|HeLa cells}} |
|||
* Leonardo: [http://www.wdr5.de/fileadmin/user_upload/Sendungen/Leonardo/2008/08/Manuskripte/ms080827_-_SCHWERPUNKT_-_Henrietta_Lacks_-_Hardy_Tasso.pdf ''Die unsterbliche Henrietta Lacks - Zellen einer Toten retten Leben.''] (PDF-Datei; 103 kB) In: [[WDR 5]] vom 27. August 2008 |
* Leonardo: [http://www.wdr5.de/fileadmin/user_upload/Sendungen/Leonardo/2008/08/Manuskripte/ms080827_-_SCHWERPUNKT_-_Henrietta_Lacks_-_Hardy_Tasso.pdf ''Die unsterbliche Henrietta Lacks - Zellen einer Toten retten Leben.''] (PDF-Datei; 103 kB) In: [[WDR 5]] vom 27. August 2008 |
||
* [[ZeitZeichen (Hörfunksendung)|WDR Zeitzeichen]]: [http://www.podcast.de/episode/2805419/WDR_3WDR_5_ZeitZeichen%3A_4._Oktober_1951%3A_Der_Todestag_der_US-Amerikanerin_Henrietta_Lacks ''4. Oktober 1951: Der Todestag der US-Amerikanerin Henrietta Lacks''] In: WDR3/WDR5 vom 4. Oktober 2011 |
* [[ZeitZeichen (Hörfunksendung)|WDR Zeitzeichen]]: [http://www.podcast.de/episode/2805419/WDR_3WDR_5_ZeitZeichen%3A_4._Oktober_1951%3A_Der_Todestag_der_US-Amerikanerin_Henrietta_Lacks ''4. Oktober 1951: Der Todestag der US-Amerikanerin Henrietta Lacks''] In: WDR3/WDR5 vom 4. Oktober 2011 |
||
Version vom 27. Juni 2015, 17:43 Uhr

HeLa-Zellen (HeLa-Linie; HeLa-Zellstamm) sind menschliche Epithelzellen eines Zervixkarzinoms (Gebärmutterhalskrebs) und die ersten menschlichen Zellen, aus denen eine permanente Zelllinie etabliert wurde. Die Zellen waren vom humanen Papillomvirus 18 (HPV18) befallen. Der Gendefekt konnte inzwischen aufgeklärt werden: Die Zellen waren sowohl durch ein virales Protein (Onkogen E6 oder E7), das den p53-Tumorsuppressor inaktiviert, als auch durch eine Mutation im Humanen Leukozyten-Antigen (HLA) der Supergenfamilie auf Chromosom 6 zu Tumorzellen entartet.
Ursprung der Zellen
Siehe auch: Henrietta Lacks
Die HeLa-Zellen wurden aus einer Gewebeprobe aus einem Cervixtumor der afroamerikanischen Patientin Henrietta Lacks, geborene Pleasant (* 1. August 1920 in Roanoke (Virginia), † 4. Oktober 1951 in Baltimore (Maryland))[1] (fälschlicherweise auch als Henrietta Lakes, Helen Lane oder Helen Larson benannt) etabliert. Nach dem Tod ihrer Mutter war Henrietta Lacks in ärmlichen Verhältnissen bei ihrem Großvater auf einer Tabakplantage in Clover (Virginia) aufgewachsen. Sie hatte 1941 ihren Cousin David Lacks geheiratet, mit dem sie später nach Maryland zog, wo dieser auf der Sparrow Point Schifswerft arbeitete.
Nach der Geburt ihres fünften Kindes litt Henrietta Lacks an starken unregelmäßigen Unterleibsblutungen. Ihr Hausarzt überwies sie zur Untersuchung an das Johns Hopkins Hospital in Baltimore. Johns Hopkins war in den 1950er-Jahren das einzige Krankenhaus in der weiteren Umgebung, das Schwarze behandelte.[2] Im Johns Hopkins Hospital stellte der Gynäkologe Howard W. Jones ein 2 - 3 cm großes Geschwulst an ihrem Gebährmutterhals fest.[3] Weder bei der nur 4 1/2 Monate zurückliegenden Geburt ihres jüngsten Sohn noch bei der gynäkologischen Untersuchungen sechs Wochen nach der Geburt waren den Ärzten pathologische Veränderungen an der Zervix aufgefallen.
Jones entnahm ein Gewebeprobe des Tumors, bei deren pathohistologischer Untersuchung ein Plattenepithelkarzinom der Zervix diagnostiziert wurde, wobei der Tumor später als ein Adenokarzinom identifiziert wurde.[4]
Henrietta Lacks wurde mit internen und externen Bestrahlungen therapiert. Am 9. Februar 1951 entnahm Jones während einer dieser Bestrahlungssitzungen weitere Gewebeproben aus dem Gebärmutterhals.[5] Diese Proben gab er an Dr. George Otto Gey weiter, der am Johns Hopkins Hospital daran arbeitete, eine potentiell unsterbliche Zellinie zu erschaffen. Aus diesen Zellen entstand schließlich die potentiell unsterbliche HeLa-Zelllinie.
Am 8. August 1951 stellte sich Henrietta Lacks wieder im John Hopkins Hospital vor. Ihr Gesundheitszustand hatte sich deutlich verschlechtert und sie litt unter starken Schmerzen, weshalb die Ärzte entschieden, die stationär zu behandeln. Sie verstarb am 4. Oktober 1951 im Alter von 31 Jahren an akutem Nierenversagen mit Urämie. Zwischen der Diagnose und dem Tod lagen nur acht Monate.
Henrietta Lacks Körper wurde nach ihrem Tod obduziert, wobei die Ärzte feststellten, dass der Krebs bereits im gesamten Körper Metastasen gebildet hatten.[6]
Etablierung der HeLa-Zellen
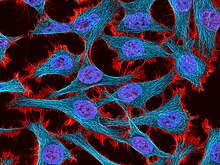
Eine aus Henrietta Lacks Tumor entnommene Gewebeprobe wurde an den Wissenschaftler George Otto Gey übergeben. Der Krebsforscher Grey arbeitete zusammen mit seiner Frau Margaret am Johns Hopkins Hospital bereits seit fast 30 Jahren daran, eine potentiell unsterbliche menschliche Zelllinie zu etablieren, um daran Erkenntnisse zum Wachstumsverhalten von entarteten Zellen studieren zu können.[7] Bis zu diesem Zeitpunkt war es Wissenschaftlern zwar gelungen, permanente Zelllinien von tierischen Zellen zu erzeugen, alle bis zu dem Zeitpunkt kultivieren humanen Zellen stellten aber nach maximal 30 bis 50 Teilungen das Wachstum ein und starben ab.
Grey isolierte einzelne Zellen aus dem Tumorgewebe und brachte sie in Kultur. Unter ihnen war eine Zelle, deren Wachstums- udn Teilungverhalten sich von dem der anderen Zelen unterschied. Sie teilte sich mit besonders hoher Geschwindigkeit und starb selbst nach einer großen Anzahl duchgemachter Zellteilungen nicht ab. Grey erkannte, dass diese Zelllinie potentiell unsterblich war, vermehrte sie und etablierte so eine humane Zellinie, die er zur Anonymisierung nach den Namensinitialen der Spenderin Henrietta Lacks HeLa nannte. Später wurde der Name der Zellline fälschlicherweise auf die Namen Henrietta Lakes, Helen Lane und Helen Larson.
Der Immunologe Jonas Salk hatte Anfang des Jahres 1952 den ersten Impfstoff gegen Kinderlähmung (Poliomyelitis) entwickelt. Gey und seine Kollegen am Johns Hopkins Hospital stellten fest, dass die HeLa-Zellen sich mit dem Polio-Virus infizieren liessen und sehr viel sensibler gegenüber einer Infektion mit dem Poliovirus waren, als die bis dahin für die Impfstofftestung verwendeten Primaten-Zellen. Da von dieser Entdeckung an für die Testung von Polio-Impfstoffen HeLa-Zellen in großem Umfang benötigt wurden, gründete die National Foundation for Infantile Paralysis 1952 eine am Tuskegee Institute angesiedelte Abteilung für die Massenproduktion von HeLa-Zellen.[8] Das Institut verband damit keine kommerziellen Interessen und stellte die Zellen Laboren und Wissenschaftlern zur Verfügung. Auch George Otto Gey verbreitete die Zellen durch großzügige Weitergabe unter Wissenschaftlern.[9]
Später war die Firma Microbiological Associates die erste Unternehmen, das HeLa-Zellen kommerziell produzierte und vermarktete.[10]
Es wird geschätzt, dass Wissenschaftler bisher ca. 20 Tonnen HeLa-Zellen gezüchtet haben.
Forschung mit HeLa-Zellen
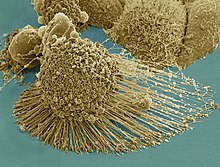
Auf wissenschaftlichen Erkenntnissen aus Experimenten mit HeLa-Zellen basieren weltweit ca. 11.000 angemeldete Patente. In der medizinisch-naturwissenschatlichen Datenbank PubMed sind mehr als 75.000 wissenschaftliche Artikel registriert, die auf Experimenten mit HeLa-Zellen beruhen.[11] Es wird geschätzt, dass Wissenschaftler bisher ca. 50 Tonnen HeLa-Zellen gezüchtet haben.(Stand: 2010)[12]
Neben der Testung des Polio-Impfstoffes wurden HeLa-Zellen bald für zahlreiche verschiedene Zellkulturexperimente in der naturwissenschaftlichen Forschung eingesetzt. Der Bedarf an HeLa-zellen stieg schnell an. Nachdem sie in Massenfertigung hergestellt wurden, wurden sie in die ganze Welt verschickt. Im Jahr 1955 waren HeLa-Zellen die ersten humanen Zellen, die erfolgreich geklont wurden. Sie wurden zur Erforschung von Krebs, AIDS, die Auswirkungen von radioaktiver Strahlung und toxischen Substanzen, die die Genkartierung und andere wissenschaftliche eingesetzt. HeLa-Zellen werden verwendet, um die menschliche Empfindlichkeit gegen Pflaster, Klebstoff, Kosmetik und viele andere Produkte zu testen. Auch die Aufklärung der Funktion der Polymerase-Enzyme gelang an HeLa-Zellen.
Bisher wurden vier Nobelpreise für Forschungsarbeiten verliehen, bei denen HeLa-Zellen eingesetzt wurden:
- Nobelpreis für Physiologie oder Medizin 2008 an Richard Axel und Linda B. Buck „für die Erforschung der Riechrezeptoren und der Organisation des olfaktorischen Systems“
- Nobelpreis für Physiologie oder Medizin 2008 an Harald zur Hausen „für seine Entdeckung der Auslösung von Gebärmutterhalskrebs durch humane Papillomviren“
- Nobelpreis für Physiologie oder Medizin 2009 an Elizabeth Blackburn, Carol W. Greider und Jack Szostak für die Entdeckung, „wie Chromosomen durch Telomere und das Enzym Telomerase geschützt werden“
- Nobelpreisträger für Chemie 2014 an Eric Betzig, Stefan Hell und William Moerner für die „für die Entwicklung von superauflösender Fluoreszenzmikroskopie“ (Photoactivated Localization Microscopy, STED-Mikroskop)
Verunreinigung von Zellkulturen durch HeLa-Zellen
Im Jahr 1966 stellte der Wissenschaftler Stanley Michael Gartler fest, dass HeLa-Zellen offenbar weltweit zahlreiche Zellkulturansätze mit humanen kontaminiert hatten.[13] Aufgrund der hohen Teilungsrate und der dadurch bedingten hohen Vermehrungsrate kann eine einzige HeLa-Zelle, die als Verunreinigung in eine bestehende Zellkultur eingebracht wird, die bestehende Kultur überwachsen. In den 1960er-Jahren hatten Wissenschaftler nur sehr eingeschränkte Möglichkeiten, die Kontamination einer Zellkulturansatzes mit Zellen der gleichen Spezies zu erkannen, da es noch keine genetischen Analysemethoden gab. Gartler hatte mittels Elektrophorese ein spezifisches Enzymmuster der jeweiligen Zelllinien bestimmt und konnte nachweisen, dass dieses bei vielen der von ihm untersuchten Zellinien identisch war und gleichzeitig eindeutig dem einer schwarzen Spenderperson zugeordnet werden konnte, obwohl viele der unersuchten Zelllinien angeblich von weißen Spendern abstammen sollten.
Gartlers Feststellung wurde im Nachhinein oft als die HeLa-Bombe bezeichnet,[14] da damit zahlreiche der innerhalb von eineinhalb Jahrzehnten an Zellkulturlinien erarbeiteten wissenschaftliche Kenntnisse in Frage gestellt wurden, da im Nachhinein nicht mehr festgestellt werden konnte, ob Experimente jeweils tatsächlich an humanen Zellen spezifischer Organe oder aber an den von Krebszellen abstammenden HeLa-Zellen durchgeführt worden waren.
Juristische und ethische Kontroverse
Weder Henrietta Lacks noch ihre Familie hatten ihrem Arzt die Erlaubnis zur Entnahme der Zellen erteilt. Zu der Zeit der zellentnahme war die Einverständnis des Patienten weder zwingend notwendig noch war es üblich, diese einzuholen. Die Angehörigen und Nachkommen von Henrietta Lacks wussten über mehrere Jahrzehnte nicht, dass aus den entnommenen Tumorzellen die HeLa-Zellen kultiviert worden waren und diese weltweit wissenschaftlich genutzt und kommerziell vermarktet wurden.[15] Das Johns Hopkins Hospital war in den 1950er Jahren eines der wenigen Krankenhäuser in der Gegend, das überhaupt scharze Patienten behandelte. Die medizinische Versorgug wurde kostenlos gewärt, war aber mit der stillschweigenden Einverständnis zur Teilnahme an wissenschaftlichen Studien verbunden.[16]
Nachdem die Kontamination zahlreicher Zellkulturlinien durch HeLa-Zellen bekannt geworden waren, kontaktierten Wissenschaftler David Lacks, den Witwer Henrietta, um von ihm und weiteren Angehörigen Blutproben zu nehmen.[17] Sie erhofften sich, über die Analyse der DNA der Angehörigen eine genetische Karte der HeLa-Zellen erstellen zu können, um so Marker zu finden, mit denen HeLa-Zellen eindeutig identifiziert werden konnten. Die Angehörigen erfuhren erst dadurch davon, dass Zellen von Henrietta Lacks lebten und weltweit in Laboren für Experimente eingesetzt wurdem.[18] Auf die Bitte um eine Erklärung, wurde der Familie ein Lehrbuch über Zellbiologie mit dem Hinweis, die Erklärung befinde sich in diesem Buch, überreicht. Da kein Familienangehöriger über medizinisches Grundwissen verfügte, konnte die Familie aus dem Buch keine Informationen gewinnen.[19] Nährer Informationen über die Zellen erhielt die Familie erst, erst durch den Reporter Michael Gold, der die Familie bei der Recherche an eine Artikel über HeLa-Zellen für das Rolling Stone-Magazin kontaktierte.[20]
Bei ihren Nachforschungen erfuhr die Familie, dass mit der weltweiten Vermarktung der HeLa-Zellen jedes Jahr einen Umsatz von mehreren Millionen US-Doller erzielt wurde, während Henrietta Lacks Nachkommen weiterhin in Armut lebten und sich zum Teil nicht einmal die Beiträge für eine Krankenversicherung leisten konnten.
In den 1980er- und 1990er-Jahren wurden Auszüge aus der Patientenakte von Henrietta Lacks und von Angehörigen der Familie ohne deren Einverständnis veröffentlicht.[21] Ein ähnlicher Fall wurde vor dem Supreme Court of California verhandelt: im Fall Moore gegen die University of California entschiet das Gericht am 9. Juli 1990, dass das einer Person entfernte Gewebe oder Zellen nicht deren Eigentum sei und deshalb kommerziell verwertet werden darf.
Im Jahr 2013 wurde das Genom eines Stammes der HeLa-Zellen durch Wissenschaftler des European Molecular Biology Laboratory vollständig sequenziert [22] Der üblichen Vorgehensweise entsprechend, wurde die gesamte Gebomsequenz in den frei zugänglichen Datenbanken des European Bioinformatics Institute sowie des National Center for Biotechnology Information (NCBI) veröffentlicht, um sie anderen Wissenschaftlern für deren Forschungsarbeiten zur Verfügung zu stellen.
Die Veröffentlichung löste eine weltweite Debatte unter Wissenschaftlern und Bioethikern aus, da die veröffentlichte DNA-Sequenz Rückschlüsse auf die genetische Information lebender und der Öffentlichkeit bekannte Nachfahren von Henrietta Lacks zuläßt.[23] Obwohl die Wissenschaftler nicht gegen die gültige Rechtsgebung verstoßen hatten wurde diese Vorgehen international stark kritisiert.[24]
Lars Steinmetz, der Leiter der Forschungsgruppe, die das Genom sequenziert hatte, ließ die im Internet veröffentlichte DNA-Sequenz löschen und nahm über Rebecca Skloot, die Autorin der Biografie über Henrietta Lacks, Kontakt zur Familie Lacks auf, um sich zu entschuldigen. Er bot der Famnilie eine Zusammenarbeit an, um einen Weg zu finden, die wissenschaftlich bedeutende Information zu veröffentlichen und gleichzeitig die Privatsphäre der Familie Lacks zu respektieren.[25]
Am 7. August 2013 wurde schließlich eine Vereinbahrung zwischen der Familie Lacks und dem National Institutes of Health geschlossen, die der Familie einige Kontrollrechte über den Zugang zu dem DNA-Code der Zellen sowie die Erwähnung von Henrietta Lacks in wissenschaftlichen Veröffentlichungen zusicherte.[26] Zusätzlich erhielten zwei Familienmitglieder Sitze in dem sechsköpfigen Kommitee , das über den Zugang von Wissenschaftlern zu dem DNA-Code entscheidet.

Nach dem Bekanntwerden der Identität der Spenderin der HeLa-Zelllienie wurden Henriette Lacks Jahrzehnte nach ihrem Tod zahlreiche Ehrungen zuteil. So veranstaltet das Johns Hopkin Hospital in Baltimore seit dem Jahr 2010 jährlich die Henrietta Lacks Memorial Lecture, mit der Henrietta Lacks und der bedeutende Beitrag der Hela-Zellen für die biomedizinische Forschung geehrt werden sollen.[27] Fas Krankenhaus vergibt außerdem jährlich das mit 40.000 US-Dollar dotierte Henrietta Lacks East Baltimore Health Sciences-Stipendium für einen Studenten der Paul Laurence Dunbar High School sowie den den mit 15.000 US-Dollar dotierten Henrietta Lacks Community Academic Partnership Award.[28] Im Jahr 2014 erhielt Henrietta Lacks einen Platz in der Maryland Women's Hall of Fame. In der Würdigung wurde besonders hervorgehoben, dass durch Henrietta Lacks Geschichte die Bedeutung ethischen Handelns in in der modernen Wissenschaft aufgezeigt wird.[29]
2011 gründete die Familie von Henrietta Lacks Lacks Family HeLa Foundation, eine Stiftung zur finanziellen Unterstützung bedürftiger, an Krebs erkrankter Patienten.[30]
An ihrem führeren Wohnort Clover (Virgina) und an dem ehemaligen Wohnhaus der Familie Lacks in Maryland erinnern Gedenktafeln an Henrietta Lacks.[31]
Literatur
- Rebecca Skloot: Die Unsterblichkeit der Henrietta Lacks. Irisiana-Verlag, 2010, ISBN 978-3-424-15075-9
- Friederike Lorenz: Ein bisschen Unsterblichkeit – über die Zellen von Henrietta Lacks. In: Die Zeit Nr. 52, 2006, vom 20. Dezember 2006
- Katrin Blawat: Ein ewiges Leben. In: Süddeutsche Zeitung vom 19. April 2010
Weblinks
- Leonardo: Die unsterbliche Henrietta Lacks - Zellen einer Toten retten Leben. (PDF-Datei; 103 kB) In: WDR 5 vom 27. August 2008
- WDR Zeitzeichen: 4. Oktober 1951: Der Todestag der US-Amerikanerin Henrietta Lacks In: WDR3/WDR5 vom 4. Oktober 2011
Einzelnachweise
- ↑ Rebecca Skloot: Die Unsterblichkeit der Henrietta Lacks. Goldmann Verlag, München 2013, S. 35 (ISBN 978-3-442-15750-1)
- ↑ D. Keiger: Immortal Cells, Enduring Issues. In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014
- ↑ B. P. Lucey:Henrietta Lacks, HeLa Cells, and Cell Culture Contamination. In: Arch Pathol Lab Med. Vol. 133, September 2009, S. 1463 - 1467
- ↑ Eintrag zu HeLa-Zellen auf der Homepage des DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
- ↑ D. Keiger: Immortal Cells, Enduring Issues. In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014
- ↑ D. Keiger: Immortal Cells, Enduring Issues. In: Johns Hopkins Magazine, 2. Juni 2010, abgerufen am 25.12.2014
- ↑ R. Skoolt: An Obsession on Culture. In: Pitt Magazin. März 2001, abgerufen am 27.12.2014
- ↑ R. W. Brown, J. H. Henderson: The mass production and distribution of HeLa cells at Tuskegee Institute, 1953-55. In: Journal of the History of Medicine and Allied Sciences. 38 (4), 1983, S. 415 - 431.
- ↑ R. Skoolt: An Obsession on Culture. In: Pitt Magazin. März 2001, abgerufen am 27.12.2014
- ↑ E. Brown: Monroe M. 'Monty' Vincent, early leader in cell-production industry, dies at 98. In: Washington Post 7. März 2011, abgerufen am 28. Dezember 2014
- ↑ E. Callaway: Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data. In: Nature, Vol. 500, 8. August 2013, S. 132 -133
- ↑ Lisa Margonelli: Eternal Life. In: The New York Times. 5. Februar 2010, abgerufen am 27. Juni 2015
- ↑ S. M. Gartler: Apparent Hela cell contamination of human heteroploid cell lines. In: Nature. 24. Februar 1968 (5130), S. 750 - 751. PMID:5641128
- ↑ A. del Carpio: The good, the bad, and the HeLa - Perspectives on the world’s oldest cell line. In: Berkley Science Review. 27. April 2014, abgerufen am 28. Dezember 2014
- ↑ H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148
- ↑ J. L. Stump:Henrietta Lacks and The HeLa Cell: Rights of Patients and Responsibilities of Medical Researchers. In: The History Teacher. Vol. 48 (1) 2014, S. 127 - 180
- ↑ E. Callaway: Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data. In:Nature, Vol. 500, 8. August 2013, S. 132 -133
- ↑ S. Zielinski: Henrietta Lacks’ 'Immortal' Cells. Smithonian.com, 22. Januar 2010. abgerufen am 28. Dezember 2014
- ↑ E. Callaway: Deal done over HeLa cell line - Family of Henrietta Lacks agrees to release of genomic data. In:Nature, Vol. 500, 8. August 2013, S. 132 -133
- ↑ R. E. Kisner , E. F. Granton: "Family Talks About Dead Mother Whose Cells Fight Cancer. In: Jet Magazine, 1 April 1976, S. 16-18, 53
- ↑ H. W. Jones: Record of the first physician to see Henrietta Lacks at the Johns Hopkins Hospital: history of the beginning of the HeLa cell line. In: Am J Obstet Gynecol. (176) 1997, S. 227 – 228
- ↑ J. Landry et al.: The Genomic and Transcriptomic Landscape of a HeLa Cell Line. In: 3G Genes Genomes Genetics. Volume 3, August 2013, S. 1213 - 1224; doi: 10.1534/g3.113.005777
- ↑ H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148
- ↑ R. Skloot: The Immortal Life of Henrietta Lacks, the Sequel. In: The New Yorck Times, 23. März 2013, abgerufen am 30. Dezember 2014
- ↑ H. T. Greely, M. K. Cho: The Henrietta Lacks legacy grows. In: EMBO reports, Nr. 10, Volume 14, 2013 S. 849; doi:10.1038/embor.2013.148
- ↑ K. L. Hudson, F. S. Collins: Biospecimen policy: Family matters. Nature 500, 8. August 2013, S. 141–142; doi:10.1038/500141a
- ↑ M. Adams: First Annual Henrietta Lacks Memorial Lecture at Johns Hopkins. veröffentlicht auf der Homepage des Johns Hopkins Hospital am 3. Oktober 2010, abgerufen am 25. Dezember 2014
- ↑ M. Adams: First Annual Henrietta Lacks Memorial Lecture at Johns Hopkins. veröffentlicht auf der Homepage des Johns Hopkins Hospital am 3. Oktober 2010, abgerufen am 25. Dezember 2014
- ↑ Eintrag von Henrietta Lacks auf der Homepage der Maryland Women's Hall of Fame, abgerufen am 27. Juni 2015
- ↑ J. Franzos: An immortal legacy - Hopkins and the community reflect on contributions of Henrietta Lacks at second annual lecture. In: Inside Hopkins. News bulletin for employees throughout Johns Hopkins Medicine. 13. Oktober 2011
- ↑ M. Stefano, N. King: Days of our lives. March 26, 2014, abgerufen am 27. Dezember 2014




