Fumarylacetoacetase
| Fumarylacetoacetathydrolase | ||
|---|---|---|
 | ||
| Bändermodell der Maus-FAA mit Ca2+ (gelb), Ni2+ (orange), Produkte (lila) nach PDB 1QCO | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 46,4 kDa / 419 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Ca2+, Mg2+ | |
| Bezeichner | ||
| Gen-Namen | FAH ; FAA | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.7.1.2, Hydrolase | |
| Reaktionsart | Hydrolyse | |
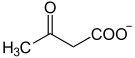
| Substrat | 4-Fumarylacetoacetat + H2O | |
| Produkte | Fumarat + Acetoacetat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2184 | 14085 |
| Ensembl | ENSG00000103876 | ENSMUSG00000030630 |
| UniProt | P16930 | P35505 |
| Refseq (mRNA) | NM_000137 | NM_010176 |
| Refseq (Protein) | NP_000128 | NP_034306 |
| Genlocus | Chr 15: 80.15 – 80.19 Mb | Chr 7: 84.59 – 84.61 Mb |
| PubMed-Suche | 2184 | 14085 |
Fumarylacetoacetase (FAA, FAH) ist der Name des Enzyms, das 4-Fumarylacetoacetat in Fumarat und Acetoacetat hydrolysiert. Diese Reaktion ist der letzte Schritt im Abbau der Aminosäure Tyrosin, und wird in allen Lebewesen durchgeführt. Ein Mangel oder Fehlen des Enzyms beim Menschen führt zu einer Stoffwechselerkrankung, der Tyrosinämie Typ I. Ursache ist immer eine Mutation im FAH-Gen, das für das Enzym codiert.
Biosynthese
FAA wird hauptsächlich in der Leber und den Nieren gebildet, aber auch in geringem Maß in jedem anderen Gewebe. Das FAH-Gen ist auf Chromosom 15 lokalisiert und umfasst 33.340 Basenpaare und 14 Exons. Nach Transkription entsteht mRNA mit einer Länge von 1.447 Basen, deren Translation ein Protein mit 419 Aminosäuren ergibt.[1][2]
Katalysierte Reaktion
Fumarylacetoacetat wird zu Fumarat und Acetoacetat hydrolysiert, das Enzym benötigt außerdem noch Calcium- und Magnesiumionen als Kofaktoren. FAA ist in der Lage, auch andere 3,5- und 2,4-Dioxocarbonsäuren zu hydrolysieren.[3]