AIDS


Acquired Immune Deficiency Syndrome (engl. für erworbenes Immundefektsyndrom, zumeist als AIDS oder Aids abgekürzt) bezeichnet eine spezifische Kombination von Symptomen, die beim Menschen infolge der durch Infektion mit dem HI-Virus induzierten Zerstörung des Immunsystems auftreten.[1] Diese Symptome bestehen aus Sekundärinfektionen (auch opportunistische Infektionen genannt) und Tumoren. Bereits während der mehrjährigen, symptomfreien Inkubationsphase können antivirale Medikamente eingesetzt werden, die die Lebenserwartung von Infizierten steigern können. Eine Heilung ist jedoch nicht möglich, da die HI-Viren nicht vollständig aus dem Körper entfernt werden können.
Aids wurde am 1. Dezember 1981 als eigenständige Krankheit erkannt und tritt in Gestalt einer Pandemie auf. Die WHO schätzt die Anzahl der 2005 an Aids Verstorbenen auf etwa 3,1 Millionen Menschen, mit 40,3 Millionen lebenden Infizierten und 4,1 Millionen Neuinfektionen im Jahr. Der Anteil der HIV-Infizierten liegt weltweit durchschnittlich bei etwa 1 % der 15–49-jährigen, erreicht in einzelnen afrikanischen Staaten jedoch Werte um 20 %.[2]
Ansteckung
Das HI-Virus wird mit den Körperflüssigkeiten Blut, Sperma, Vaginalsekret, Liquor und Muttermilch übertragen. Potentielle Eintrittspforten sind frische, noch blutende Wunden in Schleimhäuten (Bindehaut, Mund-, Nasen-, Vaginal- und Analschleimhaut) bzw. nicht ausreichend verhornte, leicht verletzliche Stellen der Außenhaut (Eichel, Innenseite der Vorhaut). Die häufigsten Infektionswege sind der Vaginal- oder Analverkehr ohne Verwendung von Kondomen, der aufnehmende Oralverkehr (Schleimhautkontakt mit Sperma bzw. Menstruationsblut; bei unverletzter Mundschleimhaut stellt der Kontakt mit Präejakulat oder Vaginalsekret ein vernachlässigbares Infektionsrisiko dar, ebenso der passive Oralverkehr) und die Benutzung kontaminierter Spritzen bei intravenösem Drogenkonsum. Homosexuelle Männer gelten als Risikogruppe, da häufige Partnerwechsel und Analverkehr in der Szene weit verbreitet sind. Wie hoch das Risiko beim Geschlechtsverkehr ist, hängt vor allem von der Viruslast in der Samenflüssigkeit, im Scheidensekret und im Blut ab. Diese ist unmittelbar nach der Infektion, bevor sich Antikörper gebildet haben, besonders hoch, nimmt dann aber zunächst ab und steigt in späten Stadien der Erkrankung wieder an.
Bluttransfusionen bergen ebenfalls das Risiko einer HIV-Infektion, Routineüberwachung der Blutspender – wie sie in Deutschland seit 1985 durchgeführt wird – reduziert dieses jedoch stark. Aufgrund des durchschnittlich etwa 25 Tage andauernden Zeitfensters, während dem eine Neuinfektion noch nicht durch einen Test nachgewiesen werden kann, verbleibt jedoch eine Restgefahr.[3]
Das Risiko einer Infektion eines Kindes durch eine HIV-infizierte Mutter während der Schwangerschaft oder während der Geburt wird auf 10 bis 30 %[4] geschätzt. Bei bekannter HIV-Infektion der Mutter kann das Risiko einer Übertragung auf das Kind durch die Gabe antiretroviraler Medikamente und die Geburt durch Kaiserschnitt auf ca. 2 % vermindert werden.
Vor allem in der Anfangszeit der Epidemie infizierten sich viele intravenös-Drogenabhängige durch die gemeinsame Nutzung von Injektionsnadeln. Auch Ärzte und pflegerisches Personal haben ein gewisses Risiko der Ansteckung bei Nadelstichverletzungen im OP oder nach Punktionen an infizierten Patienten.
Die HIV-Konzentration in Tränen, Schweiß und Speichel reicht für eine Ansteckung nach heutigem Erkenntnisstand nicht aus. Zudem erscheint aufgrund der Aids-Epidemiologie eine Infektion über Insekten oder Tröpfcheninfektion als unwahrscheinlich.[5]
Mittels postexpositioneller Prophylaxe (PEP) kann nach einem Vorfall einer möglichen Infektion entgegengewirkt werden. Die 28 Tage andauernde, medikamentöse PEP bietet nur dann vollständigen Schutz, wenn die Behandlung innerhalb von zwei Stunden nach Exposition begonnen wird und kann bis zu 24 nach intravenöser und bis zu 72 Stunden nach Exposition über die Schleimhäute noch immer wirksam sein.[4]
Ansteckungswahrscheinlichkeit
Hauptquelle dieses Abschnitts: Leitlinie „Postexpositionelle Prophylaxe der HIV-Infektion“ der AWMF [1]
Die Infektionswahrscheinlichkeit liegt nach derzeitigen Erkenntnissen bei den meisten Übertragungswegen zwischen 1:100 und 1:1000. Wichtigste Ausnahme ist die Übertragung von der Mutter auf das Kind während der Geburt mit einer Infektionswahrscheinlichkeit von ca. 15 % und durch eine verseuchte Bluttransfusion, bei der das Infektionsrisiko 95 % beträgt.
Die folgenden Häufigkeiten sind Angaben, die durch Partnerstudien und epidemiologische Studien ermittelt wurden. Das individuelle Risiko kann sehr viel höher sein. So erhöht eine gleichzeitig vorliegende andere Geschlechtserkrankung das Infektionsrisiko um das 5- bis 10-fache, eine hohe Viruslast des Überträgers sogar um das 10- bis 30-fache. Geschlechtsverkehr während der Regelblutung der Frau ist mit einem erhöhten Infektionsrisiko für beide Partner verbunden, beschnittene Männer haben ein geringeres Infektionsrisiko. Insgesamt scheint das Infektionsrisiko nicht konstant über die Anzahl der Kontakte zu sein, so dass das Risiko einzelner Kontakte womöglich erheblich zu niedrig angegeben ist. Mit besseren Medikamenten sinkt möglicherweise das Übertragungsrisiko durch die sinkende Viruslast in Blut und Sekreten.
- Ungeschützter vaginaler Geschlechtsverkehr mit einem HIV-positiven Partner ist mit einem Risiko einer HIV-Infektion von ca. 0,05 - 0,15 % für die Frau, und von 0,03 - (bei einer Studie) 5,6 % für Männer verbunden, tendenziell jedoch für Männer etwas geringer als für Frauen.
- Das Infektionsrisiko für Oralverkehr beim Mann (Fellatio), bei dem Sperma in den Mund aufgenommen wird, ist geringer, eine Infektion ist jedoch nicht ausgeschlossen. Eine Infektion durch Vorflüssigkeit („Lusttropfen“) ist sehr unwahrscheinlich. Bei Oralverkehr bei der Frau (Cunnilingus) wird das Risiko ebenfalls als geringer als beim vaginalen Geschlechtsverkehr angesehen. Auch das Risiko beim sogenannten Rimming wird als äußerst gering eingeschätzt.
- Bei Analverkehr treten häufig kleine Risse an der Schleimhaut auf. Dementsprechend liegt das Risiko beim Analverkehr nach einer Studie mit homosexuellen Männern bei 0,82 % für den passiven Teilnehmer und um 0,3 % für den aktiven Teilnehmer.
- Andere Sexualpraktiken, bei denen kein Kontakt zu Schleimhäuten, Blut, Sperma oder Vaginalsekret besteht, haben ein extrem geringes Infektionsrisiko.
- Das Infektionsrisiko durch Nadelstiche hängt sehr von der Situation ab. Das Infektionsrisiko wird durchschnittlich mit 0,3 % angegeben und steigt mit folgenden Faktoren: sehr tiefe Verletzungen (16-fach erhöht), sichtbare Blutspuren auf der Nadel oder Nadel war vorher in einer Vene oder Arterie des Überträgers (jeweils 5-fach erhöht), bei hoher Viruslast des Überträgers (6-fach erhöht). Das Risiko bei Hohlnadeln ist höher als bei geschlossenen Nadeln.
- Das Risiko, sich bei gemeinsamer Benutzung einer Kanüle, meist beim Spritzen von Heroin, zu infizieren, liegt um 0,7 % und sinkt mit dem zeitlichen Abstand zwischen den Injektionen, allerdings nur langsam, da in der Kanüle eingeschlossene Viren lange infektiös bleiben können, teilweise auch noch nach Tagen. Ein Auskochen der Nadeln ist zwar generell möglich, wenn es lange genug durchgeführt wird, allerdings sind handelsübliche Nadeln nicht dafür geeignet, weil die verwendeten Kunststoffe nicht entsprechend hitzefest sind. Eine chemische Desinfektion (Alkohol oder andere Desinfektionsmittel) ist nicht ausreichend, weil nicht gewährleistet ist, dass die Substanzen ganz in die Kanüle eindringen.
Teilweise besteht die Möglichkeit einer Postexpositionsprophylaxe. Diese besteht aus allgemeinen Maßnahmen (Waschen des Penis nach dem Verkehr, Ausdrücken der Stichwunden und Behandlung mit Desinfektionsmittel) und spezifischen Maßnahmen wie der Gabe von antiretroviralen Medikamenten. Nach einem Ansteckungsverdacht sollte immer sofort ein Arzt aufgesucht werden, der über mögliche Maßnahmen informiert und diese auch einleiten kann.
HIV-Tests
Definition: Unter dem Begriff HIV-Tests versteht man Nachweismethoden, die entweder im Labor oder aber zuhause (Heim-Tests) durchgeführt werden und auf den Nachweis bzw. den Ausschluss einer HIV-Infektion abzielen. Folgende Testmethoden existieren derzeit:
ELISA-Suchtest
Funktionsweise des ELISA-Tests
Die ELISA (enzyme linked immuno sorbent assay)-Testmethode ist die gängigste Verfahrensweise, um HIV im menschlichen Körper nachweisen zu können. Vom Zeitpunkt der Blutabnahme bis zum Eintreffen der Laborergebnisse beim Hausarzt des Patienten vergehen in etwa 3-4 Arbeitstage.
Die ELISA-Tests funktionierten - bis und einschließlich der 3. Test-Generation - ausschließlich über die Abklärung, ob bereits eine Immunantwort des menschlichen Körpers in Form der Produktion von HIV-Antikörpern vorliegt. Ein direkter Nachweis des HI-Virus selbst war jedoch nicht Bestandteil dieses Tests.
Die ELISA-Tests wurden in den vergangenen Jahren kontinuierlich fortentwickelt und stehen seit 1999 als ELISA-Tests der 4. Generation zur Verfügung. Diese funktionieren dergestalt, dass nicht nur abgeklärt wird ob sich HIV-Antikörper (gegen HIV-1, HIV-2 und HIV-1 Subtyp O) in der Blutprobe finden lassen, sondern zusätzlich auch nach dem p24-Antigen gesucht wird. Durch den neu hinzugekommenen p24-Antigen-Anteil hat sich die diagnostische Lücke bezüglich HIV-1 weiter verringert und dementsprechend lässt sich eine HIV-1-Infektion nun eher nachweisen. Zu beachten ist jedoch, dass das p24-Antigen nur in HIV-1 auftritt und bezüglich einer HIV-2-Infektion nach wie vor nur der HIV-Antikörper-Nachweis greift.
Patienten, die in Deutschland einen Arzt aufsuchen und um Abklärung bezüglich einer HIV-Infektion bitten, werden - sofern sie nicht auf eine andere Untersuchungsmethode bestehen - mittels ELISA getestet werden. Der ELISA besitzt eine eingeschränkte Spezifität, dass heißt, dass bei einigen Probanden falsch-positive Ergebnisse ermittelt werden (der Anteil falsch-positiver Ergebnisse an den Testergebnissen in Wahrheit Nicht-HIV-Infizierter liegt allerdings in der Regel deutlich unter 1%, die Spezifität des ELISAs liegt also über 99%). Deswegen wird bei einem positiven Ergebnis im ELISA-Test zusätzlich ein Bestätigungstest mittels der aufwändigeren Western-Blot-Methode (genauer gesagt Immunoblot) durchgeführt. Nur wenn auch dieser positiv ist, wird dem Patienten das Ergebnis „HIV positiv“ mitgeteilt.
Technische Durchführung eines ELISA-Tests (im Labor)
Bei der Durchführung des Tests werden so genannte Elisa-Testplatten verwendet. Eine Testplatte besteht aus bis zu 96 kleinen Näpfen, in denen die HIV-Proteine auf dem Trägermaterial fixiert wurden. Von der zu testenden Blutprobe werden die Blutzellen abgetrennt und die verbleibende gelblich-klare Flüssigkeit, das so genannte Serum, in eines der Näpfchen der Testplatte gegeben (meist verdünnt). Wenn Antikörper im Serum vorliegen, die vom Immunsystem eines HIV-Infizierten gebildet wurden, heften diese sich an die HIV-Proteine. Nach weiteren Arbeitsschritten verbleibt in den Näpfen von HIV-negativen Personen eine glasklare Flüssigkeit und bei HIV-infizierten Menschen eine gefärbte Flüssigkeit. Der Test wird maschinell und immer im Vergleich zu HIV-positiven und HIV-negativen standardisierten Seren abgelesen.
Vorteile des ELISA
Der ELISA-Test ist eine relativ kostengünstige und einfache Möglichkeit, das HI-Virus nachweisen zu können. Allgemein gesagt gilt: Wird der ELISA-Test mit ausreichendem zeitlichen Abstand nach dem letzten Risikokontakt durchgeführt, so sind die Ergebnisse als äußerst genau anzusehen.
Nachteile des ELISA
Der größte Nachteil des ELISA-Test liegt darin, dass eine nahezu hundertprozentige Ausschlusswahrscheinlichkeit einer HIV-Infektion im Regelfall erst nach 12 Wochen gegeben ist. Dies bedeutet, dass ELISA-Tests die vor Ablauf der 12-Wochen-Frist durchgeführt werden, eine ggf. vorhandene HIV-Infektion nicht erkennen, da noch nicht genügend HIV-Antikörper im menschlichen Organismus produziert worden sind. Beim ELISA-Test ist die diagnostische Lücke (Zeitraum bis zum sicheren Nachweis der Infektion) also relativ groß (=> Gefahr eines “falsch-negativen“ Ergebnis). Dies gilt insbesondere bei HIV-2, da bei dieser Spezies statt dem p24-Antigen ( welches mit ELISA/4.Generation nachgewiesen werden könnte ) das p26-Antigen auftritt. Ein p26-Abgleich ist im ELISA/4.Generation jedoch nicht enthalten.
Es gelten bei Nutzung von ELISA-Tests der 3. Generation (bei Infizierten) folgende Nachweiswahrscheinlichkeiten[6]:
- Nach 4 Wochen ist der Test in 60-65 % der Fälle positiv.
- Nach 6 Wochen in 80 %
- Nach 8 Wochen in 90 %
- Nach 12 Wochen in 95 % ( andere Quellen sprechen von 99 % )
Grundsätzlich gilt: Je länger der Zeitraum zwischen möglicher Ansteckung und Test, um so größer ist seine Aussagekraft.
Zweite diagnostische Lücke bei ELISA-Test der 4. Generation möglich
Um die diagnostische Lücke zwischen einem Risikokontakt und dem Nachweis der Infektion zu verkürzen, wurden die ELISA-Tests dergestalt weiterentwickelt, dass neben dem reinen Antikörpermachweis auch noch ein HIV-1-p24-Antigen-Nachweis in den Test integriert wurde. Da das HIV-1-p24-Antigen bereits zu einem Zeitpunkt nachweisbar ist, zu welchem ein reiner Antikörpertest noch nicht anschlagen würde, kann somit im Regelfall eine HIV-1-Infektion früher ermittelt werden. Beachtet werden muss jedoch, dass das HIV-1-p24-Antigen nur für ca. 4 Wochen im Körper nachweisbar ist. Dies ist im Normalfall nicht weiter nachteilig, da sich die Nachweisbarkeit des HIV-1-p24-Antigen und die Nachweisbarkeit von HIV-Antikörpern zeitlich überschneiden, so dass die Kombinationstests (ELISA/4. Generation) entweder auf den einen oder auf den anderen, oder aber auf beide Bestandteile ansprechen. In Einzelfällen ist es jedoch vorgekommen, dass das p24-Antigen bereits wieder unter die Nachweisgrenze von HIV-Tests der 4. Generation zurückgegangen war, während die HIV-Antikörper die Nachweisgrenze noch nicht überstiegen hatten. Es hatte sich somit eine zweite diagnostische Lücke aufgetan, also ein Zeitraum, zu welchem das HIV-1-p24-Antigen nicht mehr, die HIV-Antikörper jedoch noch nicht nachweisbar war. Wurde nun in dieser Zeit eine Blutprobe entnommen und mittels ELISA (4. Generation) getestet, so wurde fälschlicherweise bei diesen Patienten ein falsch-negatives Ergebnis ermittelt. Von Seiten der Testhersteller wurden bereits Anstrengungen unternommen, die „zweite diagnostische Lücke“ zu schließen.
Genauigkeit des ELISA-Test
Die Sensitivität des ELISA-Test wird mit 99,9 % angegeben. Dies bedeutet, dass von 1000 HIV-positiven Patienten 999 als solche erkannt werden und einer ein falsch-negatives Ergebnis erhält. Die Spezifität beträgt 99,8 %. Dies bedeutet, dass von 1000 nicht HIV-Positiven 998 ein korrektes, negatives Ergebnis erhalten und 2 ein falsch-positives Ergebnis. Der positive prädiktive Wert, also die Wahrscheinlichkeit, dass eine Person mit positivem Test wirklich infiziert ist, hängt von der Prävalenz in der getesteten Gruppe ab und kann somit nicht allgemein angegeben werden. Bei niedriger Prävalenz, wie z. B. bei Personen ohne Risikofaktoren liegt er deutlich unter der Spezifität, bei unter 50 %. Liegen hingegen Risikofaktoren vor, steigt der Wert schnell an und erreicht Werte nahe der Spezifität (zur Bewertung eines Testergebnisses siehe auch: Beurteilung eines Klassifikators).
Sonstiges zum ELISA
Der HIV-Suchtest ist auch in großen klinisch-chemischen Laborautomaten durchführbar. Es werden dann etwa abweichende Verfahren eingesetzt, z. B. der Chemilumineszenz-Immunoassay (ChLIA) oder der Mikropartikel-Enzym-Immunoassay (MEIA). Aussagekraft und Beschränkungen sind aber dem ELISA vergleichbar.
Western-Blot-Bestätigungs-Test (Immunoblot):
Sofern ein ELISA-Suchtest positiv oder grenzwertig ausgefallen ist und somit ein erstes Indiz auf eine vorhandene HIV-Infektion vorliegt, wird seitens des Labors zur Bestätigung ein zweiter Antikörper-Test durchgeführt. Ein positives Ergebnis wird dem Patienten nur mitgeteilt, wenn auch der Western-Blot positiv ist. Dieser routinemäßige Bestätigungstest wird mittels der aufwändigeren Western-Blot-Methode (genauer gesagt Immunoblot), ebenfalls einem Antikörpertest, durchgeführt. Hierzu wird eine Reihe unterschiedlicher HIV-Proteine auf einen Teststreifen als Trägermaterial nebeneinander aufgebracht. Der Streifen wird in eine weitere verdünnte Serumprobe eingelegt. Wenn Antikörper gegen HIV vorhanden sind, heften sich diese an die Virusproteine. Nach weiteren Arbeitsschritten werden dunkle Striche auf dem Teststreifen sichtbar. Sie zeigen an, gegen welche Virusproteine der Mensch Antikörper gebildet hat. Nach WHO-Empfehlung wird die Diagnose 'HIV-positiv' auf Grund von Antikörpern gegen zwei verschiedene Virusproteine gestellt. Auf diese Weise wird der zuvor positive oder grenzwertige Suchtest widerlegt oder bestätigt und eine noch größere Spezifität (ca. 99,9996 %) erreicht. [7].
RT-PCR-Test
Funktionsweise des PCR-Test
Ein Test nach dem RT-PCR-Verfahren ist eine der genauesten und zugleich auch eine der teureren Untersuchungs- bzw. Testmethoden. Im Gegensatz zum ELISA-Test wird nicht auf HIV-Antikörper abgezielt, sondern stattdessen werden die HI-Viren selbst - mittels Suche nach viralen Nukleinsäuren - nachgewiesen. Dabei wird durch die reverse Transkriptase (RT) in einem ersten Schritt die virale RNA aus den Blutproben in DNA umgewandelt. Im Rahmen der PCR (Polymerase Chain Reaction) wird diese DNA anschließend vervielfältigt, womit - im nächsten Schritt der Untersuchung - der Nachweis des Virus erst möglich gemacht wird. Da die Vervielfältigung logarithmisch verläuft, lassen sich auch Aussagen über die Ausgangskonzentration der HIV-RNA und somit Virus-„Menge“ treffen, wobei der durch die Labortests abgedeckte Messbereich 40 Kopien/ml bis 10.000.000 Kopien/ml Blut umfasst. Fällt ein solcher Test negativ aus, bedeutet es, dass entweder überhaupt keine HIV-Infektion vorliegt, oder aber die Virus-Last (noch) so gering ist, dass weniger als 40 Kopien pro ml Blut vorhanden waren. Da jedoch die Anfangsphase einer HIV-Infektion - aufgrund der noch fehlenden körpereigenen Antikörper - dadurch chrakterisiert ist, daß eine außerordentlich hohe Virus-Menge im Blut des Infizierten vorliegt, ist ein negativ verlaufender PCR-Test, der mind. 15 Tage nach erfolgtem Risikokontakt durchgeführt wurde, als eindeutiges Zeichen für das Nichtvorhandensein einer HIV-Infektion zu werten. Vom Zeitpunkt der Blutentnahme bis zur Ergebnisübermittlung an den Hausarzt des Patienten vergehen im Regelfall 3-4 Arbeitstage. Das PCR-Verfahren wird bei Infizierten standardmäßig zur Überwachung der antiretroviralen Therapie (HAART) eingesetzt und findet ferner auch im Blutspendewesen Verwendung.
PCR-Tests begleitend zur antiretroviralen Therapie
Um den Verlauf und den Erfolg der antiretroviralen Therapie (HAART) beobachten zu können, wird das PCR-Verfahren verwendet. Durch regelmäßige Bluttests wird die Entwicklung der Virus-Last im Blut des Infizierten abgeklärt. Ziel der HAART ist es, die Virus-Last unter die Nachweisgrenze zu drücken.
PCR-Tests im Blutspendewesen
Blutspenden von Dutzenden von Menschen werden gemischt und dann gemeinsam nach HIV-Erbgut untersucht. Ist das Resultat positiv, werden dann die Blutproben von kleineren und noch kleineren Untergruppen untersucht, um so die Herkunft des gefundenen Viren-Erbgutes auf den einzelnen Spender zurückzuführen.
Vorteile des PCR/RT-PCR-Verfahrens
Das PCR/RT-PCR-Verfahren weist im Gegensatz zum ELISA-Verfahren eine kleinere diagnostische Lücke auf. Dies bedeutet, dass schon 10 bis 15 Tage nach einem Risikokontakt eine Aussage über den Nachweis bzw. Ausschluss einer HIV-Infektion gemacht werden kann[8]. Der Vorteil einer frühzeitigen Erkennung einer HIV-Infektion liegt in der vermuteten positiven Wirkung, die einem Behandlungsbeginn noch im Verlauf der akuten HIV-Infektionsphase (siehe Punkt 5.1 dieses Artikels) zugeschrieben werden.
Nachteile des PCR/RT-PCR-Verfahrens
Da es sich nicht um ein Standard-Verfahren handelt, hat ein Patient, welcher auf eigenen Wunsch hin mittels PCR/RT-PCR-Verfahren auf HIV getestet werden möchte, diese Untersuchung selbst zu zahlen. Die Kosten belaufen sich hierbei auf etwa 100 bis 150 Euro (Stand 2006). Es ist ferner zu beachten, dass dieser Kostensatz pro HIV-Spezies anfällt. Wer also neben dem in Deutschland weit verbreiteten HIV-1 auch das deutlich seltenere HIV-2 mittles eines PCR-Tests abklären will, der muss den doppelten Satz (also insgesamt zwischen 200 und 300 Euro) bezahlen. Es ist ferner zu beachten, daß die Blutprobe welche mittels RT-PCR getestet werden soll, rasch und ungekühlt an das Labor zu senden ist. D.h. der Blutentnahmetermin ist vom Hausarzt des Patienten so zu legen, daß die Probe relativ kurz vor dem Eintreffen des Laborkurierfahrers entnommen werden kann. Bis zum Eintreffen des Kurierfahrers wird die Probe bei Zimmertemperatur gelagert.
HIV-Tests bei Neugeborenen
Bei Neugeborenen hat ein Antikörper-Test keine Aussagekraft, da die IgG-Antikörper der Mutter durch die Plazenta in das Blut des Kindes gehen, und daher ein falsch positives Testergebnis entsteht. Kommerziell erhältliche Tests zum Nachweis von IgM- oder IgA-Antikörpern, welche vom Kind gebildet werden, sind noch nicht vorhanden. Daher ist die gängige Untersuchungsmethode bei Neugeborenen und Säuglingen die RT-PCR.
Sonstiges
Mittlerweile werden zunehmend auch solche Nachweismethoden zum diagnostischen Standard, welche Resistenzen in den Virusstämmen gegen antiretrovirale Therapien anzeigen.
Sonderform Heim-Test/Home-Test
HIV-Tests sind nicht nur im Rahmen einer ärztlichen Untersuchung möglich, sondern werden seit Jahren auch als Heim-Tests/Home-Tests vertrieben. Diese Heim-Tests (auch „point-of-care“-Tests, „bedside“-Tests oder „rapid/simple test devices“ genannt) basieren auf einem der vier immundiagnostischen Prinzipien Partikel-Agglutination, Immunodot (Dipstick), Immunofiltration oder Immunchromatografie.
Hintergrund der Entwicklung von Heim-Tests war die Notwendigkeit, auch in Ländern mit schlechter medizinischer Infrastruktur, wie beispielsweise in weiten Teilen Afrikas, eine Möglichkeit zu schaffen, HIV-Infektionen rasch nachweisen zu können. Als größter Auftraggeber von HIV-Home-Tests gilt die UN, die diese millionenfach in afrikanischen Ländern verteilt. Laut Bundeszentrale für gesundheitliche Aufklärung sind HIV-Heimtests in Deutschland jedoch nicht zugelassen, was mit dem nicht integrierten Bestätigungstest (Western-Blot) begründet wird. Gleichwohl kann man solche Heim-Tests über Internetanbieter bestellen und es werden die Bestellsendungen auch anstandslos durch die Zollkontrollen durchgelassen. Dies gilt auch dann, wenn die Sendung im Rahmen einer zollamtlichen Abfertigung geöffnet und geprüft wird.
Technische Durchführung eines Heim-Tests
Der Patient sticht sich – mittels eines im Test-Set enthaltenen mechanischen Fingerstechers oder einer Lanzette – in eine seiner Fingerkuppen. Der mechanische Fingerstecher ist dergestalt konstruiert, daß er nur einmal ausgelöst werden kann. Man setzt das Plastik-Gehäuse, in welchem sich die Nadel befindet auf den zu stechenden Finger auf und drückt von oben auf die Apparatur. Am Anfang baut sich im Inneren des Plastik-Gehäuses eine mechanische Spannung auf, die bei Überschreiten eines bestimmten Punktes, zu einer blitzschnellen nähmaschinenartigen kurzen Vor- und Zurückbewegung der Nadel führt. Dieser Vorgang ist nahezu schmerzfrei. Nun kann der Patient einen Bluttropfen in die Probenvertiefung des Testplättchens fallen lassen und gibt einen Tropfen Pufferlösung hinzu. Nach genau 15 Minuten wird die Anzeige des Testplättchens überprüft. Erscheint lediglich ein Ausschlag im Kontroll-Bereich, so wurde der Test ordnungsgemäß durchgeführt und es liegt keine HIV-Infektion vor. Erscheint sowohl ein Ausschlag im Kontroll-Bereich als auch im Test-Bereich, so wurde der Test ordnungsgemäß durchgeführt und der Test ist positiv.
Vorteile von Heim-Tests
Heim-Test sind in vielen Ländern der Dritten Welt die einzige Möglichkeit für große Teile der Bevölkerung, überhaupt eine Nachweismöglichkeit bereitzustellen. Ferner entfällt aufgrund der schnellen Reaktionszeit (15 Min.), im Gegensatz zum klassischen Test beim Arzt, ein tagelanges und nervenaufreibendes Warten auf die Laborergebnisse.
Nachteile von Heim-Tests
Heim-Tests werden im Regelfall seitens des möglicherweise Infizierten ohne Anwesenheit einer weiteren Person durchgeführt. Dementsprechend steht der Patient dem, möglicherweise positiven, Testergebnis alleine gegenüber. In einer solchen Situation besteht die Gefahr, dass ein positiv Getesteter eine Kurzschluss-Handlung (z. B. Selbstmord) begeht, da niemand da ist, der beruhigend auf ihn einwirken kann. Da kein Bestätigungstest durchgeführt wird, besteht zusätzlich eine höhere Gefahr eines falsch-positven Ergebnisses, das von einem Laien unter Umständen nicht richtig gedeutet wird.
Neben den individuellen Risiken bestehen auch gesellschaftliche Folgen: Da die Durchführung eines Heim-Tests ein anonymes Unterfangen ist und somit im Gegensatz zu einem beim Arzt durchgeführten HIV-Test keine Datenspur hinterlässt, besteht die Gefahr, dass Infizierte diesen Informationsvorsprung ausnutzen und zum Nachteil der Versicherungsgesellschaften etwaige Risikolebensversicherungen, Krankenzusatzversicherungen oder eine private Krankenversicherung abschließen und hierbei die Gesundheitsfragen vorsätzlich falsch beantworten. Da es seitens der Versicherungen nahezu unmöglich ist, einen solchen Betrug nachweisen zu können, entstehen den betroffen Firmen und somit auch der Allgemeinheit entsprechende finanziellen Schäden.
Da Heim-Tests lediglich auf Antikörpernachweis abzielen, benötigt man - analog einem ELISA-Test der 3. Generation - einen zeitlichen Abstand von 3-6 Monaten, um eine nahezu hunderprozentige Aussage bezüglich dem Ausschluss einer HIV-Infektion treffen zu können. Zudem weisen nicht alle Heim-Tests auch Antikörper gegen HIV-2 nach.
Heim-Tests werden in Swinger-Kreisen als vermeintlicher Nachweis eigener Gesundheit verwandt, um einen Sexualpartner zu ungeschützten Sexualpraktiken zu überreden. Hierbei wird die diagnostische Lücke oftmals unberücksichtigt gelassen und führt zu einer weiteren Verbreitung von HIV.
Meldepflicht
In Deutschland wird dem feststellenden Arzt im Rahmen der Laborberichtspflicht empfohlen, eine HIV-Infektion anonymisiert dem Robert-Koch-Institut in Berlin zu melden. Eine HIV-Infektion ist in Österreich, im Gegensatz zur Aidserkrankung, nicht meldepflichtig. Diese erfolgt an das Ministerium in anonymisierter Form.
Definition und Klassifikation des AIDS
HIV-Erkrankungen werden in der Regel nach der CDC-Klassifikation eingeteilt, die von den US-amerikanischen Centers for Disease Control and Prevention erstellt und zuletzt 1993 überarbeitet wurde Die Einteilung basiert auf drei verschiedenen Kategorien, die sich aus dem klinischen Bild ergeben (A-C) und der Einteilung des CD4-T-Helferzellstatus (1-3). [9].
Kategorie A bezeichnet eine asymptomatische HIV-Infektion.
Unter Kategorie B werden Krankheiten zusammengefasst, die nicht als Aids definierend gelten, aber im Zusammenhang mit einem Immundefizit zu stehen scheinen. Zu diesen gehören:
- bazilläre Angiomatosen
- Entzündungen des kleinen Beckens, besonders bei Komplikationen eines Tuben- oder Ovarialabszesses
- ausgedehnter oder rezidivierender Herpes zoster (Gürtelrose)
- thrombozytopene Purpura
- lang anhaltendes Fieber oder Durchfälle, die länger als einen Monat anhalten
- Listeriose
- orale Haarleukoplakie
- oropharyngeale Candidosen
- chronische oder schwer zu therapierende vaginale Candidosen
- zervikale Dysplasien
- Carcinoma in situ
- periphere Neuropathie.
Kategorie C umfasst die Aids definierenden Erkrankungen. Es handelt sich um meist opportunistische oder maligne Erkrankungen, die bei einem gesunden Immunsystem nicht oder nicht in der beschriebenen Weise auftreten. Zu ihnen gehören:
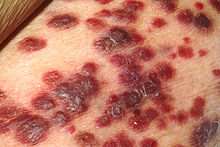
- Candidosen der Atemwege oder der Speiseröhre
- Cytomegalievirus-Infektionen (außer Leber, Milz und Lymphknoten)
- CMV-Retinitis (mit Einschränkung der Sehschärfe)
- HIV-bedingte Enzephalopathie
- Herpes simplex mit chronischen Ulzera (>1 Monat) oder durch Herpes simplex bedingte Bronchitis
- Pneumonie oder Ösophagitis
- chronische Histoplasmose
- intestinale Isosporiasis
- Kaposi-Sarkom
- disseminierte oder extrapulmonale Kokzidiomykose
- extrapulmonale Kryptokokkose
- chronisch intestinale Kryptosporidiose
- immunoblastisches, primär zerebrales oder Burkitt-Lymphom
- extrapulmonale und atypische Mykobakteriosen
- Pneumocystis-carinii-Pneumonie
- rezidivierende bakterielle Pneumonien (länger als 1/Jahr)
- progressive multifokale Leukenzephalopathie
- rezidivierende Salmonellen-Septikämie
- Tuberkulose
- zerebrale Toxoplasmose
- Wasting-Syndrom
- invasives Zervixkarzinom
Die CDC-Klassifikation der Laborkategorien beschreibt die noch vorhandene Anzahl von CD4-Zellen. Kategorie 1 entspricht mehr als 500 CD4-Zellen/pl, Kategorie 2 200 bis 400 und Kategorie 3 unter 200 CD4 Zellen/pl.
Zur Einstufung werden beide Werte herangezogen. Die Erkrankung eines Patienten mit einer oropharyngealen Candidose und mit einem CD4 Zellwert von 300 wird also mit B2 beschrieben. Eine Rückstufung bei Besserung des klinischen Bildes oder des CD4 Zellwertes wird nicht vorgenommen.
In Deutschland wird die Diagnose Aids anhand des klinischen Bildes getroffen, wohingegen in den USA bei einem CD4-Zellwert von unter 200 ebenfalls von Aids gesprochen wird, auch ohne klinische Symptomatik.
Die CDC Klassifikation ist die derzeit gebräuchlichste und wahrscheinlich beste Einteilung der HIV-Erkrankung. Trotzdem weist sie einige Schwächen auf. Zum einen ist sie zuletzt 1993 neu bearbeitet worden, was eine ganze Epoche an neueren HIV-Therapiemöglichkeiten und den damit verbundenen Änderungen des klinischen Bildes nicht mit berücksichtigt. Zum anderen ist sie geprägt durch ihren Entstehungsort (USA). Einige opportunistische Erreger, die in anderen Teilen der Welt eine große Rolle spielen, wie Penicillosen in Asien, tauchen in der Klassifikation nicht auf.
Krankheitsverlauf
Eine HIV-Infektion verläuft in vier Phasen:
Akute Phase (4-6 Wochen)
2-6 Wochen nach einer Infektion können grippeähnliche Symptome wie Fieber, Nachtschweiß, geschwollene Lymphknoten, Übelkeit usw. auftreten.
Die häufigsten Symptome einer akuten HIV-Infektion sind (angegeben nach der Wahrscheinlichkeit des Auftretens)[10]
- 80 % Fieber
- 78 % Abgeschlagenheit, Müdigkeit
- 68 % Unwohlsein, Krankheitsgefühl
- 54 % Kopfschmerzen
- 54 % Appetitverlust
- 54 % Arthralgien (Gelenkschmerzen)
- 51 % Hautausschlag
- 51 % Nachtschweiß
- 49 % Myalgien (Muskelschmerzen)
- 49 % Übelkeit
- 46 % Diarrhoe (Durchfall)
- 46 % Fieber und Ausschlag (als Kombination)
- 44 % Pharyngitis oder Schluckschmerzen
- 37 % orale Ulzerationen (Geschwüre im Mund)
- 34 % Steifer Nacken (vermutlich aufgrund der auch dort befindlichen und angeschwollenen Lymphknoten)
- 32 % Gewichtsverlust größer als 2,5 kg
- 24 % Lichtempfindlichkeit
Manche Patienten bemerken obige Symptome jedoch nicht oder sie haben keine.
Zur Diagnostik einer akuten HIV Infektion dient ein positiver HIV-RNA Test durch eine RT-PCR und ein negativer oder „grenzwertiger“ Bestätigungstest. Referenzfehler: Es fehlt ein schließendes </ref>. Bei der Toxizität der einzelnen Substrate gibt es erhebliche Unterschiede.
NRTI werden unverändert in die Zelle aufgenommen und dort durch Phosphorylierung aktiviert. Sie werden überwiegend über die Niere (renal) eliminiert und haben daher wenig Wechselwirkung mit Medikamenten, die in der Leber verstoffwechselt werden.
Nicht-Nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI)
Während NRTIs als „falsche“ Bausteine die reverse Transkriptase hemmen, binden NNRTIs direkt an dieses Enzym, nahe der Substratbindungsstelle für Nukleoside. Zurzeit gibt es drei NNRTIs auf dem Markt: Neverapin, Delavirdin und Efavirenz. Während Nevirapin und Efavirenz etwa gleich effektiv sind, spielt Delaviridin in der Therapie kaum eine Rolle und ist in Deutschland (noch) nicht zugelassen.
Als Einzelsubstanz zeigen NNRTIs nur eine begrenzte Wirkung, in Kombinationstherapie mit 2 NRTIs sind sie aus immunologisch-virologischer Sicht mit Proteaseinhibitoren gleichwertig. Bisher konnte keine Studie nachweisen, dass die Überlebenszeit verbessert wurde und die Krankheit langsamer fortschreitet als mit HAART [11]. Jedoch wurde eine Verbesserung der Lebensqualität beschrieben [12]. Zur Zulassung wurden ausschließlich Studien zu verbesserten CD4+ Zellzahlen und zur niedrigeren Viruslast benutzt (Surrogatmarker-Studien). Durch ihre gute Verträglichkeit und die geringere Pillenzahl werden sie häufig den Proteaseinhibitoren vorgezogen. NNRTIs sind recht empfindlich: Schon eine Punktmutation genügt, um eine Resistenz des Virus gegen den Wirkstoff zu erzeugen. Zudem bestehen Kreuzresistenzen: Zeigt ein Virus Resistenzen gegen einen NNRTI, so sind meist alle NNRTIs wirkungslos. NNRTIs werden in der Leber verstoffwechselt (Cytochrom P450-System).
Die Nebenwirkungsprofile der einzelnen Wirkstoffe unterscheiden sich erheblich. Bei der Therapie mit Nevirapin stehen vor allem allergische Reaktionen und Lebertoxizität im Vordergrund. Ein Ausschlag tritt bei bis zu 20 % der Patienten auf und führt bei 7 % zum Abbruch der Nevirapineinnahme. Um die Gefahr von Allergien zu mindern, sollte Nevirapin mit zunächst geringer Dosierung eingeschlichen werden. Lebertoxizität ist eine seltene, aber unter Umständen lebensbedrohliche Nebenwirkung von Nevirapin. Daher sollten zu Beginn der Therapie die Leberwerte (vor allem die Transaminasen) engmaschig kontrolliert werden.
Die Nebenwirkungen von Efavirenz betreffen hingegen vor allem das zentrale Nervensystem. Sie treten meist zur Beginn der Therapie auf und schwächen sich danach ab. In den ersten vier Wochen in einer Studie traten bei 2/3 der Patienten Schwindel, nahezu der Hälfte Albträume und bei etwa einem Drittel der Patienten Benommenheit und Schlafstörungen auf. Diese nahmen aber meist nach einiger Zeit ab. Während Nevirapin zur Vorbeugung einer Mutter-zu-Kind-Übertragung (PMTCT = Prevention of Mother to Child Transmission) eingesetzt wird, ist Efivarenz in der Schwangerschaft kontraindiziert. Angesichts der Wirkung auf das zentrale Nervensystem ist die Verkehrstauglichkeit fraglich. Ein Vorteil von Efavirenz gegenüber Nevirapin ist die geringere Lebertoxizität.
Delavirdin ist wegen der hohen Pillenzahl und der dreimal täglichen Einnahme den anderen Wirkstoffen unterlegen. Zudem ist es zurzeit nicht auf dem deutschen Markt zugelassen.
Proteaseinhibitoren (PI)
Kann das HIV-Enzym Protease das virale Makromolekül gag-pol-Polyprotein nicht spalten, so werden nicht-infektiöse Viruspartikel produziert. Proteaseinhibitoren wurden mit dem Wissen über die molekulare Struktur des Enzyms so modelliert, dass sie direkt im aktiven Zentrum der Protease binden können. Die gute Wirksamkeit von Proteaseinhibitoren wurde anhand von klinischen Endpunkten nachgewiesen.Sie haben zu einer deutlichen Verbesserung der Therapie beigetragen[13]. Bei der Langzeitbehandlung zeigen sich jedoch einige Probleme, die zu Störungen im Fettstoffwechsel führen und in der Folge Lipodystrophie (Fettverteilungsstörungen) und Dyslipidämie (erhöhte Blutfettwerte) auslösen können. Der Grund liegt wahrscheinlich in der mitochondrialen Toxizität, da Proteaseinhibitoren offenbar ähnlich den NRTI die Mitochondrien schädigen [14]. Weitere Nebenwirkungen sind gastrointestinale Beschwerden.
Proteaseinhibitoren haben relativ kurze Halbwertszeiten im Blutplasma. Schon nach acht Stunden ist die minimale Hemmkonzentration erreicht. Daher müssen die meisten Proteaseinhibitoren 3-mal täglich eingenommen werden.
Der Abbau der Proteaseinhibitoren geschieht in der Leber durch das Cytochrom-P450-Enzymsystem. Der Proteaseinhibitor Ritonavir hemmt dieses System. Man ging daher dazu über, andere Proteaseinhibitoren zusammen mit Ritonavir zu verabreichen, um den Abbau zu verlangsamen und die Plasma-Halbwertszeit zu verlängern. Dies wird als „Booster“ bezeichnet. Mittlerweile gibt es den Proteaseinhibitor Lopinavir kombiniert mit einer Boosterdosis Ritonavir (Kaletra) [15]. Dies führt zu einer fast 100-fach größeren Plasma-Konzentration von Lopinavir und zu einer größeren Barriere gegen Resistenzen. Daher wird Lopinavir/Ritonavir (Kaletra) zumeist nach Therapieversagen anderer Medikamente benutzt („Salvage-Bereich“).
Fusionsinhibitoren
Anfang 2003 wurde der erste Fusionsinhibitor T-20 auf den Markt gebracht. T-20 bindet an das für die Fusion des Virus mit der Zellmembran der T-Helferzellen wichtige Transmembranprotein gp41 und blockiert so den Eintritt des Virus in die Zelle. Besonders interessant wird die Substanz dadurch, dass sie keine mitochondriale Toxizität und damit kein Lipodystrophiesyndrom auslöst.
T-20 ist mit seinen 36 Aminosäuren zu groß für eine orale Einnahme. In seiner jetzigen Form muss T-20 täglich subkutan gespritzt oder über eine „Insulinpumpe“ verabreicht werden. Als Nebenwirkung treten häufig Hautirritationen an der Einstichstelle auf.
Erste Studien ergaben, dass die eine bloße Hinzugabe von T-20 zu einer klassischen antiretroviralen Therapie nur einen begrenzten Erfolg mit sich bringt. Zwei große Studien, die T-20 zu einer optimierten HAART gegen eine optimierte HAART ohne T-20 verglichen, zeigte jedoch signifikant bessere Werte im T-20-Arm der Studie. Das lässt darauf schließen, dass besonders diejenigen Patienten von T-20 profitieren, die gleichzeitig auch noch andere medikamentöse Optionen haben.[16]
T-20 kann offenbar zu Interaktionen mit Granulozyten führen, die bei einigen Patienten zu vermehrten Infektionen führten.
Eine rasche Resistenzbildung des Virus ist zudem recht wahrscheinlich. Jedoch scheint die virale Angepasstheit an den menschlichen Wirt der resistenten Stämme vermindert zu sein.
Dennoch ermöglicht T-20 Patienten eine Option, die auf Grund von Nebenwirkungen oder Resistenzen ihre Therapie umstellen müssen. Erste Wahl zu Therapiebeginn ist T-20 derzeit jedoch nicht, und das nicht nur auf Grund der Studienlage. T-20 ist nach Aussage der Herstellerfirma Hoffmann-La Roche einer der am aufwändigsten zu produzierenden Substanzen der Firmengeschichte. Dies macht sich im Preis deutlich, der mit über 24.000 Euro pro Jahr höher als einige Dreifachkombinationen herkömmlicher antiretroviraler Medikamente liegt. An anderen Fusionsinhibitoren und an einer wöchentlich zu verabreichenden T-20-Injektion wird geforscht.
Eine Sammlung mit übersichtlichen Beschreibungen aller zur Zeit angewandten antiretroviralen Therapeutika sowie einiger gängiger Medikamente zur Behandlungen opportunistischer Infektionen findet sich unter HIV.NET.
Highly Active Antiretroviral Therapy (HAART)
Mit highly active antiretroviral therapy wird die Kombinationstherapie aus mehreren antiretroviralen Medikamenten bezeichnet. Ziel der Therapie ist es, die Viruslast unter die Nachweisgrenze zu drücken und die CD4-Zellwerte zu erhöhen, um so das Immunsystem gegen opportunistische Infektionen und andere Aids-definierende Erkrankungen zu stärken.
In der Regel besteht eine HAART aus 2 verschiedenen Nukleosidanaloga (NRTI, auch als „Nuke-Backbone“ der Therapie bezeichnet) plus entweder einem Nicht-nukleosidischen Reverse-Transkriptase-Hemmer (NNRTI), einem Proteaseinhibitor (PI) oder einem dritten Nukleosidanalogon. Welche Kombination die beste ist, lässt sich pauschal nicht beantworten, und wird individuell entschieden. Jede der Kombinationen hat Vor- und Nachteile:
Die Kombination aus 2 NRTI und einem PI wurde dem größten Testspektrum ausgesetzt und es liegen Daten aus Langzeitstudien zum klinischen Effekt vor. Diese Kombination weist eine hohe Barriere gegen Resistenzen auf. Die hohe Pillenzahl stellt jedoch eine Belastung für den Patienten dar und wirkt sich negativ auf seine Adherence aus. Auch ist eine Langzeittoxizität zu befürchten.
Eine Kombination aus 2 NRTI und einem NNRTI besitzt offenbar eine ähnlich virenhemmende Wirkung wie PIs, jedoch ist nicht der klinische Effekt, sondern lediglich der Effekt auf Laborparameter durch Studien belegt. Die geringe Pillenzahl (einmal am Tag für den NNRTI, zweimal am Tag die NRTI) stellt hierbei eine geringere Belastung für den Patienten dar. Zu Beginn der Therapie mit Nevirapin treten jedoch häufig Allergien auf. NNRTI sind resistenzanfälliger, und durch Kreuzresistenzen fällt eine ganze Wirkstoffklasse weg.
3 NTRI haben die geringste Pillenzahl und die einfachste Dosierung. Eine Kombination aus AZT, 3TC und Abacavir ist in einer Tablette (Trizivir) verfügbar, die 2-mal täglich eingenommen wird. Andere Kombinationen sind aus patentrechtlichen Gründen nicht in einer Tablette verfügbar. In Indien, Südafrika, Brasilien und Kenia werden auch Tabletten mit zwei NRTI und einem NNRTI als Generikum produziert. Es scheint wenige Interaktionen mit anderen Medikamenten zu geben, und sollte es zur Unverträglichkeit oder Resistenzen kommen, so stehen noch 2 andere Wirkstoffklassen zu Verfügung. Es liegen jedoch keine Langzeitdaten mit klinischen Endpunkten vor und die Kombination scheint auch etwas weniger wirksam in der Virusunterdrückung zu sein.
Startzeitpunkt einer HAART
Zum besten Startzeitpunkt einer HAART gibt es keinen Konsens, da die Gefahr an Aids zu erkranken gegen die Risiken der Langzeittoxizität und Resistenzbildung abgewägt werden müssen. Während Mitte der 1990er Jahre die Mutationsgeschwindigkeit des Virus und die Annahme einer möglichen Eradikation zu einer „Hit hard and early!“-Strategie bei der Behandlung verleiteten, führte die Entdeckung mitochondrialer Toxizität zur Zurückhaltung. Heute beginnt eine HAART erst bei deutlicher Schwächung des Immunsystems.
Die Deutsch-Österreichische Empfehlung zum Therapiebeginn berücksichtigt drei Faktoren: Das klinische Bild des Patienten, seinen CD4-Wert und die Viruslast.
Patienten, die bereits Aids-definierende Erkrankungen haben (CDC C), wird eine HAART dringend empfohlen. Auch beim Auftreten von Erkrankungen, die auf ein geschwächtes Immunsystem hindeuten, jedoch nicht Aids-definierend sind (CDC B), wird eine HAART empfohlen. Dies gilt auch für Patienten, die symptomfrei sind, aber einen CD4+ Wert unter 200 haben, da es dann meist eine Frage der Zeit ist, bis Aids auftritt. Als im Allgemeinen ratsam wird eine Therapie bei Patienten angesehen, die einen CD4+ Wert zwischen 200 und 350 haben. Ebenso angeraten ist der Beginn der HAART laut der Empfehlung bei Patienten mit einem CD4+ Wert zwischen 350 und 500, wenn eine hohe Viruslast vorliegt (> 100.000).
Aufgrund der für den Patienten weitreichenden Konsequenzen, wird die Entscheidung individuell getroffen, so dass der Patient zuvor über Risiken und Nebenwirkungen ausreichend informiert und psychisch auf diese Therapie eingestellt ist.
Vorbeugung
Prävention ist die effektivste Maßnahme gegen HIV. Durch den Gebrauch von Kondomen, sterilen Nadeln bei der Einnahme von Drogen und bei Impfungen sowie Blutspenden kann man einer Infektion sehr sicher entgehen. Verzicht auf häufigen Wechsel des Sexualpartners und ein drogenfreier Lebensstil sind noch wirksamere Präventionsmaßnahmen, die so gut wie alle Neuinfektionen verhindern können. Nach einem Ereignis mit Ansteckungsrisiko kann die Ansteckung verhindert werden, wenn eine sog. Postexpositionsprophylaxe stattfindet.
Eine HIV-Impfung gibt es nicht.
An der hohen Mutationsrate des HI-Virus scheiterten bisher die langjährigen Forschungen um Impfstoffe, die die Bildung von schützenden Antikörpern gegen das Oberflächenprotein gp120 fördern sollten. Als das Mittel endlich gegen das sehr ähnliche SIV (SI-Virus, simian Immunodeficiency virus) der Affen erfolgreich getestet war, hatte das HI-Virus in Freiheit die Struktur seines gp120 Oberflächenproteins verändert.
Nach jahrzehntelangen vergeblichen Versuchen, einen Impfstoff gegen das HI-Virus herzustellen, begann Ende Februar 2004 zum ersten Mal eine klinische Studie an gesunden Probanden. Die Studie wird von den Universitätskliniken Bonn und Hamburg-Eppendorf durchgeführt. Als Grundlage für die neue Impfung nahmen die Forscher den Subtyp HIV-1, Subtyp C, der vor allem in Afrika vorkommt. Denn hier soll das Hauptanwendungsgebiet liegen. Aus diesem Grund wird die Studie von gemeinnützigen Organisationen wie der International Aids Vaccine Initiative (IAVA) gefördert.
Entstehungstheorien
HIV ist eng mit Viren verwandt, die aidsähnliche Symptome in Primaten auslösen, und es ist eine derzeit allgemein akzeptierte Annahme, dass einer dieser Virustypen Anfang des 20. Jahrhunderts auf den Menschen übertragen wurde, obwohl es Hinweise darauf gibt, dass dies in isolierten Fällen bereits früher geschah.
Genaue Angaben über Zeit, Ort, Wirtstier, Art und Anzahl der Übertragungen sind nicht bekannt.

Ein Virus, das fast identisch mit dem menschlichen HI-Virus ist und SIV genannt wird, wurde in Schimpansen gefunden. Nach jüngsten Untersuchungen von Virologen der Universität Birmingham/Alabama löst HIV-1, das von dem im Schimpansen gefundenen SI-Virus abstammt, vermutlich die Immunschwächekrankheit aus. Durch eine genetische Analyse konnten die Wissenschaftler zeigen, dass das SI-Virus eine Kombination aus zwei Virusstämmen ist, die in bestimmten Meerkatzen vorkommen. Da Meerkatzen von Schimpansen gejagt und gefressen werden, müssen sich die Schimpansen mit den zwei Virusstämmen infiziert haben, aus denen sich dann in ihrem Körper das SI-Virus gebildet hat. Die Übertragung dieses SI-Virus auf den Menschen erfolgte nach Ansicht der Forscher wohl bereits in den 30er Jahren des 20. Jahrhunderts durch den Verzehr von Schimpansenfleisch.
Weitere wissenschaftliche Untersuchungen ergaben, dass das HI-Virus zuerst in Westafrika auftrat, aber es ist nicht mit letzter Sicherheit geklärt, ob es nicht mehrere Virusherde gab. Neue sogenannte phylogenetische Untersuchungen, das heißt Verwandtschaftsvergleiche zwischen den unterschiedlichen Subtypen von HIV und zwischen HIV und SIV, lassen vermuten, dass mehrere unabhängige Übertragungen vom Schimpansen auf den Menschen in Kamerun und/oder dessen Nachbarländern stattfanden.
Die erste Blutprobe, die nachgewiesenermaßen HIV-Antikörper enthält, wurde 1959 im Kongo von einem erwachsenen Menschen genommen. Weitere Proben stammen von einem US-Amerikaner (1969) und einem norwegischen Matrosen (1976).
Curtis und Hooper (Polio-Impfstoffe)
Nach der Behauptung von Tom Curtis, 1992 vorgestellt im Rolling Stone Magazine, und dadurch ausgelösten Recherchen des britischen Journalisten Edward Hooper, 1999 in dessen Buch The River veröffentlicht, sei das Virus möglicherweise Ende der 1950er Jahre durch einen Polio-Impfstoff in Belgisch-Kongo (heute Demokratische Republik Kongo), der aus den Organen von Schimpansen hergestellt worden sein soll, auf den Menschen übertragen worden.
Es wurde mehrfach versucht, diese Theorie zu bestätigen. Als einen möglichen Beweis dieser Behauptung wird die Häufung von AIDS-Fällen in den Gebieten der Impfungen genannt. Auch werden ehemalige Bedienstete der Einrichtungen, in denen der Impfstoff hergestellt wurde, hierfür zitiert.
Tatsächlich wurden allerdings keine Affenorgane für die Produktion des Impfstoffs verwendet. Eine Probe des Wirkstoffes, die in London verwahrt wurde, zeigte folgerichtig weder Spuren von Schimpansen-DNS noch HIV.
Geschichte
Die früheste dokumentierte Infektion mit HIV-1 wurde anhand 1959 entnommener Blutproben eines Mannes aus Kinshasa (Demokratischen Republik Kongo) nachgewiesen. Der Vergleich mit späteren Proben von einer 1976 an Aids verstorbenen, norwegischen Fischerfamilie, deutet auf Divergenz von einem gemeinsamen Vorfahren aus den 1940er bis frühen 1950er Jahren hin. Es wird angenommen, dass HIV-1 einige Jahre zuvor auf den Menschen übersprang. Der genetische Unterschied zwischen HIV-1 und HIV-2 deutet jedoch auf darauf hin, dass diese Subtypen bereits weitaus früher divergierten. [17]
1981 beschrieb Michael Gottlieb in der am 5. Juni erschienenen Ausgabe des Morbidity and Mortality Weekly Report, einem wöchentlichen Bulletin der US-Gesundheitsbehörde CDC, eine Häufung einer seltenen Form der Lungenentzündung. Diese, durch den Pilz Pneumocystis carinii ausgelöste Form befällt nahezu ausschließlich Patienten mit schwerwiegender Immunschwäche, wurde von Gottlieb jedoch bei fünf zuvor gesunden, homosexuellen Männern in Los Angeles festgestellt.[18] Ähnliche Berichte aus anderen US-amerikanischen Städten folgten. Zudem wurden ein verstärkt auch andere opportunistische Infektionen – etwa Kaposi-Sarkome – festgestellt, die überwiegend Patienten mit geschwächtem Immunsystem befallen.[19]
Schon früh wurde eine erworbene Immunschwächeerkrankung als wahrscheinliche Ursache in Betracht gezogen. Im Juni 1982 wurde eine, anfänglich als Gay Related Immune Deficiency (GRID) bezeichnete, sexuell übertragene Krankheit vermutet[20]. Weitere epidemiologische Untersuchungen in den USA zeigten jedoch, dass die Krankheit auch unter Hämophilen[21], Empfängern von Blut (z. B. durch Bluttransfusionen) und heterosexuellen Drogenabhängigen auftrat, was neben sexueller auch eine parenterale Übertragung nahelegt. Aus diesem Grund wurde die Krankheit ab August 1982 unter ihrem neuen Namen „AIDS“ [1] bzw. im französischen Sprachraum „Syndrome d'Immuno-Déficience Acquise“ (SIDA) referenziert.
In Deutschland wurde die Krankheit erstmalig 1982 bei einem Patienten aus Frankfurt am Main diagnostiziert.
1983 isolierte eine französische Forschergruppe um Luc Montagnier ein zuvor unbekanntes Retrovirus, das Lymphadenopathie-Virus (LAV), das sie als Ursache für Aids vermuteten. [22] Eine kausale Beziehung zwischen dem Virus und der Immunschwächeerkrankung wurde kurze Zeit später behauptet. Im selben Jahr wurde in Berlin die AIDS-Hilfe gegründet. 1984 wurde im US-Krebsinstitut ein bei Aids-Patienten entdecktes Virus Human T-cell Lymphotropic Virus-III (HTLV-III) genannt.[23]Im März 1985 stellte sich aufgrund weiterer Berichte zu LAV und HTLV-III heraus, dass diese identisch sind. 1985 erhielt Robert Gallo das US-Patent für den ersten ELISA-Antikörper-Test, der von der US-Zulassungsbehörde zugelassen wurde. Im gleichen Jahr fand in Atlanta (USA) die erste Welt-Aids-Konferenz statt.
Im Jahr 1986 wurde für den Virus der Name Humanes Immundefizit Virus (HIV) etabliert. Ein Jahr später, 1987, wurde mit AZT (Retrovir) das erste Therapeutikum zugelassen. In einer Studie hatte es die Sterberate unter HIV stark reduziert. Im Jahr 1988 wurde von der WHO der 1. Dezember zum Welt-Aids-Tag erklärt. 1989 wurde bei HIV-Patienten die Pentamidin-Inhalation zur Prophylaxe der Pneumocystis-carinii-Pneumonie eingeführt.
Im Jahr 1990 wurde aus Protest gegen die Diskriminierung von HIV-Infizierten auf der Aids-Konferenz in San Francisco das Red Ribbon, ein rotes Armband etabliert. Ein Jahr später wurde die Rote Schleife international zum Symbol für den Kampf gegen Aids. 1992 wurde aufgrund der US-Einreisebestimmungen der Welt-Aids-Kongress von Boston nach Amsterdam verlegt. Außerdem wurde im Gedenken an Freddie Mercury von den verbleibenden Queen-Mitgliedern die Stiftung Mercury Phoenix Trust gegründet.
In der frühen Therapie HIV-Infizierter ergab sich 1993 in einer Studie kein Überlebensvorteil mit der AZT-Therapie. 1994 wurde HIV-PCR als wichtiger Marker für die Therapiekontrolle des Infektionsverlaufes etabliert. Im folgenden Jahr, 1995, kam der erste Protease-Hemmer, Saquinavir, in den USA auf den Markt. Im folgenden Jahr wurde Nevirapin als erster nicht-nukleosidischer Reverse-Transkriptase-Hemmer zugelassen. Durch die intensive Kombitherapie nahm die Sterberate in den USA 1997 drastisch ab. 2003 wurde mit Enfuvirtid (Fuzeon) der erste Fusionshemmer in den USA zugelassen. 2004 wurde von der WHO die Initiative 3 by 5 gestartet: 3 Millionen Infizierte sollten im Jahr 2005 mit Medikamenten versorgt werden.
Zu Anfang galt die Erkrankung in der öffentlichen Wahrnehmung als Problem von „Randgruppen“ wie Homosexuellen und Drogenabhängigen. Dies änderte sich jedoch auf dramatische Weise durch das Aufkommen von HIV-Tests. Denn auch Menschen ohne klinische Symptome hatten Antikörper, was auf eine Inkubationszeit von mehreren Jahren hindeutete, in der das Virus möglicherweise auch weitergegeben wurde. 1984 ergaben Untersuchungen, dass Aids in Kinshasa bei Männern und Frauen gleich häufig auftrat, unabhängig von Drogenkonsum und Bluttransfusionen.
In den USA wurde 1985 berichtet, dass bei untersuchten Hämophiliekranken („Blutern“), die sich durch Blutkonserven infiziert hatten, die Ansteckungsrate der Ehefrauen bei 70 % lag. Die Erkenntnis, dass die Ansteckungsgefahr bei heterosexuellem Geschlechtsverkehr deutlich höher zu sein schien als zunächst angenommen, führte zu einem großen öffentlichen Interesse. Die Kombination aus den nun bekannten Ansteckungswegen und langer Inkubationszeit ließen epidemiologische Hochrechnungen ein apokalyptisches Bild zeichnen. Eine geschichtlich einmalige Massenhysterie breitete sich aus: Aids schien zu einer Bedrohung der Menschheit geworden zu sein.
Die jährliche Verdopplung von Neuerkrankungen hielt in Deutschland nur von 1984 bis 1987 an, danach verlief der Anstieg der Zahl von Erkrankten weniger steil, bis sich die Zahlen im Jahre 1993 auf ca. 2000 einpendelte. Dadurch änderte sich auch schnell wieder das öffentliche Interesse an Aids. 2003 steckten sich weltweit ungefähr 4,8 Millionen Menschen neu mit dem Virus an, im selben Jahr starben circa 2,9 Millionen Menschen daran.
Verbreitung des HI-Virus
Allgemein

Aus epidemiologischer Sicht ist das weltweite Verteilungsmuster von HIV interessant: Während sich die meisten Viren gleichmäßig schnell ausbreiten, war dies bei HIV anders. Während die HIV-Epidemie in den USA bereits vor 20 Jahren begann, gab es einige Länder, die von HIV verschont zu sein schienen, dann aber mit großer Geschwindigkeit vom Virus erobert wurden. So geschah es vor allem in Osteuropa und Asien Mitte der 1990er Jahre. In anderen Ländern, zum Beispiel Kamerun, blieb die Prävalenz von HIV Jahre lang stabil, um dann sprunghaft anzusteigen. Auch eine Obergrenze in der HIV-Prävalenz scheint es nicht zu geben. So stieg die Quote der schwangeren Frauen mit HIV in städtischen Zentren in Botswana nach 1997 in vier Jahren von 38,5 % auf 55,6 %.
Dass HIV erfolgreich zu bekämpfen ist, zeigt das Beispiel Uganda. 1992 lag die Prävalenz von HIV bei schwangeren Frauen bei nahezu 30 % und konnte auf 10 % im Jahre 2000 gesenkt werden. Grundlagen dieses Erfolges waren die landesweite Einführung von Sexualkundeunterricht, flächendeckende Kampagnen zur Steigerung der Akzeptanz von Kondomen, HIV-Tests, deren Ergebnisse noch am selben Tag bekannt gegeben wurden und Selbsthilfe-Kits für sexuell übertragbare Krankheiten. Diese Erfolge sind jedoch nur mit finanziellen Mitteln durchführbar, die viele der Hochendemie-Länder in Afrika nicht allein aufbringen können. Unabdingbar ist ferner ebenso ein politischer Wille, diese Seuche aktiv zu bekämpfen.
Weltweit
| Mit HIV/Aids lebende Personen | Neuinfektionen | Todesfälle | Todesfälle aufsummiert | Quelle | |
|---|---|---|---|---|---|
| 1980 | (~ 2.000.000)1 | - | - | - | - |
| 1993 | (12.900.000)1 | - | - | (2.500.000)1 | - |
| 1999 | - | 4.000.000 | - | - | - |
| 2000 | - | 3.800.000 | - | - | - |
| 2001 | 34.900.000 (40.000.000)1 | 3.400.000 | 2.500.000 | 20 - 22 Mio | - |
| 2002 | - (42.000.000)1 | 3.500.000 | 3.100.000 | ~ 21.1 Mio | - |
| 2003 | 37.800.000 | 4.800.000 | 2.900.000 | ~ 24.0 Mio | - |
| 2004 | 39.400.000 | 4.900.000 | 3.100.000 | ~ 27.1 Mio | - |
| 2005 | 40.300.000 | 4.900.000 | 3.100.000 | > 25 Mio | Aids epidemic update December 2005 (UNAIDS) |
| 2006 | 38.600.000 | 4.100.000 | 3.100.000 | > 25 Mio | Aids epidemic update December 2005 (UNAIDS), Tagesschau-Meldung |
1Bei der Berechnung der Gesamtzahl aller Infektionen wandte UNAIDS ab 2004 eine neue Methodik an, die eine relative Korrektur der Zahlen nach unten nach sich zog. Nach alter Methodik ermittelte Zahlen sind zur Unterscheidung kursiv gesetzt, für 2001 finden sich zum Vergleich beide Werte angegeben, ein korrigierter Wert für 2002 ist nicht bekannt.
| Globale Verteilung | 2001 | 2002 | 2003 | 2004 | 2005 |
|---|---|---|---|---|---|
| Subsahara-Afrika | 23,8 Millionen | 24,4 Millionen | 25,0 Millionen | 25,4 Millionen | 25,8 Millionen |
| Süd- & Südostasien | 5,9 Millionen | 6,4 Millionen | 6,5 Millionen | 7,1 Millionen | 7,4 Millionen |
| Latein-Amerika | 1,4 Millionen | 1,5 Millionen | 1,6 Millionen | 1,7 Millionen | 1,8 Millionen |
| Osteuropa & Zentralasien | 890.000 | 1,0 Millionen | 1,3 Millionen | 1,4 Millionen | 1,6 Millionen |
| Ostasien | 680.000 | 760.000 | 900.000 | 1,1 Millionen | 870.000 |
| Nordamerika | 950.000 | 970.000 | 1 Million | 1 Million | 1,2 Million |
| West- und Zentraleuropa | 540.000 | 600.000 | 580.000 | 610.000 | 720.000 |
| Nordafrika und Naher Osten | 340.000 | 430.000 | 480.000 | 540.000 | 510.000 |
| Karibik | 400.000 | 420.000 | 430.000 | 440.000 | 300.000 |
| Ozeanien | 24.000 | 28.000 | 32.000 | 35.000 | 74.000 |
Alle Zahlen von UNAIDS
Im südlichen Afrika ist die Rate am höchsten. Die Rate der schwangeren HIV-Infizierten unter 20 Jahren ist in Südafrika auf 15,4 % gesunken (1998: 21 %); dies bedeutet, dass Aufklärungsprogramme langsam Erfolge zeigen. Jedoch sind die Aids-Raten bei älteren Frauen immer noch sehr hoch. 32 % der Frauen zwischen 24 und 29 Jahren sind derzeitig mit der Krankheit infiziert. Insgesamt sind 20 % der Bevölkerung Südafrikas mit HIV infiziert. Das Land mit der weltweit höchsten Aids-Rate ist das benachbarte Swasiland, wo 2005 42 % der Bevölkerung infiziert waren.
Deutschland
Die Zahl der Neuinfektionen lag einige Jahre relativ konstant bei knapp 2.000 pro Jahr. In letzter Zeit wird eine Steigerung der Infektionszahlen beobachtet. Ende 2006 betrug die Zahl der Neuinfizierten in Deutschland ca. 2.700; insgesamt lebten ca. 56.000 HIV-infizierte Menschen in der Bundesrepublik, davon 47.000 Männer und 8.500 Frauen sowie ca. 400 Kinder. 8.700 von ihnen leben mit Aids.
Von den 2.700 Neuinfizierten waren ca. 81% Männer; geschätzte 70% von ihnen sind Männer, die Sex mit Männern hatten, 20% waren Übertragungen durch heterosexuellen Sex, 9% Infektionen durch infizierte Spritzen bei Drogenmissbrauch und 1% Übertragungen von der Mutter auf das Kind, meist während der Geburt.
Die Zahl der neu an Aids Erkrankten lag Ende 2006 bei 1.200 (Vorjahr: 850). Etwa 600 Menschen sind bis Ende 2006 an den Folgen einer HIV-Infektion beziehungsweise an Aids verstorben. Von Anfang der 1980er Jahre bis 2006 haben sich in der Bundesrepublik Deutschland etwa 82.000 Menschen mit HIV infiziert, etwa 32.500 Menschen sind an Aids erkrankt und etwa 26.000 sind an den Folgen der HIV-Infektion gestorben.
Die vom Robert-Koch-Institut ermittelten Daten zur Verbreitung von HIV und Aids sind nur begrenzt mit früher publizierten Schätzungen vergleichbar, da zusätzliche Daten und Informationen sowie die Anpassung der Erhebungsmethodik die Berechnungen von Jahr zu Jahr verändern.
Es gibt Befürchtungen, dass die Infizierungsrate ansteigt, da zum einen die Aufklärungswelle der 1990er-Jahre verebbt sei und sich zum anderen gerade bei Jugendlichen zwischen 13 und 16 Jahren eine erstaunliche Unkenntnis in Bezug auf die latente Ansteckungsgefahr beim ungeschützten Sexualakt zeigt. So behauptet erschreckenderweise jeder fünfte Jugendliche, dass man einem HIV-Positiven „die Krankheit ansehen könne“. Hinzu kommt eine Verharmlosung und gelegentliche Faszination von Gefahren, die bei manchen zu bewusst risikoreicherem Verhalten (Barebacking) führt.
Grund zur Besorgnis gibt weiterhin der kontinuierliche Anstieg von anderen sexuell übertragbaren Krankheiten. Nicht nur, dass sich damit das Risiko einer Ansteckung erhöht, es zeigt auch, dass die Akzeptanz von Kondomen rückläufig zu sein scheint. Diese Befürchtungen werden bestärkt durch die Tatsache, dass sich laut des Berliner Robert-Koch-Instituts (RKI) in den ersten acht Monaten des Jahres 2005 zwanzig Prozent mehr Menschen mit HIV angesteckt haben als im vergleichbaren Zeitraum des Vorjahres.
Mehr als 80 Prozent sind Männer und nahezu 70 Prozent der Gesamtzahl sind Männer, die gleichgeschlechtliche Kontakte hatten. Das Infektionsrisiko für diese Männer ist damit doppelt so groß wie vor fünf Jahren - und so hoch wie seit dreizehn Jahren nicht mehr.
Österreich
Ende 2004 lebten etwa 9.400 HIV-Infizierte in Österreich, mehr als die Hälfte davon in Wien. Die Zahl der Neuinfizierungen beträgt seit 2003 etwa 450 pro Jahr. Die niedrigste Rate war 1997 mit 297, die höchste 1993 mit 561 Neuinfektionen. Der Anstieg der Neuinfektionen kann durch das Ende der Aufklärungswelle der 1990er-Jahre erklärt werden.
Zwischen 1983 und 1. Dezember 2005 sind in Österreich 2.463 Menschen an Aids erkrankt und 1.418 gestorben. Von 2003 mit 50 neuen Erkrankungen, stiegen sie im Jahr 2004 auf 65 an.
Im Vergleich der ersten drei Quartale, stiegen die HIV-Neuinfektionen von 317 im Jahr 2003 auf 364 in den Jahren 2004 und 2005 an.
Schweiz
In der Schweiz wurden im Jahr 2005 702 positive HIV-Tests gemeldet. Seit 2002 hat die Anzahl der Neuansteckungen von 791 leicht abgenommen. Besonders stark betroffen sind die Kantone Zürich, Waadt und Genf.
Ansteckungen
Bei den Männern sind 2005 die meisten Ansteckungen mit 49,1 % nach homosexuellem Geschlechtsverkehr zu verzeichnen. Seit 2003 zeigt sich in dieser Gruppe eine Zunahme von 13,9 % und bewegt sich damit über dem Höchststand von 1994. Die Anzahl der Ansteckungen nach heterosexuellem Kontakt folgt mit 38,1 %. Diese Gruppe stieg nach 2002 wieder an, sank aber 2005 wieder und scheint sich auf gleichbleibend hohem Niveau zu halten. Die Ansteckungen nach Drogenkonsum sinken seit 2003 weiter auf 9,7 %.
Bei den Frauen ist das Ansteckungsrisiko bei heterosexuellem Kontakt mit 80,6 % am größten und stieg seit 2002 um 10,7 %. Die Infizierungen nach Drogenkonsum bleiben mit 11,1 % auf konstantem Niveau.
Bei Ansteckungen nach homosexuellen Kontakten sind hauptsächlich Bürger aus der Schweiz mit etwa 72 % betroffen, gefolgt mit 15 % von Personen aus der EU. Das Verhältnis bewegt sich bei Ansteckungen nach Drogenkonsum etwa im gleichen Verhältnis (63 % aus der Schweiz und 20,4 % EU). Bei den heterosexuellen Beziehungen zeigt sich jedoch ein stark größerer Anteil an ausländischen Personen. Besonders stark betroffen sind Personen aus der Subsahara mit 41 %.
Aids in Afrika
Hauptartikel: Aids in Afrika
Ausbreitung
Die Aids-Pandemie hat ihre schlimmsten Ausmaße südlich der Sahara. Hier leben 26 Millionen Menschen mit einer HIV-Infektion. In einigen Ländern hat sich durch die Immunschwächeerkrankung die Lebenserwartung um mehr als zehn Jahre gesenkt. Warum sich die Erkrankung hier so viel schneller verbreitet, ist nicht ganz geklärt.
Es scheint einige Faktoren zu geben, die die Ausbreitung des HI-Virus begünstigen: während in Europa und Nordamerika schon kurz nach der Entdeckung des HI-Virus die Massenmedien große Teile der Bevölkerung mit Informationskampagnen über die tödlichen Gefahren einer HIV-Infektion und Prävention informierten, blieb Aids in vielen Teilen Afrikas ein Tabuthema. So hatte das HI-Virus fast zwanzig Jahre mehr Zeit, sich ungehindert auszubreiten.
Kritik an den vorherrschenden Erklärungen
Wissenschaftliche Vorbehalte
Einige Wissenschafter sind der Auffassung, dass die im weltweiten Wissenschaftsbetrieb vorherrschende virale Aids-Erklärung einer wissenschaftlichen Prüfung nicht standhält (vgl. Aids-Dissidenten). Dazu gehören insbesondere der Retrovirologe Peter Duesberg und der Chemie-Nobelpreisträger Kary Mullis. Duesberg war 2001 Mitglied der südafrikanischen Aids-Beratungskommission (s. Dokumente). Mullis entdeckte 1983 das PCR-Verfahren, mit dem u. a. HI-Viren im Körper von Betroffenen nachgewiesen werden.
Die Kritiker haben sich in der Group for the Scientific Reappraisal of the HIV-Aids Hypothesis (Gruppe für die wissenschaftliche Überprüfung der HIV-Aids-Hypothese) zusammengefunden. Die Gruppe benennt hauptsächlich harte Drogen, Unterernährung und die Einnahme hochtoxischer antiviraler Medikamente als Aids-Ursache. Obwohl alle Mitglieder von einer nichtviralen Aidsursache ausgehen, propagiert die Gruppe keine Einheitslehre. Duesberg und Mullis bestreiten weder die Existenz noch die Übertragbarkeit des HIV, aber sie halten das Virus für harmlos. Mitglieder der australischen Perth Group, einer Untergruppe, stellen hingegen sogar in Frage, dass sich HI-Viren im menschlichen Körper nachweisen lassen.
Verschwörungstheorien
Der hauptsächlich in der DDR wirkende Biologe Jakob Segal (1911-1995) stellte 1987, noch während des Kalten Krieges die Behauptung auf, dass das HI-Virus nicht von Affen stamme, sondern in den Labors US-amerikanischer Mikrobiologen für militärische Zwecke künstlich hergestellt worden sei - eine Basis vieler Verschwörungstheorien, die Aids als eine gegen bestimmte Personengruppen eingesetzte Biowaffe sehen. So ist beispielsweise in einigen afrikanischen Ländern die These gängig, dass westliche Rassisten die Krankheit Aids auf ihren Kontinent gebracht haben, um die dortige Bevölkerung zu dezimieren und den Rohstoffreichtum mit Hilfe von korrupten Regimes neo-kolonialistisch auszubeuten. Die Verschwörungstheorie soll vom sowjetischen Geheimdienst KGB in die Welt gesetzt worden sein, um die Stimmung in Afrika antiamerikanisch zu beeinflussen.
Sozialethische Beurteilung
Das Krankheitssyndrom Aids hat sich weltweit zu einer ernsten Herausforderung für direkt Betroffene, für die medizinische Wissenschaft, aber auch für all jene, die derartige Patienten zu betreuen haben oder mit ihnen zusammenleben müssen, entwickelt.
Fernab von jeder Stigmatisierung aidskranker Patienten gilt es, Mittel und Wege zu finden, ihnen besser wirksam zu helfen: Sei es durch immer noch nicht ausreichend verfügbare therapeutische Maßnahmen, sei es im Sinn der symptomatischen Therapie und palliativen Medizin. Geboten ist zudem umfassende und wirksame Prävention.
Die Suche nach einer ethisch vertretbaren Aids-Bekämpfungsstrategie führt zu teils gegenteiligen Ergebnissen: Die einen betonen die unbedingte Notwendigkeit eines ausschließlich oder doch primär „technischen“ Schutzes gegen die Ausbreitung der Krankheit. Andere sehen diese Antwort als nicht ausreichend an bzw. lehnen diese aus Gründen einer religiösen Ethik ab. Sie betonen den Wert der dauerhaften ehelichen Treue neu bzw. fordern im konkreten Fall auch zeitweise oder völlige Enthaltsamkeit ein. Die Propagierung von Kondomen als Schutz gegen Aids sei vom religiös-christlichen Standpunkt aus bedenklich. Man argumentiert, auf diese Weise werde ein mit Promiskuität und gewissen sexuellen Praktiken assoziierter verantwortungsloser Lebensstil gefördert, der die eigene Person sowie andere Menschen einer todbringenden Gefahr aussetze.
Gegenwart/Aktuelles
Aids hat sich infolge der Einführung von HAART in den westlichen Industriestaaten von einer auf jeden Fall tödlichen zu einer chronischen Krankheit entwickelt, die nicht mehr notwendigerweise zum Tod führt. In Deutschland sterben nur noch wenige Menschen an AIDS, bei denen die HAART keine Wirkung mehr hat. AIDS ist behandelbar, aber nicht heilbar. Demgegenüber sterben in Drittweltstaaten Menschen an Aids, da die medizinische Versorgung nicht oder nicht ausreichend vorhanden ist bzw. die Medikamente zu teuer oder nicht vorrätig sind.
Literatur/Medien
Bücher (wissenschaftliche Sicht)
- Dilger, Hansjoerg: Leben mit Aids. Krankheit, Tod und soziale Beziehungen in Afrika. Eine Ethnographie. Campus, Frankfurt a. M., 2005. ISBN 3593377160
- Stratton, Allan: Worüber keiner spricht, Deutscher Taschenbuch Verlag, 2005, ISBN 3-423-78204-8
- UNAIDS: 2004 Report on the Global HIV/AIDS Epidemic: 4th Global Report, Genf, 2004, ISBN 92-9173-355-5
- Bogner, Schirin: Ich wollte hundert Jahre alt werden, 2002, ISBN 3404615115
- Michael T. Ford: Viren sind nicht wählerisch. AIDS - Fragen, Antworten, Erfahrungen., dtv, 1999, ISBN 3-4237-8139-4
- Christian Fiala: Lieben wir gefährlich? Ein Arzt auf der Suche nach Fakten und Hintergründen von Aids, Deuticke, 1997
- Geisler, Wolff: AIDS, Herkunft, Verbreitung und Heilung, Bipawo Verlag, 1994, ISBN 3-9803883-1-X
- Kiper, Manuel: Seuchengefahr aus der Retorte, rororo Tb Verlag GmbH, 1992 ISBN 3-499-13119-6
- Koch, Egmont R.; Meichsner, Irene: BÖSES BLUT. Die Geschichte eines Medizin-Skandals. Hamburg: Hoffmann und Campe, (1990) ²1993. ISBN 3-455-10312-X.
- Shilts, Randy: AIDS. Die Geschichte eines großen Versagens, 1989, ISBN 3442114861
Bücher (HIV-Denialists)
- Peter Duesberg/Kary Mullis (Vorwort): Inventing the AIDS Virus, Regnery Publishing, 1997, ISBN 0895263998
- Torsten Engelbrecht/Claus Köhnlein: Virus-Wahn. Vogelgrippe (H5N1), SARS, BSE, Hepatitis C, AIDS: Wie die Medizin-Industrie ständig Seuchen erfindet und auf Kosten der Allgemeinheit Milliarden-Profite macht, emu-Verlag, 2006, ISBN 3891891474 Buchvorstellung des Verlages
Bücher (sonstige)
- Edward Hooper: The River, A Journey to the Source of HIV and AIDS. Little, Brown and Company, New York City. ISBN 0316372617 ISBN 0713993359 ISBN 0920674232 ISBN 0140283773 ISBN 0316371378 – über die Verbreitung von HIV durch Polio-Impfstoffe (Englisch).
Aufsätze
- Engelbrecht, Torsten: Sex, Blut und Tod: ‚HIV verursacht AIDS.‘ An der Verfestigung dieses Theorems lässt sich zeigen, wie der Wissenschafts-Journalismus folgenreiche Widersprüche ausblendet und Zweifel wegdrückt. Message (deutsche Medienfachzeitschrift, siehe www.message-online.com), Januar 2005 (siehe http://www.torstenengelbrecht.com/artikel_medien/4_aids_low.pdf)
- Ilse Zündorf: Entdeckung und Ursprung des HI-Virus. Pharmazie in unserer Zeit 30(3), S. 190 - 192 (2001), ISSN 0048-3664
- Ilse Zündorf, Theo Dingermann: Struktur des HI-Virus. Pharmazie in unserer Zeit 30(3), S. 202 - 207 (2001), ISSN 0048-3664
- H. Leisch: Die AIDS-Pandemie - regionale Auswirkungen einer globalen Seuche. Geographische Rundschau 53(2), S. 26 - 31 (2001), ISSN 0016-7460
Zeitschriften
- African Journal Of Aids Research (Grahamstown, Südafrika)
Filme
Spielfilme
- Früher Frost (erster TV Film zum Thema), 1985, IMDb
- Buddies, 1985, IMDb
- Abschiedsblicke (Parting Glances), 1986, IMDb
- Longtime Companion, 1990, IMDb
- Wilde Nächte, 1992
- Philadelphia, 1993
- ...und das Leben geht weiter, 1994, IMDb
- Milch und Zucker, 1994
- Kids, 1995, IMDb
- Jeffrey, 1995
- It's my Party, 1996, IMDb
- Liebe! Stärke! Mitgefühl!, 1997
- Relax... It's Just Sex, 1998, IMDb
- Fickende Fische, 2002, IMDb
- Rent, 2005, IMDb
- Mississippi- Fluss der Hoffnung,1995
- Transit, MTV-Film
Dokumentationen
- Sindis letzte Chance: Billige AIDS-Medikamente für Südafrika, WDR 2001
- Tödlicher Ausverkauf: Wie AIDS nach Asien kam, WDR 2004
- Poppenberg, Fritz: Die AIDS-Rebellen, 1992, Dokumentation
- Tahi, Djamel: AIDS - Die großen Zweifel, Dokumentation (komplette Doku auf Deutsch: siehe 9. Tiger-Icon - das auf dem „VIDEO“-Sockel - von oben neben dem Text „arte-Doku ‚AIDS - Die großen Zweifel‘ von Djamel Tahi“ auf dieser Seite: http://www.torstenengelbrecht.com/de/artikel_medien.html)
- Hoya, Konrad: Fehldiagnose AIDS? - Teil 1: Wissenschaftliche Hintergründe, Dokumentation
- Hoya, Konrad: Fehldiagnose AIDS? - Teil 2: Medizinische und soziale Folgen, Dokumentation
- Teboho Edkins: Ask me, I'm positive, 2003, Dokumentation im Rahmen des Projekts steps for the future
- Talk mit J. B. Kerner im ZDF zu Aids in Osteuropa
Siehe auch
Referenzen
- ↑ a b Marx, J. L.: New disease baffles medical community. In: Science. 217. Jahrgang, Nr. 4560, 1982, Vorlage:PMID, S. 618–621.
- ↑ UNAIDS: 2006 Report on the global AIDS epidemic. 2006, Overview of the global AIDS epidemic.
- ↑ E.M. Lackritz et al.: „Estimated Risk of Transmission of the Human Immunodeficiency Virus by Screened Blood in the United States“. In: New England Journal of Medicine. 333. Jahrgang, Nr. 26, 1995, Vorlage:PMID, S. 1721–1725.
- ↑ a b A. Plettenberg et al.: „HIV-PEP State of the art“. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. 43. Jahrgang, Nr. 13, 2000, DOI, S. 18–25.
- ↑ HIV and Its Transmission, CDC
- ↑ Roche: HIV FAQ´s und Tipps
- ↑ Kleinman et al: False-Positive HIV-1 Test Results in a Low-Risk Screening Setting of Voluntary Blood Donation. In: JAMA. 280. Jahrgang, Nr. 12, 1998, Vorlage:PMID, S. 1080–1085.
- ↑ Ruby Phelps et al.: Window-period human immunodeficiency virus transmission to two recipients by an adolescent blood donor. In: Transfusion. Bd. 44, Nr. 6, 2004, S. 929-933, ISSN 0041-1132.
- ↑ Centers for Disease Control and Prevention: 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. In: JAMA. 269. Jahrgang, Nr. 6, 1993, Vorlage:PMID, S. 729–730.
- ↑ Hecht, F. M. et al.: Use of laboratory tests and clinical symptoms for identification of primary HIV infection. In: AIDS. 16. Jahrgang, Nr. 8, 2002, Vorlage:PMID, S. 1119–1129.
- ↑ Torre, D. et al: Nevirapine or efavirenz combined with two nucleoside reverse transcriptase inhibitors compared to HAART: a meta-analysis of randomized clinical trials. In: HIV Clinical Trials. 2. Jahrgang, Nr. 2, 2001, Vorlage:PMID, S. 113–121.
- ↑ Fumaz, C. R. et al.: Quality of life, emotional status, and adherence of HIV-1-infected patients treated with efavirenz versus protease inhibitor-containing regimens. In: Journal of acquired immune deficiency syndromes. 29. Jahrgang, Nr. 3, 2002, Vorlage:PMID, S. 244–253.
- ↑ Dauer, B.: Protease inhibitors: the current status. In: Journal of HIV Therapy. 10. Jahrgang, Nr. 4, 2005, Vorlage:PMID, S. 72–74.
- ↑ Brinkman, K et al: Mitochondrial toxicity induced by nucleoside-analogue reverse-transcriptase inhibitors is a key factor in the pathogenesis of antiretroviral-therapy-related lipodystrophy. In: Lancet. 354. Jahrgang, Nr. 9184, 1999, Vorlage:PMID, S. 1112–1115.
- ↑ Oldfield, V. Plosker, G. L.: Lopinavir/Ritonavir: a review of its use in the management of HIV infection. In: Drugs. 66. Jahrgang, Nr. 9, 2006, Vorlage:PMID, S. 1275–1299.
- ↑ J. P. Lalezari et al.: „Enfuvirtide, an HIV-1 Fusion Inhibitor, for Drug-Resistant HIV Infection in North and South America“. In: New England Journal of Medicine. 348. Jahrgang, Nr. 22, 2003, Vorlage:PMID, S. 2175–2185.
- ↑ T. Zhu, B. T. Korber, A. J. Nahmias, E. Hooper, P. M. Sharp, D. D. Ho: „An African HIV-1 sequence from 1959 and implications for the origin of the epidemic“. In: Nature. 391. Jahrgang, Nr. 1998-02-05, 1998, Vorlage:PMID, S. 594–597.
- ↑ „Epidemiologic Notes and Reports: Pneumocystis Pneumonia --- Los Angeles.“, Morbidity and Mortality Weekly Report, 5. Juni 1981 / 30(21);1-3
- ↑ „Epidemiologic Notes and Reports Update on Kaposi's Sarcoma and Opportunistic Infections in Previously Healthy Persons -- United States“, Morbidity and Mortality Weekly Report, 11. Juni 1982 / 31(22);294,300-1
- ↑ „A Cluster of Kaposi's Sarcoma and Pneumocystis carinii Pneumonia among Homosexual Male Residents of Los Angeles and range Counties, California“, Morbidity and Mortality Weekly Report, 18. Juni 1982 / 31(23);305-7
- ↑ „Epidemiologic Notes and Reports Pneumocystis carinii Pneumonia among Persons with Hemophilia A“, Morbidity and Mortality Weekly Report, 16. Juli 1982 / 31(27);365-7
- ↑ F. Barre-Sinoussi et al.: „Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)“. In: Science. 220. Jahrgang, Nr. 4599, 1983, Vorlage:PMID, S. 868–871.
- ↑ Popovic et al.: „Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS“. In: Science. 224. Jahrgang, Nr. 4648, 1984, Vorlage:PMID, S. 497–500.
Weblinks
- Deutsche Aids-Hilfe (mit Kontaktadressen)
- www.aidsonline.de Online Beratung
- Das HIV-NET, u. a. eine 800-Seiten-Publikation zu AIDS und HIV zum Downloaden
- AIDS-Informationsseite der Vereinten Nationen (Englisch)
Kritiker der viralen Aids-Erklärung
- The Perth Group (Prof. Eleni Papadopulos-Eleopulos et al.) (englisch)
- AIDS Wiki (englisch)
- Huw Christie interviewt Dr. Valendar F. Turner
Dokumente
- Abschlussbericht der südafrikanischen AIDS-Expertenkommission 2001 (Mitglieder waren Verfechter und Kritiker der viralen Aids-Erklärung, so u. a. Luc Montagnier und Peter Duesberg) (PDF-Datei, englisch)
Eine Entgegnung des Robert-Koch-Instituts:




