„Kupfersulfat“ – Versionsunterschied
| [gesichtete Version] | [ungesichtete Version] |
Diba (Diskussion | Beiträge) K Änderungen von 93.232.150.199 (Diskussion) wurden auf die letzte Version von JWBE zurückgesetzt (HG) | |||
| Zeile 63: | Zeile 63: | ||
=== Hydrate === | === Hydrate === | ||
fuck jan | |||
Neben der wasserfreien Verbindung treten noch [[kristallwasser]]haltige Kupfer(II)-sulfat-Hydrate auf. Am geläufigsten ist das Pentahydrat (CuSO<sub>4</sub> · 5 H<sub>2</sub>O). Weiterhin existieren auch ein Trihydrat (CuSO<sub>4</sub> · 3 H<sub>2</sub>O) und Kupfer(II)-sulfat-Monohydrat (CuSO<sub>4</sub> · H<sub>2</sub>O). Nachfolgend sind die Eigenschaften der Hydrate aufgeführt, die von denen der wasserfreien Verbindung abweichen, sofern diese zur Verfügung standen. | |||
==== Kupfer(II)-sulfat-Pentahydrat ==== | |||
[[Datei:Cuso4 5h2o.PNG|miniatur|left|Kristallwasserverlust bei CuSO<sub>4</sub> · 5 H<sub>2</sub>O ([[Thermogravimetrie|TGA]]/[[Differential-Thermoanalyse|DTA]])]] | |||
Kupfersulfat-Pentahydrat CuSO<sub>4</sub> · 5 H<sub>2</sub>O (Kupfer(II)-tetraoxosulfat(VI)-Pentahydrat, Mineralname: [[Chalkanthit]]) bildet [[Triklines Kristallsystem|trikline]] [[Kristall]]e mit blauer Farbe, die beim Erhitzen nach und nach ihr [[Kristallwasser]] abgeben und schließlich zu farblosem Kupfersulfat-Anhydrat werden. Bei 95 °C spalten sich zwei Wassermoleküle ab, es entsteht das Trihydrat. Weitere zwei Wassermoleküle werden bei 116 °C abgespalten, das letzte bei 200 °C, dabei verlieren die Kristalle ihre blaue Farbe und werden zu farblosem Kupfersulfat CuSO<sub>4</sub>. Dieser Vorgang ist umkehrbar, beim Auflösen des wasserfreien Anhydrats in Wasser färbt sich die Lösung durch [[Hydratation]] der Cu<sup>2+</sup>-Ionen blau und erwärmt sich dabei ([[Hydrationsenergie]]). Aus der Lösung kann durch Verdunstung des Wassers wieder das blaue Kupfersulfat-Pentahydrat kristallisieren. Die chemische Formel des Pentahydrats sollte besser gemäß [Cu(H<sub>2</sub>O)<sub>4</sub>]SO<sub>4</sub> · H<sub>2</sub>O geschrieben werden, da in der [[Kristallstruktur]] vier Wassermoleküle direkt an die Kupfer(II)-Ionen koordiniert sind und diese [[Kristallfeld- und Ligandenfeldtheorie#Quadratisch-planare Komplexe|quadratisch-planar]] umgeben. | |||
* Kurzbeschreibung: blauer, geruchloser Feststoff | |||
* Kristallwasserabgabe: 88–245 °C | |||
* thermische Zersetzung: 340–650 °C | |||
* Löslichkeit: leicht löslich in Wasser: 317 g/l | |||
== Verwendung == | == Verwendung == | ||
Version vom 28. August 2012, 10:43 Uhr
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
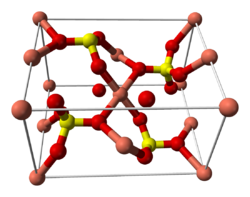 | ||||||||||
| __ Cu2+ __ S __ O | ||||||||||
| Allgemeines | ||||||||||
| Name | Kupfer(II)-sulfat | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | CuSO4 | |||||||||
| Kurzbeschreibung | weißes bis graues, geruchloses Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 159,61 g·mol−1 249,69 g·mol−1 (Pentahydrat) | |||||||||
| Aggregatzustand | fest | |||||||||
| Dichte | 3,60 g·cm−3 | |||||||||
| Schmelzpunkt | Zersetzung bei 560 °C[1] | |||||||||
| Löslichkeit | leicht löslich in Wasser: 203 g·l−1 (20 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK | 0,1 mg·m−3 (gemessen als einatembarer Aerosolteil)[1] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Kupfersulfat, früher auch Kupfervitriol (siehe Vitriole), ist das Kupfersalz der Schwefelsäure und besteht aus Cu2+-Kationen und SO42−-Anionen. Es ist ein farbloser, unbrennbarer Feststoff, der sehr gut wasserlöslich ist. Wasserhaltige Kupfersulfate (Hydrate), zum Beispiel das Kupfer(II)-sulfat-Pentahydrat, haben eine blaue Farbe.
Vorkommen

In der Natur kommt Kupfersulfat als Verwitterungsprodukt sulfidischer Kupfererze als krustenförmige, körnige oder faserige Aggregate vor. Die wasserfreie Form (CuSO4) tritt in der Natur nicht auf, sondern ausschließlich das Kupfersulfat-Pentahydrat (CuSO4 · 5 H2O) als seltenes Mineral Chalkanthit. Aufgrund der sehr guten Wasserlöslichkeit von Kupfersulfat bleibt es jedoch nur in sehr trockenen Klimagebieten erhalten und wird daher nur in Wüsten wie beispielsweise der Atacama (Chile) gefunden.
Gewinnung und Darstellung
Im Labor lässt sich Kupfersulfat beispielsweise aus Kupferhydroxid und Schwefelsäure herstellen:
Technisch wird Kupfersulfat durch Einwirkung von Schwefelsäure auf Kupferoxide oder Kupfersulfide gewonnen.
Kupfersulfat ist das mit Abstand wichtigste Kupfersalz.
Eigenschaften
Kupfersulfat ist in Wasser gut, in den meisten organischen Lösungsmitteln nicht löslich. In Glycerin löst es sich mit smaragdgrüner Farbe. Bei starkem Erhitzen (ab 340 °C) zerfällt das wasserfreie Kupfersulfat in Kupfer(II)-oxid und Schwefeltrioxid.
Hydrate
fuck jan
Verwendung
Kupfersulfat wird für eine Vielzahl von Prozessen und Reaktionen verwendet, so zum Verkupfern, zur Herstellung von kupferhaltigen Farben, zur Kupferstichätzung, in der Medizin als zusammenziehendes (adstringierendes) Mittel, früher auch als Brechmittel (es schmeckt unangenehm bitter, ist aber nicht als ungiftig anzusehen), in Silvester-Raketen (erzeugt einen bläulich-grünen Farbton) und weiteren Anwendungen.
Galvanotechnik
Kupfersulfat wird zur galvanischen Verkupferung in der Galvanotechnik und in Form der Oettelsche Lösung in der Coulometrie zur Bestimmung von exakten Ladungsmengen verwendet.
Kennzeichnung
Kupfersulfat findet man auch als Zusatz in Anreißfarben, welche vor dem Anreißen einer metallischen Oberfläche auf dieselbe gestrichen wird, um den eigentlichen Riss nach dem Anreißen besser sichtbar zu machen.
Pflanzenschutz
Kupfersulfatlösung gemischt mit Calciumhydroxid-Suspension wurde früher als Bordeauxbrühe im Weinbau zur Bekämpfung von Pilzerkrankungen eingesetzt. Heute setzt man Pflanzenschutzmittel ein, die Kupfersulfat oder andere Kupferverbindungen enthalten. Moderne, kupferhaltige Pflanzenschutzmittel sind besser formuliert und haben geringere Konzentration an Kupfersulfat, Kupferoxychlorid, Kupferhydroxid oder Kupferoktanoat. Wegen möglicher Bodenbelastung mit Kupfersalzen wird nach Alternativen gesucht (z. B. Phosphonate).
Der Integrierte Weinbau und der Biologische Weinbau haben die Anzahl der Ausbringungen von kupferhaltigen Mitteln beschränkt. Jedoch haben kupferhaltige Mittel im Bioweinbau eine zentrale Bedeutung bei der Peronosporabekämpfung.
Trocknungsmittel

Das wasserfreie, weiße Kupfersulfat dient als Trocknungsmittel (beispielsweise zur Herstellung von wasserfreiem Ethanol) und zum Nachweis von Wasser, wobei es sich, durch Einlagerung von Kristallwasser, blau färbt.
Kristallzüchtung
Kupfersulfat wird, besonders in der Schule, sehr gerne zum Kristallzüchten verwendet.
Schwimmbäder
In Kombination mit Ammoniumsulfat wird Kupfersulfat gegen Algen in Schwimmbädern eingesetzt. Das Kupfersulfat verfärbt keineswegs das Wasser.
Medizin
Die paramagnetische Eigenschaft von Kupfersulfat macht die Nutzung als Kontrastmittel in der Magnetresonanzspektroskopie (NMR) möglich. Im Deutschen Arzneibuch ist wasserfreies Kupfer(II)-sulfat monographiert, im Europäischen Arzneibuch Kupfer(II)-sulfat-Pentahydrat. Kupfersulfat wurde früher äußerlich als Ätzmittel, als Adstringenz und in der Wundbehandlung, innerlich als Brechmittel, zur Stillung von Blutungen und als Gegenmittel gegen Phosphorvergiftung verwendet. In der Schäferei bzw. Veterinärmedizin wird Kupfersulfat zur Behandlung der Moderhinke, einer bakteriellen Erkrankung der Klauen bei Schafen, eingesetzt.
Biologische Bedeutung
Kupfersulfat ist für lebende Organismen sehr giftig und hat in Gewässern schädliche Wirkungen. Das wassergefährdende Salz ist in der Wassergefährdungsklasse 2 eingestuft.
Sicherheitshinweise
Bei Kontakt mit starken Reduktionsmitteln (z. B. feingepulvertem Magnesium) oder Hydroxylamin kann es zu gefährlichen Reaktionen mit starker Hitzeentwicklung kommen.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Kupfersulfat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
Literatur
- "Weinbau", K. Bauer und Mitarbeiter, 8. Aufl., Österr. Agrarverlag, Wien 2008, ISBN 978-3-7040-2284-4.












