„Cathelicidine“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
+Struktur (Zanetti) | →Biochemie: +Biosynthese | ||
| Zeile 42: | Zeile 42: | ||
== Biochemie == | == Biochemie == | ||
=== Struktur === | === Struktur === | ||
Die strukturell heterogene Familie der Cathelicidine vereinigt Peptide mit einer Länge von 12 bis 80 [[Aminosäure]]bausteinen. Die größte Gruppe der Cathelicidine besteht aus 23 bis 37 Aminosäuren umfassenden Peptiden mit einer [[α-Helix]]-Struktur. Weitere Vertreter dieser Familie sind aus 12 bis 18 Aminosäuren bestehende Peptide mit einer [[β-Schleife]]nstruktur, die über ein oder zwei [[Disulfidbrücke]]n stabilisiert wird, ein aus 13 Aminosäuren bestehendes lineares Peptid und größere, aus 39 bis 80 Aminosäuren bestehende Peptide mit Polyprolinmotiven. Sie alle bestehen aus einer C-terminale [[kation]]ische Domäne, welche nach Abspaltung aus einem [[Holoprotein]] aktiviert wird und für eine antimikrobielle Wirksamkeit verantwortlich ist. | Die strukturell heterogene Familie der Cathelicidine vereinigt antimikrobielle Peptide mit einer Länge von 12 bis 80 [[Aminosäure]]bausteinen. Die größte Gruppe der Cathelicidine besteht aus 23 bis 37 Aminosäuren umfassenden Peptiden mit einer [[α-Helix]]-Struktur. Weitere Vertreter dieser Familie sind aus 12 bis 18 Aminosäuren bestehende Peptide mit einer [[β-Schleife]]nstruktur, die über ein oder zwei [[Disulfidbrücke]]n stabilisiert wird, ein aus 13 Aminosäuren bestehendes lineares Peptid und größere, aus 39 bis 80 Aminosäuren bestehende Peptide mit Polyprolinmotiven. Sie alle bestehen aus einer C-terminale [[kation]]ische Domäne, welche nach Abspaltung aus einem [[Holoprotein]] aktiviert wird und für eine antimikrobielle Wirksamkeit verantwortlich ist. | ||
== Biosynthese == | |||
Die [[Biosynthese]] und Aktivierung der Cathelicidine ist ein mehrstufiger Prozess. Das menschliche Cathelicidin LL-37 wird durch das ''CAMP''-Gen auf dem [[Chromosom 3 (Mensch)|Chromosom 3]] codiert. Primär werden Propeptide, welche eine [[Cathelin]]-Sequenz beinhalten synthetisiert und in den [[Granula]] [[Neutrophiler Granulozyt|neutrophiler Granulozyten]] oder anderer Zellen gespeichert. Nach einer Freisetzung dieser biologisch inaktiven Propeptide werden sie [[enzym]]atisch durch [[Elastase]] oder andere [[Proteinase]]n in ein Cathelin-Peptid und ein C-terminales antimikrobielles Peptid gespalten. | |||
== Literatur == | == Literatur == | ||
Version vom 24. Februar 2011, 22:07 Uhr
| Cathelicidine | ||
|---|---|---|
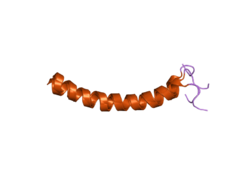 | ||
| 3D-Strukturmodell von LL-37 | ||
Vorhandene Strukturdaten: 2K6O | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 39 aa (FALL-39) 37 aa (LL-37) | |
| Präkursor | (170 aa) | |
| Bezeichner | ||
| Gen-Name | CAMP | |
| Externe IDs | ||
| Transporter-Klassifikation | ||
| TCDB | 1.C.33.1.10 | |
| Bezeichnung | Cathelicidin-Familie (Porine) | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Cathelicidine sind antimikrobielle Peptide, die hauptsächlich in Immunzellen von Wirbeltieren produziert werden und Teil der angeborenen Immunantwort sowie der Apoptose körpereigener Zellen sind. Es handelt sich um Transportproteine, deren Einbau einerseits in die Zellwand gram-positiver Bakterien sowie andererseits in die Zellmembran zu einem Verlust von Ionen und kleinen Molekülen führt. Im Mensch ist das CAMP-Gen bekannt, das für zwei Cathelicidine codiert, die aus einem Vorläuferpeptid herausgeschnitten werden: FALL-39 und LL-37.[2]
Die Produktion von Cathelicidin wird insbesondere durch Stimulation des TLR-9, aber auch TLR-2 und TLR-4 und indirekt durch Vitamin D angeregt.[3][4]
Biochemie
Struktur
Die strukturell heterogene Familie der Cathelicidine vereinigt antimikrobielle Peptide mit einer Länge von 12 bis 80 Aminosäurebausteinen. Die größte Gruppe der Cathelicidine besteht aus 23 bis 37 Aminosäuren umfassenden Peptiden mit einer α-Helix-Struktur. Weitere Vertreter dieser Familie sind aus 12 bis 18 Aminosäuren bestehende Peptide mit einer β-Schleifenstruktur, die über ein oder zwei Disulfidbrücken stabilisiert wird, ein aus 13 Aminosäuren bestehendes lineares Peptid und größere, aus 39 bis 80 Aminosäuren bestehende Peptide mit Polyprolinmotiven. Sie alle bestehen aus einer C-terminale kationische Domäne, welche nach Abspaltung aus einem Holoprotein aktiviert wird und für eine antimikrobielle Wirksamkeit verantwortlich ist.
Biosynthese
Die Biosynthese und Aktivierung der Cathelicidine ist ein mehrstufiger Prozess. Das menschliche Cathelicidin LL-37 wird durch das CAMP-Gen auf dem Chromosom 3 codiert. Primär werden Propeptide, welche eine Cathelin-Sequenz beinhalten synthetisiert und in den Granula neutrophiler Granulozyten oder anderer Zellen gespeichert. Nach einer Freisetzung dieser biologisch inaktiven Propeptide werden sie enzymatisch durch Elastase oder andere Proteinasen in ein Cathelin-Peptid und ein C-terminales antimikrobielles Peptid gespalten.
Literatur
Zanetti M: The role of cathelicidins in the innate host defenses of mammals. In: Curr Issues Mol Biol. 7. Jahrgang, Nr. 2, Juli 2005, S. 179–96, PMID 16053249 (horizonpress.com [PDF]).
Einzelnachweise
- ↑ Suchergebnis Cathelicidine nach Taxonomie
- ↑ UniProt P49913
- ↑ Rivas-Santiago B, Hernandez-Pando R, Carranza C, et al.: Expression of cathelicidin LL-37 during Mycobacterium tuberculosis infection in human alveolar macrophages, monocytes, neutrophils, and epithelial cells. In: Infect. Immun. 76. Jahrgang, Nr. 3, März 2008, S. 935–41, doi:10.1128/IAI.01218-07, PMID 18160480, PMC 2258801 (freier Volltext).
- ↑ Yuk JM, Shin DM, Lee HM, et al.: Vitamin D3 induces autophagy in human monocytes/macrophages via cathelicidin. In: Cell Host Microbe. 6. Jahrgang, Nr. 3, September 2009, S. 231–43, doi:10.1016/j.chom.2009.08.004, PMID 19748465.




