GTP-Cyclohydrolase I
| GTP-Cyclohydrolase I | ||
|---|---|---|
 | ||
| Bändermodell des GCH1-Dekamer nach PDB 1FB1 | ||
Vorhandene Strukturdaten: 1fb1 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 250 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodecamer (2*5) | |
| Kofaktor | Zink | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Namen | GCH1 ; GTPCH1; GCH | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.5.4.16, Hydrolase | |
| Reaktionsart | Hydrolyse zweier C-N-Bindungen und Isomerisierung | |
| Substrat | GTP + H2O | |
| Produkte | 7,8-Dihydroneopterin-3′-triphosphat + Ameisensäure | |
| Vorkommen | ||
| Homologie-Familie | GTPCH1 | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 2643 | 14528 |
| Ensembl | ENSG00000131979 | ENSMUSG00000037580 |
| UniProt | P30793 | Q05915 |
| Refseq (mRNA) | NM_000161 | NM_008102 |
| Refseq (Protein) | NP_000152 | NP_032128 |
| Genlocus | Chr 14: 54.84 – 54.9 Mb | Chr 14: 47.15 – 47.19 Mb |
| PubMed-Suche | 2643 | 14528 |
GTP cyclohydrolase I (GCH1) ist der Name für das Enzym, das GTP zu einer Vorstufe des Biopterin abbaut und damit an der Bildung von Biopterin, einem Coenzym, beteiligt ist. Varianten des Enzyms gibt es in vielen Lebewesen, und im Menschen sind vier Isoformen bekannt, von denen nur eine enzymatische Aktivität hat. Mutationen im GCH1-Gen können die atypische, schwere Form der Phenylketonurie und eine Form der Dystonie, die mit Levodopa behandelbar ist, verursachen.[1]
Katalysiertes Gleichgewicht
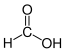
Durch die Hydrolyse von GTP entstehen 7,8-Dihydroneopterin-3′-triphosphat und Ameisensäure.
GCH1 ist verantwortlich für die Hydrolyse von Guanosintriphosphat (GTP), aus welchem es durch die Katalyse dreier Reaktionen ein Abbauprodukt formt, das durch zwei weitere Enzyme zum Tetrahydrobiopterin umgewandelt wird.
Literatur
- D. Voet, J.G. Voet (2004): Biochemistry (3rd ed.). John Wiley & Sons, ISBN 0-471-39223-5