Podoviren
Die Einteilung der Viren in Systematiken ist kontinuierlicher Gegenstand der Forschung. So existieren neben- und nacheinander verschiedene Virusklassifikationen sowie die offizielle Virus-Taxonomie des International Committee on Taxonomy of Viruses (ICTV). Die hier behandelte Gruppe ist als Taxon durch neue Forschungen obsolet geworden oder aus anderen Gründen nicht Teil der offiziellen Virus-Taxonomie.
| Podoviren | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
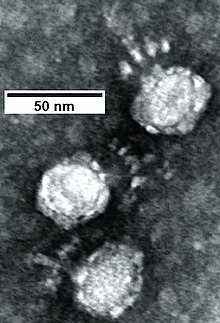
 Typisches Aussehen eines Virusteilchens | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Taxonomische Merkmale | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| „Podoviruses“ | ||||||||||||
| Links | ||||||||||||

Die morphologisch begründete (nicht-taxonomische) Gruppe der Podoviren (englisch podoviruses, früher auch Morphotyp C genannt) umfasst eine Reihe von Familien, Unterfamilien und Gattungen von Viren mit einem linearen Molekül doppelsträngiger DNA (dsDNA) von 16 bis 70 kBp Länge als Genom. Ihre Morphologie ist gekennzeichnet durch ein 50–70 nm im Durchmesser großes ikosaedrisches Kapsid mit einem kurzen, nicht-kontraktilen Schwanzteil von ca. 20 × 8 nm. Je nach Gattung befinden sich am Schwanzteil sechs kurze Schwanzfibern oder mehrere kurze Fortsätze (spikes), Podoviren vom Subtyp 1 haben dagegen keine Anhängsel an Kopf und Schwanz.[2] Das kurze Schwanzteil ist innerhalb der Gruppe der Prokaryoten infizierenden dsDNA-Viren mit Kopf-Schwanz-Struktur charakteristisch für die Podovirien, daher leitet sich der Name für den Morphotyp von griechisch ποδός podos, deutsch ‚Fuß‘ ab.
Die Gattungen der Podovirien unterscheiden sich hinsichtlich der Organisation des Genoms, den Mechanismen der DNA-Verpackung und dem Vorhandensein einer DNA-Polymerase. Die Spezies der Gattung Salasvirus (früher Phi29virus, Phi29likevirus, Φ29-ähnliche Viren) besitzen im Gegensatz zu den anderen ein langgestrecktes, nicht-isometrisches Kapsid. Sie wurde 2021 in die neue Familie Salasmaviridae der Caudoviricetes verschoben.
Die Gruppe galt lange Zeit als ein Virustaxon im Rang einer Virusfamilie mit der Bezeichnung Podoviridae. Im März 2021 wurde vorgeschlagen, diese Familie mitsamt der Ordnung Caudovirales wegen fehlender Monophylie aufzulösen und (wie damals bereits z. T. geschehen) durch neu zu schaffende Familien zu ersetzen, damit neue Ergebnisse aus der Metagenomik in die Taxonomie aufgenommen werden können.[3] Das International Committee on Taxonomy of Viruses (ICTV) hat dem im März 2022 entsprochen.[1] Gemäß Vorschlag bleibt die Bezeichnung „Podoviren“ (englisch podoviruses) aber als informeller Sammelbegriff morphologisch ähnlicher Prokaryotenviren mit einem linearen Doppelstrang-DNA-Genom erhalten.[3]
Systematik
Die folgende Systematik nach ICTV (Stand Mai/Juni 2024)[4][5] umfasst nur einen Teil der zugehörigen Spezies bzw. Viren.
Nicht-taxonomische Gruppe Podoviren (englisch podoviruses, auch Caudoviricetes „Morphotyp C“)
- Ordnung Crassvirales (früher crAss-like viruses, crAss-like phages, de crAssphagen) mit zirkulärem Genom, ursprünglich als Mitglieder der ehemaligen Familie Podoviridae vorgeschlagen. Phage crAss001 wurde kultiviert und hat Myoviren-Morphologie, ob dies für alle Mitglieder der Ordnung gilt, ist allerdings nicht gesichert.[6][7][8][3][9][10]
- Familie Crevaviridae
- Unterfamilie Coarsevirinae
- Unterfamilie Doltivirinae
- Familie Intestiviridae
- Familie Steigviridae
- Unterfamilie Asinivirinae mi Gattung Kehishuvirus (Spezies Kehishuvirus primarius, früher K. cr59 mit Phage crAss001)
- Familie Suoliviridae
- Unterfamilie Bearivirinae
- Unterfamilie Boorivirinae
- Unterfamilie Loutivirinae
- Unterfamilie Oafivirinae
- Unterfamilie Uncouvirinae
- ohne zugewiesene Unterfamilie (1 Gattung)
- Familie „Jelitoviridae“ (vorgeschlagen)
- Familie „Tinaiviridae“ (vorgeschlagen)
- Ordnung Kirjokansivirales (Archaeen-Viren mit Kopf-Schwanz-Struktur mit Podo- und Siphoviren-Morphologie, hier nur die Podoviren-Familie(n))[14]
- Familie Shortaselviridae (Podoviren)
- Podoviren ohne aktuelle Ordnungszuweisung
- Familie Autographiviridae (frühere Unterfamilie Autographivirinae der damaligen Podoviren-Familie, inklusive der Gattungen Aqualcavirus und Bifseptvirus)
- Unterfamilie Beijerinckvirinae
- Unterfamilie Colwellvirinae
- Unterfamilie Corkvirinae
- Unterfamilie Krylovirinae
- Unterfamilie Melnykvirinae
- Unterfamilie Molineuxvirinae
- Unterfamilie Okabevirinae
- Unterfamilie Slopekvirinae
- Unterfamilie Studiervirinae
- ohne zugewiesene Unterfamilie (71 Gattungen)
- Familie Fredfastierviridae
- ohne zugewiesene Unterfamilie
- Gattung Jamesmcgillvirus
- Spezies Pseudomonas-Virus 119X (wiss. Jamesmcgillvirus jv119X, früher Pseudomonas virus 119X)
- Spezies Jamesmcgillvirus jv119X, mit Pseudomonas-Phage 119X
- Spezies Jamesmcgillvirus PaMx41, mit Pseudomonas-Phage PaMx41
- Gattung Jamesmcgillvirus
- Familie Guelinviridae
- Unterfamilie Denniswatsonvirinae
- ohne zugewiesene Unterfamilie (3 Gattungen, darunter Brucesealvirus)
- Familie Grimontviridae
- ohne zugewiesene Unterfamilie
- Gattung Moazamivirus
- Spezies Moazamivirus 711, mit Salmonella-phage 7-11
- Spezies Moazamivirus SE131, mit Salmonella-Phage SE131
- Gattung Privateervirus
- Spezies Privateervirus 3H1020, mit Proteus-Phage 3H10_20
- Spezies Privateervirus P59, mit Proteus-Phage Vb_PmiP-P59
- Spezies Privateervirus privateer, mit Proteus-Phage Privateer
- Spezies Privateervirus pv009, mit Cronobacter-Phage vB_CsaP_009
- Gattung Moazamivirus
- Familie Madridviridae (abgetrennt von Salasmaviridae)
- ohne zugewiesene Unterfamilie
- Gattung Cepunavirus (veraltet Cp1virus)
- Spezies Cepunavirus Cp1 (ehem. Typus), mit Streptococcus phage Cp1 (ursprünglich Complutense-Phage 1 und 9)[15][16][17]
- Spezies Cepunavirus Cp7, mit Streptococcus phage Cp7 (ursprünglich Complutense-Phage 7)[18]
- Spezies „Streptococcus phage Cp-5“ („Streptococcus-Phage Cp-5“, Vorschlag), mit „Complutense-Phage 5“[19]
- Gattung Cepunavirus (veraltet Cp1virus)
- Familie Pachyviridae[20]
- ohne zugewiesene Unterfamilie
- Gattung Bacelvirus
- Spezies Bacelvirus phi46tres, mit Cellulophaga-Phage phi46:3 – Wirt Cellulophaga baltica NN016046)[21]
- Gattung Baltivirus
- Gattung Gundelvirus
- Spezies Gundelvirus Gundel, mit Tenacibaculum-Phage Gundel – Wirte: Tenacibaculum sp. AHE14PA – DSM111040 und T. sp. AHE15PA – DSM111039, Flavobacteriaceae).[25]
- Gattung Bacelvirus
- Familie Rountreeviridae (frühere Unterfamilie Rountreevirinae der damaligen Podoviren-Familie)
- Unterfamilie Rakietenvirinae
- Unterfamilie Sarlesvirinae
- ohne zugewiesene Unterfamilie (2 Gattungen)
- Familie Pervagoviridae[20]
- ohne zugewiesene Unterfamilie
- Gattung Callevirus (zirkuläres Genom, nach NCBI evtl. zu Crassvirales, siehe C. phi38una)
- Spezies Callevirus Calle, mit Cellulophaga-Phage Calle[26] – Wirt: Cellulophaga sp. HaHa_2_95[27] und C. sp. HaHa_2_1,[28] Flavobacteriaceae
- Spezies Callevirus phi38una, mit Cellulophaga-Phage phi38:1 und Cellulophaga-Phage phi40:1 – Wirte: Cellulophaga sp. NN016038 respektive C. sp. NN015840[29]
- Gattung Callevirus (zirkuläres Genom, nach NCBI evtl. zu Crassvirales, siehe C. phi38una)
- Familie Saffermanviridae – eine Familie von Cyanophagen
- ohne zugewiesene Unterfamilie
- Gattung Arthrovirus
- Spezies Arthrovirus TR020 (Arthronema-Virus TR020)
- Gattung Kozyakovvirus
- Spezies Kozyakovvirus A4L, mit Anabaena-Phage A-4L
- Gattung Morrisvirus
- Spezies Morrisvirus JingP1, mit Plectonema-Phage JingP1
- Spezies Morrisvirus LPP1, mit Leptolyngbya-Phage LPP-1
- Spezies Morrisvirus Pboyong3, mit Plectonema-Phage Pbo-yong3
- Gattung Wumpquatrovirus
- Spezies Wumpquatrovirus Lbo240yong1, mit Leptolyngbya-Phage Lbo240-yong1
- Spezies Wumpquatrovirus WMP4 (Phormidium-Virus WMP4), mit Phormidium-Phage Pf-WMP4
- Gattung Wumptrevirus
- Spezies Wumptrevirus LPP2, mit Leptolyngbya-Phage LPP-2, Subtyp SPI
- Spezies Wumptrevirus PP (Phormidium-Virus PP), mit Cyanophage PP – Wirte: Phormidium foveolarum (syn. Leptolyngbya foveolarum) und Plectonema boryanum[30]
- Spezies Wumptrevirus WMP3 (Phormidium-Virus WMP3), mit Phormidium-Phage Pf-WMP3
- Gattung Arthrovirus
- Familie Salasmaviridae
- Unterfamilie Northropvirinae
- Unterfamilie Picovirinae[31] – früher zur damaligen Podoviren-Familie
- Unterfamilie Tatarstanvirinae
- ohne zugewiesene Unterfamilie (3 Gattungen)
- Familie Schitoviridae[32][33][3]
- Unterfamilie Demetervirinae
- Unterfamilie Enquatrovirinae
- Unterfamilie Erskinevirinae
- Unterfamilie Fuhrmanvirinae
- Unterfamilie Humphriesvirinae
- Unterfamilie Migulavirinae
- Unterfamilie Pontosvirinae
- Unterfamilie Rhodovirinae
- Unterfamilie Rothmandenesvirinae
- ohne zugewiesene Unterfamilie (27 Gattungen)
- Familie Zobellviridae
- Unterfamilie Cobavirinae
- ohne zugewiesene Unterfamilie (6 Gattungen)
- ohne zugewiesene Familie
- Unterfamilie Beephvirinae
- Gattung Flowerpowervirus
- Spezies Flowerpowervirus flowerpower (Streptomyces-Virus FlowerPower), mit Streptomyces-Phage FlowerPower
- Gattung Immanueltrevirus
- Spezies Immanueltrevirus immanuel3 (Streptomyces-Virus Immanuel3), mit Streptomyces-Phage Immanuel3
- Gattung Manuelvirus
- Spezies Manuelvirus JXY1 (Streptomyces-Virus JXY1), mit Streptomyces-Phage JXY1
- Spezies Manuelvirus manuel (Streptomyces-Virus Manuel), mit Streptomyces-Phage Manuel
- Spezies Manuelvirus wrighton (Streptomyces-Virus WRightOn), mit Streptomyces-Phage WRightOn
- Gattung Flowerpowervirus
- Unterfamilie Eekayvirinae
- Gattung Akonivirus
- Spezies Akonivirus akoni (Microbacterium-Virus Akoni)
- Spezies Akonivirus phedro (Microbacterium-Virus Phedro)
- Gattung Tinytimothyvirus
- Spezies Tinytimothyvirus alex44 (Microbacterium-Virus Alex44)
- Spezies Tinytimothyvirus tinytimothy (Microbacterium-Virus TinyTimothy)
- Gattung Akonivirus

- Unterfamilie Gordonclarkvirinae (früher Gattung Kuravirus s. l., Podoviren)
- Gattung Kuravirus (früher Phieco32virus, Phieco32-ähnliche Viren)[34]
- Spezies Kuravirus CHD5UKE1, mit Escherichia-Phage vB_EcoP-CHD5UKE1
- Spezies Kuravirus EcoN5, mit Escherichia-Phage vB_EcoP_EcoN5
- Spezies Kuravirus ES17, mit Escherichia-Phage ES17[35][36]
- Spezies Kuravirus IMEP8, mit Escherichia-Phage vB_EcoP_IMEP8
- Spezies Kuravirus kv1721(Escherichia-Virus 172-1)
- Spezies Kuravirus MN03, mit Escherichia-Phage MN03
- Spezies Kuravirus MN05, mit Escherichia-Phage MN05
- Spezies Kuravirus NJ01(Escherichia-Virus NJ01)
- Spezies Kuravirus O18011, mit Escherichia-Phage O18-011
- Spezies Kuravirus paul, mit Escherichia-Phage Paul
- Spezies Kuravirus phiEco32 (Escherichia-Virus phiEco329), mit Enterobacteria-Phage PhiEco32
- Spezies Kuravirus SGF2, mit Shigella-Phage SGF2
- Spezies Kuravirus SU10 (Escherichia-Virus SU10), mit Escherichia-Phage vB_EcoP_SU10
- Spezies Kuravirus WFI101126, mit Escherichia-Phage vB_EcoP_WFI101126
- Gattung Nieuwekanaalvirus (abgetrennt von Kuravirus)
- Spezies Nieuwekanaalvirus EP335, mit Escherichia-Phage EP335
- Spezies Nieuwekanaalvirus KBNP1711 (früher Kuravirus septima11; Escherichia-Virus Septima11), mit Escherichia-Phage KBNP1711
- Gattung Suseptimavirus (abgetrennt von Kuravirus)
- Spezies Suseptimavirus 101114UKE3, mit Escherichia-Phage vB_EcoP-101114UKE3
- Spezies Suseptimavirus ECBP2 (früher Kuravirus ECB2; Escherichia-Virus ECB2), mit Escherichia-Phage ECBP2
- Spezies Suseptimavirus EK010, mit Escherichia-Phage EK010
- Spezies Suseptimavirus IME267, mit Escherichia-Phage IME267
- Spezies Suseptimavirus SU7, mit Escherichia-Phage vB_EcoP_SU7
- Gattung Kuravirus (früher Phieco32virus, Phieco32-ähnliche Viren)[34]
- Unterfamilie Sepvirinae
- Gattung Diegovirus (früher Pocjvirus)
- Spezies Diegovirus dv7502Stx (Shigella-Virus 7502Stx), mit ShigellaPhage 75/02 Stx
- Spezies Diegovirus POCJ13 (Shigella-Virus POCJ13), mit Shigella-Phage POCJ13
- Gattung Oslovirus (früher Tl2011virus)
- Spezies Oslovirus ArgO145, mit Escherichia-Phage ArgO145
- Spezies Oslovirus Lyz12581Vzw, mit Escherichia-Phage Lyz12581Vzw
- Spezies Oslovirus ov191 (Escherichia-Virus 191), mit Escherichia-Phage phi191
- Spezies Oslovirus PA2, mit Escherichia-Phage PA2
- Spezies Oslovirus TL2011, mit Escherichia-Phage TL-2011c
- Spezies Oslovirus VASD, mit Shigella-Phage Ss-VASD
- Gattung Traversvirus (früher Nona33virus)
- Spezies Traversvirus AU5Stx1 (Escherichia-Virus AU5Stx1)
- Spezies Traversvirus AU6Stx1 (Escherichia-Virus AU6Stx1)
- Spezies Traversvirus F451 (Escherichia virus F451)
- Spezies Traversvirus II (Escherichia-Virus Stx2 II), mit Escherichia phage Stx2 II
- Spezies Traversvirus min27 (Escherichia-Virus Min27), mit Escherichia phage Min27
- Spezies Traversvirus P27 (Escherichia-Virus P27), mit Stx converting phage vB_EcoS_P27 alias Escherichia-Phage P27
- Spezies Traversvirus PA28 (Escherichia-Virus PA28), mit Escherichia phage PA28)
- Spezies Traversvirus SH2026Stx1 (Escherichia-Virus SH2026Stx1), mit Escherichia phage SH2026Stx1)
- Spezies Traversvirus ST28624 (Enterobacteria-Virus ST2-8624), mit Stx converting phage vB_EcoS_ST2-8624
- Spezies Traversvirus tv86 (Escherichia-Virus 86), mit Stx2-converting phage 86
- Spezies Traversvirus tv24B (Escherichia-Virus 24B), mit Escherichia phage vB_EcoP_24B
- Spezies Traversvirus tv933W (Escherichia-Virus 933W), mit Escherichia phage 933W alias Enterobacteria-Phage 933W[37][38]
- Spezies Traversvirus WGPS9 (Escherichia-Virus WGPS9), mit Stx2-converting phage Stx2a_WGPS9
- Gattung Diegovirus (früher Pocjvirus)
- ohne zugewiesene Unterfamilie
- Gattung Anjalivirus
- Spezies Anjalivirus anjali (Arthrobacter-Virus Anjali)
- Gattung Astrithrvirus
- Spezies Astrithrvirus astrithr (Salmonella-Virus astrithr), mit Salmonella-Phage astrithr
- Gattung Badaztecvirus
- Spezies Badaztecvirus badaargau2, mit Bifidobacterium-Phage BadAargau2
- Spezies Badaztecvirus badaztec1 (Bifidobacterium-Virus BadAztec1)
- Gattung Bjornvirus
- Spezies Bjornvirus bjorn (Pseudomonas-Virus Bjorn)
- Gattung Anjalivirus

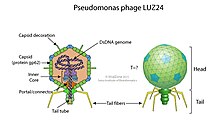
- Gattung Bruynoghevirus (früher Luz24virus, Luz24likevirus, LUZ24-ähnliche Viren)[39]
- Spezies Bruynoghevirus Ab22, mit Pseudomonas-Phage vB_PaeP_C2-10_Ab22
- Spezies Bruynoghevirus CHU, mit Pseudomonas-Phage PhiCHU
- Spezies Bruynoghevirus LUZ24 (Pseudomonas-Virus LUZ24), mit Pseudomonas-Phage LUZ24
- Spezies Bruynoghevirus PAA2, mit Pseudomonas-Phage phiIBB-PAA2
- Spezies Bruynoghevirus PaP3, mit Pseudomonas-Phage PaP3
- Spezies Bruynoghevirus PaP4, mit Pseudomonas-Phage PaP4
- Spezies Bruynoghevirus TL, mit Pseudomonas-Phage TL
- Gattung Burrovirus
- Spezies Burrovirus araxxi, mit Microbacterium-Phage Araxxi
- Spezies Burrovirus arete, mit Microbacterium-Phage Arete
- Spezies Burrovirus burro (Microbacterium-Virus Burro), mit Microbacterium-Phage Burro
- Gattung Chopinvirus
- Spezies Chopinvirus KSY1 (Lactococcus-Virus KSY1), mit Lactococcus-Phage KSY1
- Gattung Cimandefvirus
- Spezies Cimandefvirus cimandef, mit Ralstonia-Phage Cimandef
- Spezies Cimandefvirus eline, mit Ralstonia-Phage Eline
- Spezies Cimandefvirus gamede, mit Ralstonia-Phage Gamede
- Spezies Cimandefvirus Ggerry, mit Ralstonia-Phage Gerry
- Spezies Cimandefvirus heva, mit Ralstonia-Phage Heva
- Gattung Delislevirus
- Spezies Delislevirus P1 (Mycoplasma-Virus P1), mit Mycoplasma-Phage P1
- Gattung Dybvigvirus
- Spezies Dybvigvirus Av1 (Actinomyces-Virus Av1), mit Actinomyces-Phage Av-1
- Gattung Bruynoghevirus (früher Luz24virus, Luz24likevirus, LUZ24-ähnliche Viren)[39]

- Gattung Hollowayvirus (früher F116virus)[40]
- Spezies Hollowayvirus E220, mit Pseudomonas-Phage vB_PaeP_E220
- Spezies Hollowayvirus Epa33, mit Pseudomonas-Phage Epa33
- Spezies Hollowayvirus F116, mit Pseudomonas-Phage F116
- Spezies Hollowayvirus H66, mit Pseudomonas-Phage H66
- Spezies Hollowayvirus LKA5, mit Pseudomonas-Phage LKA5
- Spezies Hollowayvirus PA8, mit Pseudomonas-Phage PA8
- Spezies Hollowayvirus phiC725A, mit Pseudomonas-Phage phiC725A
- Gattung Hungariovirus (früher Giessenvirus)
- Spezies Hungariovirus C1302 (Escherichia-Virus C1302), mit Escherichia-Phage C130_2
- Gattung Jasminevirus
- Spezies Jasminevirus adat, mit Arthrobacter phage Adat
- Spezies Jasminevirus jasmine, mit Arthrobacter phage Jasmine
- Gattung Kafunavirus (früher Kf1virus)
- Spezies Kafunavirus KF1, mit Edwardsiella phage KF-1
- Gattung Kelquatrovirus
- Spezies Kelquatrovirus KL4, mit Burkholderia phage vB_BmuP_KL4
- Gattung Kochitakasuvirus (früher Kpp25virus)
- Spezies Kochitakasuvirus KPP25, mit Pseudomonas phage KPP25
- Spezies Kochitakasuvirus R18, mit Pseudomonas phage PhiR18
- Gattung Krylovvirus
- Spezies Krylovvirus tf, mit Pseudomonas-Phage tf
- Gattung Lahexavirus
- Spezies Lahexavirus LAh6, mit Aeromonas-Phage LAh_6
- Spezies Lahexavirus LAh8, mit Aeromonas-Phage LAh_8
- Spezies Lahexavirus LAh9, mit Aeromonas-Phage LAh_9
- Spezies Lahexavirus lv44572, mit Aeromonas-Phage 4_4572
- Gattung Lastavirus
- Spezies Lastavirus lasta, mit Klebsiella-Phage LASTA
- Spezies Lastavirus sopranogao, mit Klebsiella-Phage SopranoGao
- Gattung Hollowayvirus (früher F116virus)[40]



- Gattung Lederbergvirus (früher P22virus, P22likevirus, P22-ähnliche Viren)[41]
- Spezies Lederbergvirus BTP1 (Salmonella-Virus BTP1), mit Salmonella-Phage BTP1
- Spezies Lederbergvirus HK620 (Escherichia-Virus HK620), mit Enterobacteria-Phage HK620
- Spezies Lederbergvirus P22 (Salmonella-Virus P22), mit Salmonella-Phage P22 alias Bakteriophage P22 und Salmonella-Phage epsilon34 alias Bakteriophage ε34 oder Salmonella-Phage 34[42][43][44])
- Spezies Lederbergvirus SE1Spa (Salmonella-Virus SE1Spa), mit Salmonella-Phage SE1Spa
- Spezies Lederbergvirus Sf6 (Shigella-Virus Sf6), mit Shigella-Phage Sf6
- Spezies Lederbergvirus ST64T (Salmonella-Virus ST64T), mit Salmonella-Phage ST64T
- Gattung Lederbergvirus (früher P22virus, P22likevirus, P22-ähnliche Viren)[41]

- Gattung Lessievirus (früher Bcep22virus, Bcep22likevirus)[45]
- Spezies Lessievirus bcep22, mit Burkholderia-Phage Bcep22
- Spezies Lessievirus bcepil02, mit Burkholderia-Phage BcepIL02
- Spezies Lessievirus bcepmigl, mit Burkholderia-Phage BcepMigl
- Spezies Lessievirus DC1, mit Burkholderia-Phage DC1
- Gattung Lightbulbvirus (früher Cba41virus)
- Spezies Lightbulbvirus Cba41, mit Cellulophaga-Phage phi4:1
- Spezies Lightbulbvirus Cba172, mit Cellulophaga-Phage phi17:2
- Gattung Myxoctovirus
- Spezies Myxoctovirus Mx8, mit Myxococcus-Phage Mx8
- Gattung Pagevirus
- Spezies Pagevirus page (Bacillus-Virus Page), mit Bacillus-Phage Page
- Spezies Pagevirus palmer (Bacillus-Virus Palmer), mit Pacillus-Phage Palmer[46]
- Spezies Pagevirus pascal, mit Bacillus-Phage Pascal
- Spezies Pagevirus pony, mit Bacillus-Phage Pony
- Spezies Pagevirus pookie, mit Bacillus-Phage Pookie
- Gattung Parlovirus
- Spezies Parlovirus parlo (Serratia-Virus Parlo), mit Serratia-Phage Parlo
- Gattung Perisivirus (früher Prtbvirus)
- Spezies Perisivirus Pr, mit Brucella-Phage Pr
- Spezies Perisivirus Tb, mit Brucella-Phage Tb
- Gattung Rauchvirus (früher Bpp1virus, Bpp1likevirus, BPP-1-ähnliche Viren)
- Spezies Rauchvirus BPP1 (Bordetella-Virus BPP1), mit Bordetella-Phage BPP-1
- Gattung Ryyoungvirus
- Spezies Ryyoungvirus bcepC6B, mit Burkholderia-Phage BcepC6B
- Gattung Schmidvirus (früher Una961virus)
- Spezies Schmidvirus KHP40, mit Helicobacter-Phage KHP40
- Spezies Schmidvirus sv1961P, mit Helicobacter-Phage 1961P
- Gattung Sendosyvirus
- Spezies Sendosyvirus APSE1 (Hamiltonella-Virus APSE1), mit Hamiltonella-Phage APSE-1 – Wirt Hamiltonella defensa, Endosymbiont in Acyrthosiphon pisum (Erbsenlaus)
- Spezies Sendosyvirus APSE2 (Hamiltonella-Virus APSE2), mit Bacteriophage APSE-2 – Wirt Hamiltonella defensa, Endosymbiont in Acyrthosiphon pisum (Erbsenlaus)
- Gattung Skarprettervirus
- Spezies Skarprettervirus skarpretter, mit Escherichia-Phage Skarpretter
- Gattung Sortsnevirus
- Spezies Sortsnevirus IME279, mit Klebsiella-Phage vB_KpnS_IME279
- Spezies Sortsnevirus sortsne, mit Escherichia-Phage Sortsne
- Gattung Uetakevirus (früher Epsilon15virus, Epsilon15likevirus, Epsilon15-ähnliche Viren)[47]
- Spezies Uetakevirus epsilon15 (Salmonella-Virus Epsilon15), mit Salmonella-Phage Epsilon15[48]
- Spezies Uetakevirus phiV10 (Escherichia-Virus phiV10), mit Escherichia-Phage phiV10
- Spezies Uetakevirus SPN1S (Salmonella-Virus SPN1S), mit Salmonella-Phage SPN1S
- Gattung Vicosavirus
- Spezies Vicosavirus NV1, mit Pseudomonas-Phage NV1
- Spezies Vicosavirus UFVP2, mit Pseudomonas-Phage UFV-P2
- Gattung Xuquatrovirus
- Spezies Xuquatrovirus PTXU04 (Escherichia-Virus PTXU04), mit Escherichia-Phage PTXU04
- Gattung Lessievirus (früher Bcep22virus, Bcep22likevirus)[45]
- Vorschläge ohne zugewiesene Familien- oder Unterfamilienzuordnung
- Gattung „Alteavirus“ (mögliche Schwesterklade der Schitoviridae)[32]
- Gattung „Cyanopodovirus“ (informell: nicht zugeordnete Cyanophagen mit Podoviren-Morphologie)
- Spezies „Microcystis-Phage Ma-LBP“ (alias „Cyanophage Ma-LBP“)[49]
- Spezies „Microcystis-Phage Ma-LEP“ (alias „Cyanophage Ma-LEP“)[50]
- Spezies „Synechococcus-Podovirus BAC9D04“ (mit „Podophage BAC9D04“)[51][52][53]
- Spezies „Synechococcus-Podovirus MPP-A“ (englisch „Synechococcus podovirus MPP-A“)[54]
- Spezies „Synechococcus-Podovirus MPP-B“ (englisch „Synechococcus podovirus MPP-B“)[54]

Verschiebungen:
- Die Gattung Nonanavirus wurde den Siphoviren zugeordnet.
Einige (vom ICTV bereits offiziell registrierte) Phagen mit Podoviren-Morphotyp wie Roseobacter-Virus SIO1 (mit Phage SIO1) und Vibrio-Virus VpV262 (mit Phage VpV262) sind zwar evolutionär mit den Autographiviridae verwandt, enthalten jedoch anders als diese keine phagenkodierte RNA-Polymerase und zeigen auch größere Unterschiede auf der Ebene der Genomorganisation.[61][62]
Für die früher aufgrund ihrer Morphologie der Podoviren-Familie zugeordneten crAssphagen wurde inzwischen eine eigene Ordnung Crassvirales innerhalb der Klasse Caudoviricetes gestellt.[3]
Literatur
- C. M. Fauquet, M. A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London / San Diego 2004.
- David M. Knipe, Peter M. Howley et al. (Hrsg.): Fields’ Virology. 4. Auflage. Philadelphia 2001.
Einzelnachweise
- ↑ a b c ICTV Master Species List 2021.v1. ICTV. New MSL including all taxa updates since the 2020 release, March 2022 (MSL #37)
- ↑ Antje Wichels, Stefan S. Biel, Hans R. Gelderblom, Thorsten Brinkhoff, Gerard Muyzer, Christian Schütt: Bacteriophage diversity in the North Sea. In: Applied and Environmental Microbiology, November 1998, Band 64, Nr. 11, S. 4128–4133 (englisch); doi:10.1128/AEM.64.11.4128-4133.1998, PMID 9797256, PMC 106618 (freier Volltext), awi.de (PDF; 0,3 MB).
- ↑ a b c d e Dann Turner, Andrew M. Kropinski, Evelien M. Adriaenssens: A Roadmap for Genome-Based Phage Taxonomy. In: MDPI Viruses, 18. März 2021, Band 13, Nr. 3, Section Bacterial Viruses, 506 (englisch); doi:10.3390/v13030506
- ↑ ICTV: Taxonomy Browser.
- ↑ ICTV: Virus Metadata Resource (VMR).
- ↑ crAss-like viruses/phages (clade) NCBI.
- ↑ crAss-like phages und Double Strand DNA Viruses. SIB, Expasy ViralZone – Order: Caudovirales, Estimated about 10 genera
- ↑ Eugene V. Koonin, Natalya Yutin: The crAss-like Phage Group: How Metagenomics Reshaped the Human Virome. In: Trends in Microbiology, 28. Februar / 1. Mai 2020, Band 28, Nr. 5, S. 349–359 (englisch); doi:10.1016/j.tim.2020.01.010
- ↑ A. N. Shkoporov, S. R. Stockdale, E. M. Adriaenssens, N. Yutin, E. V. Koonin, B. E. Dutilh, M. Krupovic, R. A. Edwards, I. Tolstoy, C. Hill: 2020.039B.Ud.v1.Crassvirales.docx (Seite nicht mehr abrufbar, festgestellt im Dezember 2022. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis., 2020.039B.Ud.v1.Crassvirales.xlsx (Seite nicht mehr abrufbar, festgestellt im Dezember 2022. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. Proposal: Create one new order (Crassvirales) including six new families, ten new subfamilies, 78 new genera and 279 new species. 6. Dezember 2020
- ↑ Andrey N. Shkoporov et al.: Proposal 2021.022B. crAss-like phages Study Group. Create one new order (Crassvirales) including four new families, ten new subfamilies, 42 new genera and 73 new species (Caudoviricetes). Stand: 13. Mai 2021.
- ↑ uncultured crAssphage (species). NCBI.
- ↑ Ajeng K. Pramono, Hirokazu Kuwahara, Takehiko Itoh, Atsushi Toyoda, Akinori Yamada, Yuichi Hongoh: Discovery and Complete Genome Sequence of a Bacteriophage from an Obligate Intracellular Symbiont of a Cellulolytic Protist in the Termite Gut. In: Microbes and Environments. Band 32, Nr. 2, 2017, ISSN 1342-6311, S. 112–117, doi:10.1264/jsme2.ME16175, PMID 28321010, PMC 5478533 (freier Volltext) – (englisch).
- ↑ CrAssphage: Previously Unknown Ancient Gut Virus Lives in Half World’s Population. sci-news, 11. August 2014 (englisch).
- ↑ Y. Liu et al.: Proposal 2021.001A (zip:docx) ICTV Archaeal Viruses Subcommittee. PDF via Universität Helsinki. Create three new orders and 14 new families in the class Caudoviricetes (Duplodnaviria, Uroviricota) for classification of archaeal tailed viruses. Oktober 2020. Siehe insbes. Tbl. 1.
- ↑ NCBI: Streptococcus virus Cp1 (species)
- ↑ C. Ronda, R. López, E. García: Isolation and characterization of a new bacteriophage, Cp-1, infecting Streptococcus pneumoniae. In: J. Virol. Band 40, Nr. 2, 1981, S. 551–559, doi:10.1128/JVI.40.2.551-559.1981, PMID 6275103, PMC 256658 (freier Volltext).
- ↑ Rubens López: Streptococcus pneumoniae and its bacteriophages: one long argument. In: International Microbiology, Band 7, Nr. 3, S. 163–171, Oktober 2004; doi:10.1093/clinids/3.2.212, ResearchGate:8223977 (englisch))
- ↑ NCBI: Streptococcus virus Cp7 (species)
- ↑ NCBI: Streptococcus phage Cp-5 (species)
- ↑ a b Nina Bartlau et al.: Create nine new families (Pachyviridae, Pervagoviridae, Assiduviridae, Helgolandviridae, Duneviridae, Molycolviridae, Winoviridae, Forsetiviridae, and Aggregaviridae) including 13 new genera and 18 new species (Caudoviricetes). (zip:docx) Vorschlag an das ICTV, Mai 2021.
- ↑ Cellulophaga phage phi46:3 (species). NCBI.
- ↑ Cellulophaga sp. #13 (species). NCBI.
- ↑ Cellulophaga sp. #18 (species). NCBI.
- ↑ Cellulophaga sp. #19 (species). NCBI.
- ↑ Tenacibaculum phage Gundel (species) und als Spezies synonym Tenacibaculum phage Gundel_1 (species). NCBI.
- ↑ Search for: pahge Calle (token set), sowie Cellulophaga phage Calle (species).. NCBI.
- ↑ Cellulophaga sp. HaHa_2_95 (species). NCBI.
- ↑ Cellulophaga sp. HaHa_2_1 (species). NCBI.
- ↑ Cellulophaga phage phi38:1 (species) und Cellulophaga phage phi40:1 (species). NCBI. – Zuordnung zu Crassvirales ist nicht ICTV-bestätigt
- ↑ NCBI Nucleotide: Cyanophage PP, complete genome NC_022751 & KF598865].
- ↑ Luis Fernando Camarillo Guerrero: Integrative Analysis of the Human Gut Phageome Using a Metagenomics Approach. Doktorarbeit, Gonville & Caius College, University of Cambridge, August 2020; doi:10.17863/CAM.63973
- ↑ a b Proposals ratification list 2021. ( des vom 11. April 2021 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. ICTV.
- ↑ Bacterial and archaeal virus proposals. ICTV (Seite nicht mehr abrufbar, festgestellt im Dezember 2022. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (zip): 2020.146B.R.Schitoviridae.xlsx
- ↑ Kuravirus, synonym Phieco32virus. SIB; ViralZone.
- ↑ Escherichia phage ES17 (species). NCBI.
- ↑
Sabrina I. Green, Carmen Gu Liu, Xue Yu, Shelley Gibson, Wilhem Salmen, Anubama Rajan, Hannah E. Carter, Justin R. Clark, Xuezheng Song, Robert F. Ramig, Barbara W. Trautner, Heidi B. Kaplan, Anthony W. Maresso: Targeting of Mammalian Glycans Enhances Phage Predation in the Gastrointestinal Tract. In: mBio, 9. Februar 2021; doi:10.1128/mBio.03474-20. Dazu:
- Antibiotic Game-Changer: Phages Can Anticipate Bacteria’s Location and Destroy Them Before They Cause an Infection. SciTechDaily, 9. Februar 2021. Quelle: TAILΦR labs, Baylor College of Medicine
- ↑ Escherichia virus 933W (species). NCBI.
- ↑ Viral exotoxin. SIB.
- ↑ Bruynoghevirus, syn. Luz24virus. SIB; ViralZone.
- ↑ Hollowayvirus, syn. F116virus. SIB; ViralZone.
- ↑ Lederbergvirus, syn. P22virus. SIB; ViralZone.
- ↑ Salmonella phage 34 (no rank). NCBI.
- ↑ Robert Villafane, Milka Zayas, Eddie B. Gilcrease, Andrew M. Kropinski, Sherwood R. Casjens: Genomic analysis of bacteriophage ε34 of Salmonella enterica serovar Anatum (15+). In: BMC Microbiol., 17. Dezember 2008, 8, S. 227, (englisch); doi:10.1186/1471-2180-8-227, PMC 2629481 (freier Volltext), PMID 19091116.
- ↑ Harald Brüssow, Carlos Canchaya, Wolf-Dietrich Hard: Phages and the Evolution of Bacterial Pathogens: from Genomic Rearrangements to Lysogenic Conversion. In: Microbiol Mol Biol Rev., September 2004, 68(3), S. 560–602; doi:10.1128/MMBR.68.3.560-602.2004, PMC 515249 (freier Volltext), PMID 15353570, siehe insbes. Tabelle 1.
- ↑ Lessievirus, syn. Bcep22virus. SIB; ViralZone.
- ↑ Ramon Sanchez-Rosario, Jesus Garcia, Vivian Rodriguez, Kevin A. Schug, Zacariah L. Hildenbrand, Ricardo A. Bernal: Using Bacteriophages to Treat Resilient Bacteria Found in Produced Water. In: MDPI Water, 7. März 2024, Band 16, Nr. 6 (englisch); doi:10.3390/w16060797. Dazu:
- ↑ Uetakevirus, synonym Epsilon15virus. SIB; ViralZone.
- ↑ Preeti Gipson, Matthew L. Baker, Desislava Raytcheva, Cameron Haase-Pettingell, Jacqueline Piret, Jonathan A. King, Wah Chiu: Protruding knob-like proteins violate local symmetries in an icosahedral marine virus. In: Nature Communications. Band 5, Nr. 4278, 2. Juli 2014, doi:10.1038/ncomms5278 (englisch, nature.com). Corrigendum. In: Nature Communications, 12. Januar 2015, Band 6, Nr. 6040; doi:10.1038/ncomms7040.
- ↑ Stephen Tucker, Peter Pollard:Identification of Cyanophage Ma-LBP and Infection of the Cyanobacterium Microcystis aeruginosa from an Australian Subtropical Lake by the Virus. ( des vom 11. Mai 2021 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: ASM Applied and Environmental Microbiology, 3. Februar 2005, Band 71, Nr. 2, S. 629–635 (englisch); doi:10.1128/AEM.71.2.629-635.2005
- ↑ Cyanophage Ma-LEP, equivalent: Microcystis phage Ma-LEP (species). NCBI.
- ↑ Itai Sharon et al.: Viral photosynthetic reaction center genes and transcripts in the marine environment. In: The ISME Journal, Oktober 2007, Band 1, S. 492–501 (englisch); doi:10.1038/ismej.2007.67
- ↑ Ruth-Anne Sandaa et al.: Photosynthetic genes in viral populations with a large genomic size range from Norwegian coastal waters. In: FEMS Microbiology Ecology, 1. Januar 2008, Band 63, Nr. 1, S. 2–11 (englisch); doi:10.1111/j.1574-6941.2007.00400.x
- ↑ John H. Paul, Matthew B. Sullivan: Marine phage genomics: what have we learned? In: Curr. Op. in Biotechnology, Juni 2005, Band 16, Nr. 3, S. 299–307; doi:10.1016/j.copbio.2005.03.007, PMID 15961031, siehe Fig. 3 (Genomkarte)
- ↑ a b Sijun Huang, Si Zhang, Nianzhi Jiao, Feng Chen: Comparative Genomic and Phylogenomic Analyses Reveal a Conserved Core Genome Shared by Estuarine and Oceanic Cyanopodoviruses. In: PLOS ONE, 16. November 2015 (englisch); doi:10.1371/journal.pone.0142962
- ↑ Ochrobactrum phage vB_OspP_OH (species). NCBI.
- ↑ Przemyslaw Decewicz, Piotr Golec, Mateusz Szymczak, Monika Radlinska, Lukasz Dziewit: Identification and Characterization of the First Virulent Phages, Including a Novel Jumbo Virus, Infecting Ochrobactrum spp. In: MDPI Int. J. Mol. Sci, 18. März 2020, Band 21, Nr. 6, Special Issue Bacteriophage – Molecular Studies, 2096; doi:10.3390/ijms21062096
- ↑ Puniceispirillum phage HMO-2011 (species). NCBI.
- ↑ Ilnam Kang, Hyun-Myung Oh, Dongmin Kang, Jang-Cheon Cho: Genome of a SAR116 bacteriophage shows the prevalence of this phage type in the oceans. In: PNAS, 23. Juli 2013, 110 (30), S. 12343–12348 (englisch); doi:10.1073/pnas.1219930110
- ↑ Hyun-Myung Oh, Kae Kyoung Kwon, Ilnam Kang, Sung Gyun Kang, Jung-Hyun Lee, Sang-Jin Kim, Jang-Cheon Cho: Complete Genome Sequence of “Candidatus Puniceispirillum marinum” IMCC1322, a Representative of the SAR116 Clade in the Alphaproteobacteria. In: Journal of Bacteriology, 26. Mai 2010 (englisch); doi:10.1128/JB.00347-10, PMID 20382761.
- ↑ Puniceispirillum phage HMO-2011 (species). NCBI.
- ↑ R. Lavigne, D. Seto, P. Mahadevan, H.-W. Ackermann, A. M. Kropinski: Unifying classical and molecular taxonomic classification: analysis of the Podoviridae using BLASTP-based tools. In: Research in Microbiology. Band 159, Nr. 5, 2008, S. 406–414, doi:10.1016/j.resmic.2008.03.005, PMID 18555669.
- ↑ ICTV Master Species List 2019.v1. ICTV. New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)




