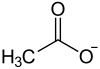
Lithiumacetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumacetat | |||||||||||||||
| Andere Namen |
Lithiumethanoat (IUPAC) | |||||||||||||||
| Summenformel | C2H3LiO2 | |||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff (Dihydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,23 g·cm−3 (Anhydrat)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lithiumacetat ist das Lithiumsalz der Essigsäure mit der Halbstrukturformel CH3COOLi.
Gewinnung und Darstellung
Lithiumacetat kann durch Salzbildungsreaktion aus Lithiumhydroxid und Essigsäure hergestellt werden.[4]
Ebenso ist die Synthese aus Lithiumcarbonat und Essigsäure unter Entwicklung von Kohlendioxid möglich.[4]
Eigenschaften
Lithiumacetat ist im Handel üblicherweise als weißes Dihydrat mit der Formel CH3COOLi · 2 H2O erhältlich.[5] Das Dihydrat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Cmm2 (Raumgruppen-Nr. 35) mit den Gitterkonstanten a = 686 pm, b = 1149 pm und c = 659 pm.[6] Das Anhydrat kristallisiert im triklinen Kristallsystem in der Raumgruppe P1 (Nr. 2) mit den Gitterkonstanten a = 929 pm, b = 1213 pm und c = 676 pm sowie α = 101°, β = 100° und γ = 105°.[2]
Verwendung
Lithiumacetat wird als Puffersubstanz bei der Gelelektrophorese von DNA und RNA, bei der Transformation von Hefezellen durch die Lithiumacetat-Methode.[7] In der Psychiatrie wird es im Zuge der Lithiumtherapie verwendet.[8] Weiterhin dient es als Katalysator in der Polyesterproduktion, als Korrosionsschutzmittel in Polyphenylsulfidharzen und als Katalysator in der Produktion von Alkydharzen und Acrylpolymeren.[9]
Einzelnachweise
- ↑ a b c Eintrag zu Lithium acetate dihydrate bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b C. Saunderson, R. B. Ferguson: Crystal data for anhydrous lithium acetate. In: Acta Cryst. (1961). 14, 321, doi:10.1107/S0365110X61001017.
- ↑ a b c d Eintrag zu Lithium acetate bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Ulrich Wietelmann, Richard J. Bauer: Lithium and Lithium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15_393.
- ↑ Datenblatt Lithium acetate dihydrate bei Sigma-Aldrich, abgerufen am 7. Juli 2019 (PDF).
- ↑ V. Amirthalingam, V. M. Padmanabhan: The crystal structure of lithium acetate dihydrate CH3COOLi.2H2O. In: Acta Cryst. Band 11, 1958, S. 896, doi:10.1107/S0365110X58002541.
- ↑ Michael Wink (Hrsg.): Molekulare Biotechnologie: Konzepte, Methoden und Anwendungen. 2. Auflage. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32655-6, S. 173 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ U. Consbruch, H. Koufen: Zur Pharmakokinetik von Lithiumsalzen bei akuten Belastungsversuchen Gesunder. In: Pharmacopsychiatry. Band 5, Nr. 2, 1972, S. 104–112, doi:10.1055/s-0028-1094337.
- ↑ FMC Lithium: lithium acetate dihydrate (PDF; 272 kB)







