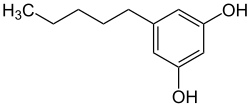
Olivetol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Olivetol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H16O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelblichweißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 180,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
162–164 °C (7 hPa)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Olivetol (5-Pentylresorcin) ist ein Naturstoff und das Pentyl-Derivat des Resorcins.
Vorkommen und Gewinnung

Olivetol kommt mit einem Anteil von bis zu 2,6 % in der Blasenflechte (Hypogymnia physodes) vor.[3] Es kommt außerdem als Pheromon in verschiedenen Insektenarten vor.
Chemische Eigenschaften
Da Olivetol durch die phenolischen Hydroxygruppen schwach sauer ist, kann es in basischen Lösungsmitteln gelöst werden.
Verwendung
Olivetol kommt durch die Nutzung des Extraktes der Blasenflechte in verschiedenen Parfüms zum Einsatz.
Durch Kondensation von Pulegon und Olivetol lässt sich Tetrahydrocannabinol synthetisieren.[4] Olivetolsäure (das Carbonsäure-Derivat des Olivetols) tritt in der Biosynthese von Hexahydrocannabinol auf.[5]
Einzelnachweise
- ↑ Robert Turkington: Chemicals Used for Illegal Purposes. John Wiley & Sons, 2009, ISBN 978-0-470-18780-7, S. 436 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d Datenblatt Olivetol, 95% bei Sigma-Aldrich, abgerufen am 21. Juni 2015 (PDF).
- ↑ Igor Stojanovic, Niko Radulovic, Tatjana Mitrovic, Slavisa Stamenkovic, Gordana Stojanovic: Volatile constituents of selected Parmeliaceae lichens. In: Journal of the Serbian Chemical Society. Band 76, Nr. 7, 2011, S. 987, doi:10.2298/JSC101004087S.
- ↑ U. Claussen, P. Mummenhoff, F. Korte: Haschisch—XVIII. In: Tetrahedron. Band 24, Nr. 7, Januar 1968, S. 2897, doi:10.1016/s0040-4020(01)98697-1.
- ↑ Raj K. Razdan: Total Synthesis of Natural Products. Hrsg.: John ApSimon. John Wiley & Sons, 1981, ISBN 978-0-470-12967-8, The Total Synthesis of Cannabinoids, S. 185–262, doi:10.1002/9780470129678.ch2 (PDF).





