Lithiumsulfat
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Li+ _ S6+ _ O2− | ||||||||||||||||
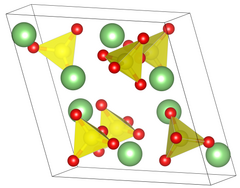
| Kristallsystem |
monoklin | |||||||||||||||
| Raumgruppe |
P21/a (Nr. 14, Stellung 3)[1] | |||||||||||||||
| Gitterparameter |
a = 8,239 Å, b = 4,954 Å, c = 8,474 Å, β = 107,98° | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumsulfat | |||||||||||||||
| Andere Namen |
Dilithiumsulfat | |||||||||||||||
| Verhältnisformel | Li2SO4 | |||||||||||||||
| Kurzbeschreibung |
weißes Pulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,22 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
gut in Wasser (342 g·l−1 bei 25 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumsulfat ist eine chemische Verbindung des Lithiums aus der Gruppe der Sulfate.
Gewinnung und Darstellung
Lithiumsulfat wird durch Umsetzung von Lithiumcarbonat mit Schwefelsäure dargestellt.[4]
Eigenschaften
Lithiumsulfat kommt auch als Monohydrat vor, welches sich bei 130 °C zum Anhydrat umwandelt.[5] Das Monohydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21 (Raumgruppen-Nr. 4).[6] Das Anhydrat kristallisiert ebenfalls im monoklinen Kristallsystem, jedoch in der Raumgruppe Raumgruppe P21/c (Raumgruppen-Nr. 14) und 4 Formeleinheiten in der Elementarzelle.[7]
Verwendung
Lithiumsulfat wird in schnellbindendem Zement und in der Lithiumtherapie eingesetzt.[4] Markenname für Medikamente sind Lithionit und Durettes.[8]
Lithiumsulfat-Einkristalle werden zudem in der Piezoelektrik, Akustik, für Ultraschall-Sender sowie zur Lichtablenkung genutzt.[9]
Einzelnachweise
- ↑ A. G. Nord: Crystal structure of β-Li2SO4. In: Acta Crystallographica Section B. Band 32, 1976, S. 982–983, doi:10.1107/S0567740876004433.
- ↑ a b c Eintrag zu Lithiumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d Datenblatt Lithium sulfate bei Sigma-Aldrich, abgerufen am 3. September 2017 (PDF).
- ↑ a b Ulrich Wietelmann, Richard J. Bauer: Lithium and Lithium compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15_393.
- ↑ Eintrag zu Lithium sulfate in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 22. Januar 2014.
- ↑ L. Bayarjargal, L. Bohatý: Nonlinear optical properties of lithium sulfate monohydrate, Li2SO4·H2O. In: Acta Crystallographica Section A: Foundations of Crystallography. Band 61, A1, 2005, S. 393–394, doi:10.1107/S0108767305083339.
- ↑ Y. N. Zhuravlev, L. V. Zhuravleva, O. V. Golovko: Chemical bond in alkali metal sulfates. In: Journal of Structural Chemistry. Band 48, Nr. 5, 2007, S. 789–795, doi:10.1007/s10947-007-0120-y.
- ↑ E. Widerlöv: A comparative double-blind study of the side effects of Litarex and Lithionit Durettes. In: Acta Psychiatrica Scandinavica. Band 54, Nr. 4, 1976, S. 294–302, doi:10.1111/j.1600-0447.1976.tb00123.x, PMID 793305.
- ↑ Eintrag zu Lithiumsulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.






