Nonapeptide
Nonapeptide sind Peptide, die aus neun Aminosäuren bestehen und damit zu den Oligopeptiden gehören.
Lineare Nonapeptide
Bei linearen Nonapeptiden sind die einzelnen Bausteine der Aminosäuren in einer Kette über acht Peptidbindungen miteinander verknüpft.
Bradykinin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
 |  Bradykinin kommt im Blutplasma vor[2] |
Das Kinin Bradykinin zählt zu den Gewebshormonen und wurde 1948 von einer Gruppe um den Brasilianer Maurício Rocha e Silva (1910–1983)[3] im Blutplasma entdeckt, als das Gift der Lanzenotter Bothrops jararaca einem Hund injiziert wurde.[4][2] Wie bei diesen Kininen üblich wirkt es blutdrucksenkend, erhöht die Gefäßpermeabilität und führt zur Kontraktion der glatten Muskulatur von Darm, Uterus und Bronchien.[4] Dieses Nonapeptid wird ausgeschüttet, wenn der Körper auf ein Trauma oder eine Verletzung reagiert. Dabei werden Botenstoffe durch die Leukozyten freigesetzt, was darauf hindeutet, dass Bradykinin u. a. am Schmerzempfinden und Entzündungen beteiligt ist.[5] So wird infolge einer Injektion von Bradykinin z. B. Schmerz empfunden und es werden Schwellungen sichtbar.[6]
DSIP
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
 |  DSIP wurde im zerebralem venösem Blut von Kaninchen entdeckt[7] |
DSIP ist die Abkürzung für Delta Sleep Inducing Peptide, was so viel bedeutet wie schlafinduzierendes Peptid. 1963 wurde durch den Schweizer Physiologen Marcel Monnier (1907–1996)[8] entdeckt, dass es möglich ist, Schlaf von einem Kaninchen auf ein anderes Kaninchen zu übertragen. Dazu wurde bei einem Kaninchen Schlaf durch elektrische Stimulation des Thalamus induziert und dieser bei einem anderen durch Austausch der Körpersäfte (d. h. humoral) induziert.[9] Daraufhin begann die Suche nach dem Stoff, der für dies verantwortlich ist. 1976 konnte dieser Stoff, das Nonapeptid DSIP, endgültig aus zerebralem venösem Blut von Kaninchen isoliert werden.[7] DSIP bzw. DSIP-ähnliche Peptide kommen in verschiedenen Säugetieren und wechselwarmen Wirbeltieren vor.[10] Im jeweiligen Organismus wirken die Peptide an verschiedenen regulatorischen Mechanismen mit, wie bspw.:[10]
- Minderung des basalen Corticotropinspiegels
- Absonderung des Luteinisierenden Hormons
- Absenkung des Stresslevels
- In der Immunreaktion als immunmodulatorischer Faktor oder Antitumormittel
- Normalisierung des Blutdrucks
- Unterdrückung der Alkohol- und Opiat-Abhängigkeit
Obwohl das Peptid „schlafinduzierendes Peptid“ heißt, sind die Auswirkungen auf den Schlaf umstritten.[11]
Phyllocaerulein
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
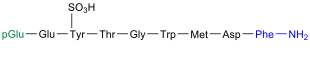 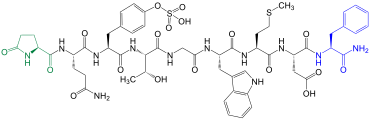 |  Phyllocaerulein kommt in der Haut des Frosches Phyllomedusa sauvagei vor[12] |
Das Neuropeptid Phyllocaerulein (auch: Phyllocerulein) wurde 1969 von einer Gruppe um den italienischen Pharmakologen Vittorio Erspamer (1909–1999) aus der Haut des Frosches Phyllomedusa sauvagei isoliert.[12] Phyllocaerulein ist dem Decapeptid Caerulein sehr ähnlich und zeigt die gleiche Wirkung.[12] Dazu gehört, dass das Nonapeptid Einfluss auf den Blutdruck nimmt,[13] zur Kontraktion der Gallenblase führt[14] sowie die Magensäure- und Pankreas-Sekretion steigert.[12][15]
Teprotid
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
 |  Teprotid kommt im Gift der Lanzenotter Bothrops jararaca vor[16] |
1970 konnten von einer Gruppe um den brasilianischen Pharmakologen Sérgio Henrique Ferreira (1934–2016) Peptide aus dem Gift der Lanzenotter Bothrops jararaca isoliert werden, die Bradykinin-potenzierend wirken, weil sie ACE-Hemmer sind.[16] Eines dieser Peptide wurde später als Teprotid bezeichnet.[16][17][18] Aufgrund von geringem kommerziellen Interesse wurde dieser Stoff nicht weiterentwickelt: Teprotid war zu teuer und konnte nicht oral verabreicht werden.[19]
Cyclische Nonapeptide
Cyclische Nonapeptide sind ringförmige Peptide. Durch Ausbildung einer neunten Peptidbindung kann eine monocyclische Verbindung entstehen. Eine Cyclisierung ist ebenfalls durch andere kovalente Bindungen wie etwa einer Disulfidbrückenbindung in Oxytocin und Arginin-Vasopressin möglich.
Arginin-Vasopressin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
  |  |
1927 gelang es Oliver Kamm und Kollegen, aus der Hypophyse zwei Extrakte zu isolieren. Durch den einen Extrakt wurden Aktivitäten gezeigt, die typisch für Oxytocin sind, und durch den anderen wurde u. a. der Blutdruck gesteigert.[20] Diese Komponente wurde Vasopressin genannt.[21]
Ein paar Jahre später wurde herausgefunden, dass es zwei Varianten von Vasopressin gibt: Arginin-Vasopressin, welches im Menschen, Rind, Schaf, Pferd und Katze vorkommt, und Lysin-Vasopressin, welches in Schweinen vorkommt.[22][23] Der Unterschied zwischen diesen beiden Varianten besteht darin, dass Lysin-Vasopressin anstelle eines Arginin-Bausteins einen Lysin-Baustein enthält.[22]
1958 gelang die Synthese des Nonapeptids Arginin-Vasopressin einer Gruppe um den US-amerikanischen Biochemiker Vincent du Vigneaud (1901–1978).[24] Neben der blutdrucksteigernden Eigenschaft trägt Arginin-Vasopressin im Allgemeinen dazu bei, die Homöostase aufrechtzuerhalten (Wasserretention, Erhöhung des Arousals …) und wird daher auch als eigennütziges Peptid bezeichnet.[25]
Oxytocin
| Aminosäurensequenz nach IUB/IUPAC[1] (mit interaktivem Schaltfeld) und Strukturformel (mit grün gefärbtem N-Terminus und blau gefärbtem C-Terminus) | Natürliches Vorkommen |
  |  |
Der britische Biochemiker Henry Dale (1875–1968) hat 1906 festgestellt, dass es in der Hypophyse Stoffe gibt, die u. a. ein Zusammenziehen des Uterus bewirken.[26] Damit war das zu den Proteohormonen zählende Neuropeptid Oxytocin entdeckt. 1953 wurde die Aminosäuresequenz des Nonapeptids von dem US-amerikanischen Biochemikers Vincent du Vigneaud (1901–1978) erarbeitet.[27] Durch ihn erfolgte im gleichen Jahr ebenfalls die Synthese des Stoffes.[28] Neben der Kontraktion des Uterus ist für die Wirkungsweise von Oxytocin z. B. die positive Beeinflussung der sozialen Interaktion zwischen Mutter und Kind charakteristisch.[29] Aufgrund genereller positiver Auswirkung auf das soziale Verhalten wird Oxytocin auch als uneigennütziges Peptid bezeichnet.[25] Daneben senkt dieses Peptid den Blutdruck und den Kortisolspiegel. Es kann sedierend wirken sowie zur Gewichtszunahme und einer verbesserten Wundheilung führen.[29]
Siehe auch
Einzelnachweise
- ↑ a b c d e f G. D. Fassman (Hrsg.): Handbook of Biochemistry an Molecular Biology. (= Proteins. Volume I). 3. Auflage. CRC Press, Cleveland 1976, ISBN 0-87819-504-1, S. 1–108.
- ↑ a b M. Rocha e Silva, W. T. Beraldo, G. Rosenfeld: Bradykinin, a Hypotensive and Smooth Muscle Stimulating Factor Released from Plasma Globulin by Snake Venoms and by Trypsin. In: American Journal of Physiology. Band 156, Nr. 2, 1949, S. 261–273. PMID 18127230.
- ↑ B. J. Hawgood: Maurício Rocha E Silva MD: Snake venom, bradykinin and the rise of autopharmacology. In: Toxikon. Band 35, Nr. 11, 1997, S. 1569–1580, doi:10.1016/S0041-0101(97)00008-1.
- ↑ a b H.-D. Jakubke: Peptide. Spektrum Akademischer Verlag, Heidelberg/ Berlin/ Oxford 1996, ISBN 3-8274-0000-7, S. 65.
- ↑ J. E. Taylor, F. V. DeFeudis, J. P. Moreau: Bradykinin-antagonists: Therapeutic perspectives. In: Drug Development Research. Band 16, Nr. 1, S. 1–11, doi:10.1002/ddr.430160102.
- ↑ C. W. Parker: Mediators: Release and Function. In: W. E. Paul: Fundamental Immunology. Raven Press, New York 1984, ISBN 0-89004-923-8.
- ↑ a b G. A. Schoenenberger, P. F. Maier, H. J. Tobler, M. Monnier: A naturally occurring delta-EEG enhancing nonapeptide in rabbits – X. Final isolation, characterization and activity test. In: Pflügers Archive. Band 369, Nr. 2, S. 99–109, doi:10.1007/BF00591565.
- ↑ Universität Basel: Prof. Marcel Monnier. ( vom 1. Dezember 2017 im Internet Archive) In: Universität Basel 1460–2010 – Rückblick auf die letzten 50 Jahre des Instituts für Physiologie. 2010, abgerufen am 29. Juni 2017.
- ↑ M. Monnier, T. Koller, S. Graber: Humoral Influences of Induced Sleep and Arousal upon Electrical Brain Activity of Animals with Crossed Circulation. In: Experimental Neurology. Band 8, Nr. 3, 1963, S. 264–277, doi:10.1016/0014-4886(63)90036-0.
- ↑ a b V. M. Kovalzon, T. V. Strekalova: Delta sleep-inducing peptide (DSIP): a still unresolved riddle. In: Journal of Neurochemistry. Band 97, Nr. 2, 2006, S. 303–309, doi:10.1111/j.1471-4159.2006.03693.x.
- ↑ A. A. Borbély, I. Tobler: Endogenous Sleep-Promoting Substances and Sleep Regulation. In: Physiological reviews. Band 69, Nr. 2, 1989, S. 605–670. PMID 2564687.
- ↑ a b c d A. Anastasi, G. Bertaccini, J. M. Cei, G. Caro, V. Erspamer, M. Impicciatore: Structure and pharmacological actions of phyllocaerulein, a caerulein‐like nonapeptide: its occurrence in extracts of the skin of Phyllomedusa sauvagei and related Phyllomedusa species. In: British Journal of Pharmacology. Band 37, Nr. 1, 1969, S. 198–206, doi:10.1111/j.1476-5381.1969.tb09538.x.
- ↑ G. Bertaccini, G. de Caro, R. Endean, V. Erspamer, M. Impicciatore: The action of caerulein on the systematic arterial blood pressure of some experimental animals. In: British Journal of Pharmacology. Band 33, Nr. 1, 1968, S. 59–71, doi:10.1111/j.1476-5381.1968.tb00474.x.
- ↑ G. Bertaccini, G. de Caro, R. Endean, V. Erspamer, M. Impicciatore: The actions of caerulein on the smooth muscle of the gastrointestinal tract and the gall bladder. In: British Journal of Pharmacology. Band 34, Nr. 2, 1968, S. 291–310, doi:10.1111/j.1476-5381.1968.tb07052.x.
- ↑ V. Erspamer, G. F. Erspamer, C. Severini, R. L. Potenza, D. Barra, G. Mignogna, A. Bianchi: Pharmacological studies of ‘sapo’ from the frog Phyllomedusa bicolor skin: A drug used by the Peruvian Matses Indians in shamanic hunting practices. In: Toxicon. Band 31, Nr. 9, 1993, S. 1099–1111, doi:10.1016/0041-0101(93)90125-3.
- ↑ a b c S. H. Ferreira, D. C. Bartelt, L. J. Greene: Isolation of Bradykinin-Potentiating Peptides from Bothrops jararaca Venom. In: Biochemistry. Band 9, Nr. 13, 1970, S. 2583–2593, doi:10.1021/bi00815a005.
- ↑ M. A. Ondetti, N. J. Williams, E. F. Sabo, J. Pluscec, E. R. Weaver, O. Kocy: Angiotensin-Converting Enzyme Inhibitors from the Venom of Bothrops jararaca. Isolation, Elucidation of Structure, and Synthesis. In: Biochemistry. Band 10, Nr. 22, 1971, S. 4033–4039, doi:10.1021/bi00798a004.
- ↑ D. W. Cushman, M. A. Ondetti: History of the Design of Captopril and Related Inhibitors of Angiotensin Converting Enzyme. In: Hypertension. Band 17, Nr. 4, 1991, S. 589–592, doi:10.1161/01.HYP.17.4.589.
- ↑ K. Nemec, M. Schubert-Zsilavecz: Vom Teprotid zum Captopril. Rationales Design von ACE-Hemmern. In: Pharmazie in unserer Zeit. Band 32, Nr. 1, 2003, S. 11–16, doi:10.1002/pauz.200390001.
- ↑ a b O. Kamm, T. B. Aldrich, I. W. Grote, L. W. Rowe, E. P. Bugbee: THe active principles of the posterior lobe of the pituitary glad. I. The demonstration of the presence of two active principles. II. The seperation of the two principles and their concentration in the form of potent solid preperations. In: Journal of the American Chemical Society. Band 50, Nr. 2, 1928, S. 573–601, doi:10.1021/ja01389a050.
- ↑ a b A. W. Bourne, J. H. Burn: The action of oxytocin and vasopressin on the uterus in labour. In: The Lancet. Band 212, Nr. 5484, 1928, S. 694–695, doi:10.1016/S0140-6736(00)84559-.
- ↑ a b E. A. Popenoe, H. C. Lawler, V. du Vigneaud: Partial purification and amino acid content of vasopressin from hog piturity glands. In: Journal of the American Chemical Society. Band 74, Nr. 14, 1952, S. 3713, doi:10.1021/ja01134a528.
- ↑ W. Sneader: Drug Discovery: A History. John Wiley & Sons, Chichester, 2005, ISBN 0-470-01553-5, S. 168, doi:10.1002/0470015535.ch14.
- ↑ V. du Vigneaud, D. T. Gish, P. G. Katsoyannis, G. P. Hess: Synthesis of the Pressor-Antidiuretic Hormone, Arginine-Vasopressin. In: Journal of the American Chemical Society. Band 80, Nr. 13, 1958, S. 33553–358, doi:10.1021/ja01546a040.
- ↑ a b J.-J. Legros: Inhibitory effect of oxytocin on corticotrope function in humans: are vasopressin and oxytocin ying–yang neurohormones? In: Psychoneuroendocrinology. Band 26, Nr. 7, 2001, S. 649–655, doi:10.1016/S0306-4530(01)00018-X.
- ↑ a b H. H. Dale: On some physiological actions of ergot. In: The Journal of Physiology. Band 34, Nr. 3, 1906, S. 163–206, doi:10.1113/jphysiol.1906.sp001148.
- ↑ V. du Vigneaud, C. Ressler, S. Trippett: The sequence of amino acids in oxytocin, with a proposal for the structure of oxytocin. In: The Journal of biological chemistry. Band 205, Nr. 2, 1953, S. 949–957. PMID 13129273.
- ↑ V. du Vigneaud, C. Ressler, C. J. M. Swan, C. W. Roberts, P. G. Katsoyannis, S. Gordon: The Synthesis of an Octapeptide Amide with the Hormonal Activity of Oxytocin. In: Journal of the American Chemical Society. Band 75, Nr. 19, S. 4879–4880, doi:10.1021/ja01115a553.
- ↑ a b K. Uvnäs-Moberg: Oxytocin may mediate the benefits of positive social interaction and emotions. In: Psychoneuroendocrinology. Band 23, Nr. 8, 1998, S. 819–835, doi:10.1016/S0306-4530(98)00056-0.







