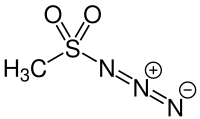
Methansulfonylazid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Methansulfonylazid | |||||||||
| Summenformel | CH3N3O2S | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 121,12 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Methansulfonylazid (kurz Mesylazid) ist das Azidderivat der Methansulfonsäure. Es wird als Reagenz zur Herstellung von Diazoverbindungen verwendet.
Herstellung
Methansulfonylazid kann ausgehend von Methansulfonylchlorid durch Umsetzung mit Natriumazid in Ethanol[1] oder Methanol[2] hergestellt werden. Auch die Herstellung in situ ist möglich, beispielsweise in Acetonitril, und ist vorteilhaft um Explosionsgefahren zu vermeiden.[3]
Eigenschaften
Methansulfonylazid schmilzt bei 18 °C und zersetzt sich ab 120 °C.[1] Wie viele andere Azide ist es explosiv.[3] Bei niedriger Temperatur kristallisiert Methansulfonylazid im triklinen Kristallsystem in der Raumgruppe P1 (Raumgruppen-Nr. 2) mit den Gitterparametern a =5,6240 Å; b = 5,9498 Å, c = 7,6329 Å, α = 72,216°, β = 70,897° und γ = 88,601° sowie zwei Formeleinheiten pro Elementarzelle.[1]
Reaktionen
Methansulfonylazid ist ein Reagenz, das sich zum Einführen von Diazogruppen in andere Verbindungen eignet. Früher wurde hierzu vor allem Tosylazid verwendet. Inzwischen werden jedoch oft Verbindungen verwendet, die weniger explosionsgefährlich sind und / oder nach dem Diazo-Transfer ein Amid bilden, das sich leicht von den Reaktionspordukten abtrennen lässt. Neben Imidazol-1-sulfonylazid und 4-Acetamidobenzolsulfonylazid wird auch Methansulfonylazid verwendet.[4] Vorteile von Methansulfonylazid sind insbesondere die einfache und billige Herstellung und die einfache Aufreinigung des Reaktionsgesmischs.[2] Ausgehend von Bromacetophenon durch Reaktion mit Trimethylphosphit, sowie anschließend mit Natriumhydrid und Methansulfonylazid, kann ein Diazoreagenz hergestellt werden, mit dem Aldehyde in Alkine umgewandelt werden können. Dies funktioniert analog zur Reaktion mit dem Ohira-Bestmann-Reagenz, das jedoch deutlich teurer herzustellen ist.[5]
Die Photolyse von Methansulfonylazid in einer Matrix aus Argon oder Neon ergibt ein kurzlebiges Nitren.[1] Wird Methansulfonylazid in Gegenwart eines Kohlenwasserstoffs bestrahlt, entsteht Methansulfonylamid, sowie durch Reaktion mit dem Kohlenwasserstoff, N-substituierte Derivate.[6]
Einzelnachweise
- ↑ a b c d Guohai Deng, Dingqing Li, Zhuang Wu, Hongmin Li, Eduard Bernhardt, Xiaoqing Zeng: Methanesulfonyl Azide: Molecular Structure and Photolysis in Solid Noble Gas Matrices. In: The Journal of Physical Chemistry A. Band 120, Nr. 28, 21. Juli 2016, S. 5590–5597, doi:10.1021/acs.jpca.6b05533.
- ↑ a b Douglass F. Taber, Robert E. Ruckle, Michael J. Hennessy: Mesyl azide: a superior reagent for diazo transfer. In: The Journal of Organic Chemistry. Band 51, Nr. 21, Oktober 1986, S. 4077–4078, doi:10.1021/jo00371a034.
- ↑ a b Denis Lynch, Rosella M. O'Mahony, Daniel G. McCarthy, Lorraine M. Bateman, Stuart G. Collins, Anita R. Maguire: Mechanistic Study of In Situ Generation and Use of Methanesulfonyl Azide as a Diazo Transfer Reagent with Real‐Time Monitoring by FlowNMR. In: European Journal of Organic Chemistry. Band 2019, Nr. 22, 16. Juni 2019, S. 3575–3580, doi:10.1002/ejoc.201900184.
- ↑ Gerhard Maas: New Syntheses of Diazo Compounds. In: Angewandte Chemie International Edition. Band 48, Nr. 44, 19. Oktober 2009, S. 8186–8195, doi:10.1002/anie.200902785.
- ↑ Douglass F. Taber, Sha Bai, Peng-fei Guo: A convenient reagent for aldehyde to alkyne homologation. In: Tetrahedron Letters. Band 49, Nr. 48, November 2008, S. 6904–6906, doi:10.1016/j.tetlet.2008.09.114, PMID 19946355, PMC 2634292 (freier Volltext).
- ↑ Noboru Torimoto, Tadao Shingaki, Toshikazu Nagai: Sensitized photolyses of methanesulfonyl azide in hydrocarbons. In: The Journal of Organic Chemistry. Band 43, Nr. 4, Februar 1978, S. 631–633, doi:10.1021/jo00398a023.






