Clostridium septicum
| Clostridium septicum | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
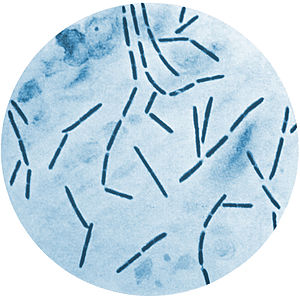
Clostridium septicum | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Clostridium septicum | ||||||||||||
| (Macé 1889) Ford 1927 |
Clostridium septicum ist ein grampositives Bakterium aus der Gattung Clostridium und der Krankheitserreger mehrerer Infektionskrankheiten, wie Gasbrand beim Menschen, Pararauschbrand bei Tieren (z. B. bei Rindern und Schafen) und dem Labmagenpararauschbrand der Schafe. Die Zellen sind strikt anaerob, sie können sich also nur vermehren, wenn kein Sauerstoff vorhanden ist. Bei Clostridium septicum handelt es sich um ein sporenbildendes Bakterium, dessen Sporen hitzeresistent sind. Entdeckt wurde das Bakterium 1877 von Louis Pasteur und Jules Joubert, sie benannten es Vibrion septique.
Merkmale
Erscheinungsbild
Clostridium septicum ist ein grampositives, mittellanges, stäbchenförmiges Bakterium.[1] Eine einzelne Zelle ist 3,0–14,0 µm (Mikrometer) lang und 1,1–1,6 µm breit. Die Zellen sind durch peritrich angeordnete Flagellen zur aktiven Bewegung fähig. Die Bakterienzellwand ist nicht von einer Kapsel umgeben.[2] Unter ungünstigen Umweltbedingungen sind Clostridien in der Lage, Endosporen zu bilden, diese sind größer als die vegetative Zelle und führen zu einer Ausbuchtung der Mutterzelle. Weiterhin zeichnen sich die Sporen durch ihre Thermoresistenz aus, während die meisten vegetativen Bakterienzellen durch ein kurzzeitiges Erhitzen auf Temperaturen von etwa 80 °C (als Pasteurisierung bezeichnet) abgetötet werden, schadet diese Erhitzung den Endosporen nicht, sie sind noch lebensfähig und können wieder keimen.[1] Die Endosporen von C. septicum werden erst durch 20-minütiges Erhitzen bei 100 °C inaktiviert.[2]
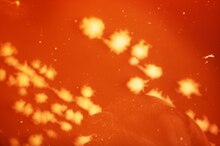
Auf festen Nährmedien wachsen nach Inkubation durch Vermehrung der Zellen sichtbare Kolonien, die von oben betrachtet nicht kreisrund, sondern amöboid erscheinen. Clostridium septicum zeigt aufgrund der Flagellen der Bakterien die Tendenz, über die Oberfläche des Nährmediums zu schwärmen. In diesen Fällen sind keine Einzelkolonien erkennbar. Die gesamte Oberfläche ist mit einem „Bakterienrasen“ bedeckt, was eine quantitative Bestimmung der Keimzahl erschwert.[3]
Wachstum und Stoffwechsel
Als typische Vertreter der Clostridien wachsen sie obligat anaerob, sie können sich also nur vermehren, wenn kein Sauerstoff vorhanden ist, da dieser auf die Zellen toxisch wirkt. Als Anaerobier sind sie Katalase-negativ und Oxidase-negativ.[1] Das Temperaturoptimum zur Kultivierung von C. septicum liegt bei etwa 37 °C,[4] somit zählt das Bakterium zu den mesophilen Organismen. Der optimale pH-Wert für das Wachstum der meisten untersuchten Stämme liegt im neutralen Bereich (pH 7,0 bis 7,2).[5]
Das Bakterium kann in einem Nährmedium kultiviert werden, das neben Kohlenhydraten (meist Glucose) noch Fleischextrakt, Hefeextrakt, Pepton oder Aminosäuren, Vitamine und weitere komplexe Wachstumsfaktoren (z. B. Hämine und verschiedene Mineralstoffe) enthält. Da Sauerstoff für die Zellen von C. septicum toxisch ist, muss das Medium vor der Beimpfung anoxisch sein. Dies wird durch Aufkochen und Abkühlen unter Stickstoffatmosphäre erreicht. Auch bei der Beimpfung und Inkubation muss auf strikte Einhaltung der Anaerobentechnik geachtet werden.[4]
Genetik
Das Genom eines Stammes von Clostridium septicum wurde vollständig sequenziert,[6] befindet sich nach Angaben des beteiligten Instituts jedoch noch im Status Draft (Entwurf).[7] Mehrere DNA-Sequenzen, die die Virulenzfaktoren des Krankheitserregers codieren, wurden im Zeitraum von 1993 bis 2011 bereits untersucht[8] und bilden die Grundlage für seine Nachweismethoden.
Pathogenität

Clostridium septicum ist krankheitserregend, er wird durch die Biostoffverordnung in Verbindung mit der TRBA 466 der Risikogruppe 2 zugeordnet.[9] Er ist der Erreger mehrerer Infektionskrankheiten bei Mensch und Tier.
Die Pathogenität von Clostridium septicum beruht auf der Freisetzung von Exotoxinen, ähnlich wie bei Clostridium botulinum und des von ihm produzierten Botulinumtoxins. Das für C. septicum bedeutsame α-Toxin ist für die Symptome der Infektionskrankheit Gasbrand verantwortlich. Es zählt zu den cytolytischen Toxinen (Zytotoxine), da seine Wirkung zur Lyse („Auflösung“) der Zellen führt.[10] Das toxische Protein führt bei infizierten Zellen zur Ausbildung von Ionen-durchlässigen Kanälen in der Zellmembran. Bei den untersuchten Zellkulturen führt dies schnell zum Zelltod (Nekrose), bedingt durch das Ausströmen von Kalium-Ionen.[11] Weitere Untersuchungen führen als Ursache für die Nekrose das Einströmen von Calcium-Ionen durch die Ionenkanäle an.[12] Bei einer Infektion mit Gasbrand schädigt das Alpha-Toxin auch Erythrozyten, sodass es durch seine hämolytische und nekrotisierende Wirkung als letales Toxin angesehen wird.[13]
Nachweise
Für einen Nachweis des Bakteriums muss es kultiviert werden. Dabei sind die Nährstoffansprüche an das Nährmedium hoch, es müssen zahlreiche komplexe Wachstumsfaktoren enthalten sein.[5] Außerdem muss bei der Beimpfung und Inkubation die Anaerobentechnik angewendet werden. Der kulturelle Nachweis ist stets mit zeitaufwendig, da die Vermehrung der Bakterien auf dem Nährmedium bis zur Bildung sichtbarer Kolonien mehrere Tage dauert, es schließen sich dann noch Nachweismethoden an. Der kulturelle Nachweis ist aber oft erforderlich, um eine Identifizierung des Bakteriums in einer Probe zu gewährleisten und um Reinkulturen für Untersuchungen zur Verfügung zu haben.
Bei klinischen Proben ist es aus Zeitgründen notwendig, zu einer schnelleren Identifizierung zu gelangen, damit möglichst bald therapeutische Maßnahmen, wie eine Behandlung mit Antibiotika, erfolgen können. Hierzu wird die direkte Immunfluoreszenz angewendet, bei der Antikörper mit Fluoreszenzfarbstoffen markiert sind. Das zu untersuchende Antigen ist ein Teil des Bakteriums. Die markierten Antikörper binden an die Antigene (Antigen-Antikörper-Reaktion) und die Detektion der Bakterien erfolgt direkt im Fluoreszenzmikroskop.[10][14]
Unter den Tierseuchen sind die bei Rindern und Schafen anzutreffenden Infektionskrankheiten Rauschbrand (verursacht durch Clostridium chauvoei) und Pararauschbrand (verursacht durch C. septicum) an ihren Symptomen nicht zu unterscheiden. Daher ist der Nachweis der Bakterien von Bedeutung. Da sich die beiden Arten phänotypisch sehr ähnlich sind, hat das Friedrich-Loeffler-Institut (FLI) – Bundesforschungsinstitut für Tiergesundheit – ein Multiplex PCR-Verfahren entwickelt. Es basiert auf dem Nachweis des „spo0A-Gens“ basiert und ermöglicht es, gleichzeitig C. chauvoei und C. septicum in klinischen Proben zu identifizieren.[15] Seit 2010 wird das Verfahren am Institut für bakterielle Infektionen und Zoonosen, einer Forschungseinrichtung des FLI, eingesetzt. Für Deutschland ist das Institut das Nationale Referenzlabor für Rauschbrand.[14]
Bei der Untersuchung von Geflügelbeständen auf das Vorhandensein von C. septicum als Krankheitserreger werden Gewebeproben als Untersuchungsmaterial verwendet. Als Alternative zum kulturellen Nachweis wird das durch den Erreger gebildeten Alpha-Toxin untersucht. Hierbei ist der Teil des Genoms, in dem die Toxinbildung codiert ist, Ziel der Untersuchung. Der Nachweis erfolgt mit Hilfe des real-time PCR Verfahrens, dabei ist die Unterscheidung von anderen Toxinen, die durch verwandte Clostridium-Arten gebildet werden, möglich.[3]
Vorkommen
Clostridium septicum kommt im Boden vor, von wo aus es mit Hilfe der Endosporen weiter verbreitet wird. Während die vegetativen Zellen empfindlich auf Luftsauerstoff reagieren, gilt dies für die Endosporen nicht, so dass sie ubiquitär verbreitet, also fast überall zu finden sind.[10] Bei den Tierseuchen ist die Verbreitung der Endosporen auf Futterpflanzen von Bedeutung. Bei infizierten Menschen oder Tieren sind verschiedene Gewebetypen oder Organe betroffen, beispielsweise der Darm oder der Labmagen bei Wiederkäuern, in denen das Bakterium dann nachweisbar ist.
Systematik
Äußere Systematik
Die Verwertung von Kohlenhydraten geschieht bei Clostridien durch Fermentation. Dabei erfolgt zunächst der schrittweise Abbau von Monosacchariden (Einfachzuckern) wie z. B. D-Glucose (Traubenzucker) in der Glykolyse zu Pyruvat. Unter anaeroben Bedingungen muss das dabei verbrauchte NAD+ (Nicotinamidadenindinukleotid) wieder regeneriert werden, dies erfolgt durch die erfolgt durch die Buttersäuregärung oder andere Gärungen.[10] Neben den saccharolytischen Clostridien (die v. a. Kohlenhydrate vergären) gibt es auch Clostridien, die Aminosäuren, Peptone bzw. Proteine in einer Gärung abbauen, sie werden als peptolytische oder proteolytische Clostridien bezeichnet.[4] Bei vielen dieser Gärungen sind Butyrat (das Anion der Buttersäure), Acetat (Anion der Essigsäure), Kohlendioxid (Gas) und gasförmiger Wasserstoff (H2) die charakteristischen Produkte der Gärung. Zu den Gasbranderregern gehören sowohl Zucker- als auch Aminosäure-Gärer.[10]
Die Unterscheidung von Clostridium chauvoei (Erreger des Rauschbrand) und Clostridium septicum (Erreger des Pararauschbrand) ist schwierig, da sich die beiden Arten in vielen phänotypischen Merkmalen ähneln. Tatsächlich haben genetische Untersuchungen ergeben, dass 99,3 % der Nukleotide im Genom von C. chauvoei und C. septicum identisch sind.[16]
Etymologie
Der Gattungsname lässt sich auf das Aussehen der durch die Endosporen spindelförmig aufgetriebenen Bakterienzellen zurückführen (aus dem Altgriechischen für „Spindel“). Der Artname verweist auf das griechische Wort σῆψις sēpsis und bedeutet „Fäulnis“, es findet sich ebenfalls in dem Begriff Sepsis (Blutvergiftung) als ein Krankheitssymptom wieder. Entdeckt wurde das Bakterium 1877 von Louis Pasteur und Jules Joubert in Milzbrand-Kadavern, es wurde von ihnen als Vibrion septique benannt.[17]
Medizinische und veterinärmedizinische Bedeutung
Infektionsquellen
Der Infektionsweg von C. septicum kann oral erfolgen, dies ist insbesondere bei den Tierseuchen von Bedeutung. Hierbei ist mit Endosporen kontaminiertes Futter die Ursache. In Organen, in denen anaerobe Bedingungen vorhanden sind, wie im Darm, können die Sporen auskeimen und sich zu vegetativen Zellen entwickeln, die bei genügend hoher Anzahl dann eine Infektion verursachen. Eine wichtige Infektionsquelle ist Boden („Erde“), eine so genannte exogene Infektion ist das Ergebnis, wenn Verschmutzungen in eine tiefe Wunde gelangen, ähnlich wie dies bei Tetanus (Wundstarrkrampf) der Fall ist. Auch endogene Infektionen werden beobachtet – insbesondere bei Patienten mit einem geschwächten Immunsystem oder bei Patienten mit einem kolorektalem Karzinom (Darmkrebs) – hierbei breiten sich im Darm vorhandene Clostridien in andere Gewebe aus.[18]
Infektionskrankheiten beim Menschen
Zwar wird beim Menschen die Infektionskrankheit Gasbrand (andere Bezeichnungen sind u. a. Gasödem, Clostridium-Myositis und clostridiale Myonekrose) vor allem durch Clostridium perfringens verursacht, aber auch C. septicum gehört zu den Erregern dieser Krankheit. Es handelt sich um eine lokale Weichteilinfektion mit gasbildenden Clostridien. Durch den Stoffwechsel der Bakterien wird Gas (Kohlendioxid) gebildet, das das umliegende Gewebe zerstört und als Gasansammlung unter der Unterhaut spürbar ist. Die von C. septicum gebildeten Exotoxine führen zur Nekrose des Gewebes, wodurch dann die weitere Vermehrung der Bakterien ermöglicht wird, da keine Sauerstoffversorgung mehr über das Blut erfolgt. Der Krankheitsverlauf ist häufig sehr kurz, nach einer Inkubationszeit von fünf Stunden kann bereits nach wenigen Stunden der Tod eintreten, falls keine Behandlung erfolgt. Aber auch mit einer Therapie liegt die Letalitätsrate dieser Krankheit bei 40–60 %.[18]
Falls C. septicum der Krankheitserreger ist, ist die Sterblichkeitsrate oft noch höher. Besonders Kinder sind gefährdet, da bei ihnen die ersten unspezifischen Symptome oftmals nicht zu der richtigen Diagnose führen. Häufig ist bei ihnen der Magen-Darm-Trakt betroffen. In einer Fallstudie werden als Symptome Erbrechen, Durchfall, Blut im Stuhl, Bauchschmerzen sowie Appetitlosigkeit genannt, die bei 85 % der erkrankten Kinder auftraten.[19]
Infektionskrankheiten bei Tieren
Clostridium septicum verursacht bei Rindern, Schafen und Ziegen die Infektionskrankheit Pararauschbrand. Die Symptome sind die gleichen wie bei der Tierseuche Rauschbrand, die durch C. chauvoei verursacht wird und ähneln dem Gasbrand beim Menschen. Bei Schafen verursacht C. septicum v. a. Wund- und Geburtspararauschbrand,[20] ebenso ist die Infektion des Labmagens bekannt und wird als Labmagenpararauschbrand der Schafe oder als Nordische Bradsot bezeichnet. Sie tritt vorwiegend bei jungen Tieren im Alter von sechs Monaten bis zwei Jahren auf und ist durch den perakuten Verlauf mit Fieber und eine hohe Sterblichkeitsrate gekennzeichnet: innerhalb von wenigen Stunden sterben bis zu 50 % der infizierten Schafe.[2] Weiterhin ist C. septicum der Auslöser einer Infektionskrankheit bei Geflügel, die als gangräne Dermatitis bezeichnet wird.[3]
Therapie
Wegen des schnellen Krankheitsverlaufs der von Clostridium septicum verursachten Infektionen ist eine Behandlung schwierig. Beim Menschen werden neben chirurgischen Interventionen, z. B. Amputation betroffener Gliedmaßen, Antibiotika als begleitende Maßnahme zur Bekämpfung der Krankheitserreger verwendet. Dabei wird vor allem Penicillin G (Benzylpenicillin) eingesetzt, aber auch Cephalosporine.[18] Beim Auftreten der Tierseuchen müssen erkrankte Tiere isoliert werden, die übrigen Tiere werden mit einem polyvalenten Clostridien-Vakzin geimpft.[2]
Literatur
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1.
- Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3.
Weblinks
- Taxonomy Browser Clostridium septicum. In: Webseite des National Center for Biotechnology Information (NCBI). Abgerufen am 11. August 2013.
- GBIF-Datenbank: Clostridium septicum. In: gbif.org. Abgerufen am 26. Januar 2024 (englisch).
Einzelnachweise
- ↑ a b c Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3.
- ↑ a b c d Martin Ganter, Heinrich Behrens, Theodor Hiepe: Lehrbuch der Schafkrankheiten. 4. Auflage. Parey Verlag, Stuttgart 2001, ISBN 978-3-8304-4190-8.
- ↑ a b c A. P. Neumann, S. M. Dunham u. a.: Quantitative real-time PCR assay for Clostridium septicum in poultry gangrenous dermatitis associated samples. In: Molecular and cellular probes. Band 24, Nummer 4, August 2010, S. 211–218, ISSN 1096-1194. doi:10.1016/j.mcp.2010.04.001. PMID 20399850.
- ↑ a b c Katalog der Mikroorganismen. In: Webseite des Leibniz Institut DSMZ – Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH. Abgerufen am 11. August 2013.
- ↑ a b S. M. Hasan, J. B. Hall: Growth of Clostridium tertium and Clostridium septicum in chemically defined media. In: Applied and environmental microbiology. Band 31, Nummer 3, März 1976, S. 442–443, ISSN 0099-2240. PMID 180884. PMC 169793 (freier Volltext).
- ↑ Clostridium septicum. In: Webseite Genomes Online Database (GOLD). Abgerufen am 11. August 2013.
- ↑ Projects. In: Webseite Hattori Lab in the University of Tokyo. Abgerufen am 11. August 2013.
- ↑ Taxon Passport – Clostridium septicum. In: straininfo.net. Archiviert vom am 4. März 2016; abgerufen am 26. Januar 2024.
- ↑ BAuA: TRBA 466 – Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. (PDF; 775 KB) 4. Mai 2012, archiviert vom am 30. Oktober 2013; abgerufen am 26. Januar 2024.
- ↑ a b c d e Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, 1. Auflage. Spektrum Akademischer Verlag GmbH, Heidelberg/Berlin 2000, ISBN 978-3-8274-0566-1.
- ↑ O. Knapp, E. Maier u. a.: Clostridium septicum alpha-toxin forms pores and induces rapid cell necrosis. In: Toxicon : official journal of the International Society on Toxinology. Band 55, Nummer 1, Januar 2010, S. 61–72, ISSN 1879-3150. doi:10.1016/j.toxicon.2009.06.037. PMID 19632260.
- ↑ C. L. Kennedy, D. J. Smith u. a.: Programmed cellular necrosis mediated by the pore-forming alpha-toxin from Clostridium septicum. In: PLoS pathogens. Band 5, Nummer 7, Juli 2009, S. e1000516, ISSN 1553-7374. doi:10.1371/journal.ppat.1000516. PMID 19609357. PMC 2705182 (freier Volltext).
- ↑ T. I. Cortiñas, M. A. Mattar, A. M. Stefanini de Guzmán: Alpha-toxin production by Clostridium septicum at different culture conditions. In: Anaerobe. Band 3, Nummer 2–3, 1997 Apr-Jun, S. 199–202, ISSN 1075-9964. doi:10.1006/anae.1997.0105. PMID 16887590.
- ↑ a b FLI: Nationales Referenzlabor für Rauschbrand. Archiviert vom am 4. Mai 2014; abgerufen am 26. Januar 2024.
- ↑ M. Lange, H. Neubauer, C. Seyboldt: Development and validation of a multiplex real-time PCR for detection of Clostridium chauvoei and Clostridium septicum. In: Molecular and cellular probes. Band 24, Nummer 4, August 2010, S. 204–210, ISSN 1096-1194. doi:10.1016/j.mcp.2010.03.003. PMID 20362050.
- ↑ P. Kuhnert, S. E. Capaul u. a.: Phylogenetic positions of Clostridium chauvoei and Clostridium septicum based on 16S rRNA gene sequences. In: International journal of systematic bacteriology. Band 46, Nummer 4, Oktober 1996, S. 1174–1176, ISSN 0020-7713. PMID 8863454.
- ↑ LPSN: Genus Clostridium. In: bacterio.net. Archiviert vom am 3. November 2013; abgerufen am 26. Januar 2024 (englisch).
- ↑ a b c Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2.
- ↑ C. L. Smith-Slatas, M. Bourque, J. C. Salazar: Clostridium septicum infections in children: a case report and review of the literature. In: Pediatrics. Band 117, Nummer 4, April 2006, S. e796–e805, ISSN 1098-4275. doi:10.1542/peds.2005-1074. PMID 16567392. (Review).
- ↑ FLI: Amtliche Methodensammlung für anzeigepflichtige Tierseuchen. (PDF; 4,1 MB) Stand Mai 2009. Ehemals im (nicht mehr online verfügbar); abgerufen am 11. August 2013. (Seite nicht mehr abrufbar. Suche in Webarchiven)




