Ascorbinsäure
| Strukturformel | |
|---|---|
| Datei:Ascorbinsaeure.png | |

| |
| Allgemeines | |
| IUPAC-Name | (R)-5-[(S)-1,2-Dihydroxyethyl]-3,4-dihydroxy- 5H-furan-2-on |
| Trivialnamen |
|
| Synonyme |
|
| Summenformel | C6H8O6 |
| E-Nummer | 300 |
| CAS-Nummer | 50-81-7 |
| Kurzbeschreibung | farbloses Kristallpulver |
| Eigenschaften | |
| Molmasse | 176,13 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,65 g/cm3 |
| Schmelzpunkt | 190 °C |
| Siedepunkt | - (thermische Zersetzung > 192 °C) |
| pKs | pKs1: 4,17; pKs2: 11,57 |
| spez. Drehwert | +48° (c=1 in Methanol, 25 °C, 589,3 nm) |
| Löslichkeit | wasserlöslich, 330 g/Liter |
| Dosierung | |
| täglicher Bedarf | 100 mg |
| Überdosis | nicht bekannt |
| Essentiell | ja |
| Vorkommen | Acerolakirschen, Kiwi, Johannisbeeren/Cassis, Zitrusfrüchte |
| Vorlage:SI-Chemikalien | |
Ascorbinsäure (in der Biochemie auch Ascorbat) ist eine organische Säure. Weil sie leicht oxidierbar ist, wirkt sie antioxidativ. Sie ist sehr gut wasserlöslich und kristallisiert in Form eines farblosen Pulvers. Ihre wichtigste Eigenschaft ist die physiologische Wirkung als Vitamin.
Ein Stereoisomer der Ascorbinsäure, die L-(+)-Ascorbinsäure und deren Derivate, die die gleiche Wirkung haben wie L-(+)-Ascorbinsäure, werden unter der Bezeichnung Vitamin C zusammengefasst[1]. Der Sammelbegriff Vitamin C umfasst neben L-(+)-Ascorbinsäure alle Stoffe, die im Körper zu Ascorbinsäure umgesetzt werden können, so z. B. Dehydroascorbinsäure (DHA).
Ascorbinsäure ist licht- und sauerstoffempfindlich.
Geschichte
Der Skorbut war bereits im 2. Jahrtausend v. Chr. im Alten Ägypten als Krankheit bekannt. Auch der griechische Arzt Hippokrates und der römische Autor Plinius berichten darüber.
Bis ins 18. Jahrhundert war Skorbut die häufigste Todesursache auf Seereisen. Im Jahre 1747 untersuchte der englische Schiffsarzt James Lind diese Krankheit. Er nahm 12 Seeleute, die unter der Skorbut litten und teilte sie in sechs Gruppen zu je zwei Personen. Jeder Gruppe gab er zusätzlich zu den üblichen Nahrungsrationen einen weiteren speziellen Nahrungszusatz. Im Speziellen: Obstwein, Schwefelsäure, Essig, Gewürze und Kräuter, Seewasser, sowie Orangen und Zitronen. Er stellte fest, dass die Gruppe, welche die Zitrusfrüchte erhielt, eine rasche Besserung zeigte. 1757 veröffentlichte Lind dieses Resultat. Doch erst 1795 ließ die britische Marine die Nahrungsrationen auf See mit Zitronensaft ergänzen. Zusätzlich wurden auch Sauerkraut und Malz zur Skorbutprävention eingesetzt.
Im Jahr 1912 entdeckte der Biochemiker Casimir Funk nach Studien zu der Mangelerkrankung Beri-Beri, dass diese durch das Fehlen einer chemischen Substanz, Thiamin, verursacht wurde. Er prägte dafür das Kunstwort „Vitamin“.
1921 gab der Biochemiker Sylvester Zilva einer Mischung von aus Zitronensaft isolierten Substanzen, die in der Lage war, Skorbut zu heilen, die Bezeichnung Vitamin C[2]. Zwischen 1928 und 1934 gelang es dem ungarischen Wissenschaftler Albert von Szent-Györgyi Nagyrapolt, sowie Joseph L. Svirbely und unabhängig davon Charles Glen King durch Kristallisationsversuche die für die Heilung der Skorbut verantwortliche Substanz zu isolieren. 1934 stellte Györgyi fest, dass diese identisch mit der 1913 entdeckten L-Ascorbinsäure ist. Ebenfalls 1934 gelang Walter Haworth und Tadeus Reichstein erstmalig die Synthese künstlicher L-Ascorbinsäure aus Glucose[3]. Haworth erhielt 1937 für seine Forschungen am Vitamin C den Nobelpreis für Chemie, Szent Györgyi den für Medizin. 1967 wurde von Linus Pauling die Verwendung hoher Dosen von Ascorbinsäure als Vorbeugung gegen Erkältungen und Krebs propagiert, was jedoch teils umstritten ist (siehe unten).
Vorkommen
In der Nahrung kommt Vitamin C vor allem in Obst, Gemüse und Grüntee vor, sein Gehalt sinkt jedoch beim Kochen, Trocknen oder Einweichen sowie bei der Lagerhaltung. Zitrusfrüchte wie Orangen, Zitronen und Grapefruits enthalten – in reifem Zustand unmittelbar nach der Ernte – viel Vitamin C. Grünkohl hat den höchsten Vitamin-C-Gehalt aller Kohlarten (105 – 120 mg/100 g verzehrbare Substanz). In Kohlgemüse ist Ascorbinsäure in Form von Ascorbigen A und B gebunden. Wird das Gemüse gekocht, zerfallen die Moleküle in L-Ascorbinsäure und Indol, so dass es in gekochtem Zustand mehr Vitamin C enthalten kann als im rohen Zustand. Durch zu langes Kochen wird das Vitamin jedoch teilweise zerstört und auch in das (meist nicht verzehrte) Kochwasser abgegeben. Rotkraut, Weißkraut und Sauerkraut sind ebenfalls Vitamin-C-Lieferanten, was lange Zeit vor allem in der Seefahrt von Bedeutung war, da man zur Vorbeugung gegen Skorbut (siehe unten) ein haltbares, an Vitamin C reiches Nahrungsmittel benötigte, wozu sich Sauerkraut am besten eignete. Die höchsten natürlichen Vitamin-C-Konzentrationen hat man in Camu-Camu und in der Acerolakirsche gefunden.
Viele Gemüsearten enthalten eine Ascorbat-Oxidase, die insbesondere durch Zerkleinern mit dem Vitamin in Berührung kommt und dieses oxidiert. Das führt z. B. bei Rohkost, die nicht sofort verzehrt wird, zu erheblichen Vitamin-C-Verlusten.
Hier der Vitamin C-Gehalt einiger Früchte / Gemüse je 100 g, geordnet nach absteigendem Vitamin C-Gehalt:
|
|
Die Angaben dienen nur der Orientierung, die tatsächlichen Werte hängen stark von den folgenden Parametern ab:
- Sorte der Pflanze
- Bodenbeschaffenheit
- Klima während des Wachstums
- Lagerdauer seit der Ernte
- Lagerbedingungen
- Zubereitung
Herstellung und Verwendung

Die Jahresproduktion für Ascorbinsäure liegt weltweit bei etwa 110.000 Tonnen. Marktführer war lange Zeit die Schweizer Hoffmann-La Roche (30 % Weltumsatz) gefolgt vom BASF-NPEG Kartell (auch etwa 30 %) und der Firma Merck. 2002 hat Hoffmann-La Roche seine Vitaminsparte für 3,4 Milliarden Schweizer Franken (etwa 2,1 Milliarden Euro) an die holländische DSM verkauft. Ascorbinsäure wird zur Zeit hauptsächlich in China produziert.
In chemischen Fabriken wird aus der Ausgangssubstanz D-Glucose über Sorbitol kristalline Ascorbinsäure, Natriumascorbat, Calciumascorbat und Ascorbylmonophosphat hergestellt. Die sogenannte Reichstein-Synthese (1934) ist bis heute die Grundlage dieser industriellen Produktion.
Zur Unterscheidung von diesem synthetisch hergestellten Produkt wird ein mit Hilfe gentechnisch veränderter Mikroorganismen hergestelltes Vitamin C international mit GMO-Vitamin C (GMO=genetically manipulated organism, genetisch veränderter Organismus) bezeichnet. GMO-Ascorbinsäure ist preiswerter; nach diesem Verfahren wird weltweit der größere Teil hergestellt.
Ascorbinsäure findet hauptsächlich als Antioxidans Verwendung. Sie wird vielen Lebensmittelprodukten als Konservierungsmittel beziehungsweise Umrötungshilfsmittel unter der Nummer E 300 zugesetzt. Weitere E-Nummern von Ascorbinsäurederivaten sind: E 301 − Natriumascorbat; E 302 − Calciumascorbat; E 304a − Ascorbylpalmitat; E 304b − Ascorbylstearat;. Der Ascorbinsäurezusatz zu Mehlen soll das Gashaltevermögen und das Volumen der Teige vergrößern. Dies lässt sich durch die Ausbildung zusätzlicher Disulfidbrücken zwischen den Kleber-Strängen des Teiges erklären. Auch im Pharma-Bereich dient Ascorbinsäure als Antioxidans zur Stabilisierung von Pharmaprodukten.
Wegen der ihr zugeschriebenen allgemein gesundheitsfördernden Eigenschaften wird Ascorbinsäure auch in der Tierzucht verfüttert.
Wegen seiner reduzierenden Eigenschaft wird Ascorbinsäure auch vereinzelt als Entwicklungssubstanz in photographischen Entwicklern eingesetzt.
Zum Auflösen von Heroinbase vor der Injektion wird oft Ascorbinsäure mit dem Heroin aufgekocht.
Physiologische Bedeutung
Vitamin C ist ein Radikalfänger und hat eine antioxidative Wirkung (Reduktionsmittel). Es ist ein wichtiger Cofaktor bei der Hydroxylierungsreaktion und steuert damit unter anderem die körpereigene Herstellung von Collagen. Darüber hinaus spielt es eine wichtige Rolle beim Aufbau von Aminosäuren. Durch seine antioxidative Wirkung schützt es andere wichtige Metaboliten und das Erbgut vor der Oxidation bzw. dem Angriff durch freie Radikale, was im Endeffekt einen Schutz der Zelle vor Schäden und somit auch vor Krebs bedeutet.

Der Name Ascorbinsäure leitet sich von der Krankheit Skorbut ab, die durch Ascorbinsäure verhindert und geheilt werden kann. Mit Niacin und Vitamin B6 steuert Vitamin C die Produktion von L-Carnitin, das für die Fettverbrennung in der Muskulatur benötigt wird. Weiterhin begünstigt es die Eisenresorption im Dünndarm.
Vitamin C wird auch bei und zur Prophylaxe von Erkältungen eingesetzt. Diese Anwendung wurde insbesondere in den 1970er Jahren durch den Nobelpreisträger Linus Pauling populär. Eine Metaanalyse von 55 Studien zeigt jedoch, dass, entgegen dem weit verbreiteten Glauben, Vitamin C Erkältungskrankheiten nicht verhindern kann. Allenfalls bei Menschen, die – wie manche Extremsportler – starken körperlichen Anstrengungen oder extremer Kälte ausgesetzt sind, scheint Vitamin C eine leicht vorbeugende Wirkung zu haben. Es gibt Hinweise darauf, dass sich die Dauer einer Erkältung durch das Vitamin geringfügig verringern lässt.[4]
Neuerdings wird Vitamin C auch zur Vorbeugung und Behandlung der Reisekrankheit (Kinetosen) eingesetzt. Vitamin C, in Dosierungen zwischen 1 und 3 Gramm täglich, ist in der Lage, die Histaminspiegel bei Patienten mit Seekrankheit oder Mastozytose deutlich zu senken.[5].
Bedarf

In weiten Teilen der Welt ist die Versorgung mit Vitamin C relativ gut, der Tagesbedarf eines Erwachsenen beträgt laut Empfehlung der Deutschen Gesellschaft für Ernährung 100 mg. Die Meinungen hierüber gehen jedoch weit auseinander; die Empfehlungen anderer Gruppierungen liegen zwischen einem Bruchteil (z. B. der Hälfte) und einem Vielfachen (z. B. „so viel wie möglich“) dieses Wertes. Fest steht, dass Mengen bis zu 5000 mg kurzzeitig als unbedenklich gelten. Überschüssige Mengen werden vom Körper über den Urin ausgeschieden, da Vitamin C gut wasserlöslich ist (siehe auch Hypervitaminosen).
Bei einer ausgewogenen Mischkost kann in Deutschland davon ausgegangen werden, dass dem Körper alle lebensnotwendigen Vitamine, und daher auch Vitamin C, in ausreichendem Maße zugeführt werden. Die Versorgung mit Vitamin C ist in Deutschland knapp über der DGE-Empfehlung von 100 mg pro Tag. Daher sind Vitaminpräparate für einen gesunden Menschen, der sich abwechslungsreich und vollwertig ernährt, überflüssig.
Untersuchungen mit 14C-markiertem Vitamin C zeigen, dass der tägliche Ascorbatumsatz unabhängig von der Vitamin-C-Zufuhr nur etwa 20 mg beträgt. Somit genügen bereits knapp 20 mg täglich, um Skorbut zu vermeiden.
Für Vergleichszwecke interessant ist, dass für Meerschweinchen eine Tagesdosis von 10 – 30 mg empfohlen wird (bei einem Gewicht von ca. 0,8−1,5 kg).
Mangelerscheinungen (Hypovitaminose)
Albert von Szent-Györgyi Nagyrapolt, ein ungarischer Wissenschaftler, identifizierte 1933 das Vitamin C als wirksame Substanz gegen Skorbut. Volle Wirksamkeit entfaltet das Vitamin C aber nur in Gegenwart eines Flavanols, das als Vitamin C2 bezeichnet wird. Keiner der beiden Stoffe kann allein Skorbut heilen, in Kombination sind sie aber schon in geringen Mengen wirksam.
Nur wenige Wirbeltiere, darunter Primaten (wie der Mensch), einige Vögel und Meerschweinchen, sind nicht zur Biosynthese von Ascorbinsäure aus Glucuronsäure befähigt, da ihnen die L-Gluconolacton-Oxidase fehlt. Für diese Lebewesen ist Ascorbinsäure somit essentiell. Darum muss der Bedarf über die Nahrung (bzw. mit Nahrungsmitteln) gedeckt werden. Mangelerscheinungen führen langfristig zu Skorbut. Sie können bei Fehl- und Mangelernährung wie falschen Diäten und Alkoholismus beziehungsweise bei erhöhtem Bedarf (Schwangerschaft, Rauchen) auftreten.
Mangelerscheinungen führen außerdem zur Schwächung des Bindegewebes, da Ascorbinsäure zur Collagen-Synthese benötigt wird (siehe oben).
Überdosierung (Hypervitaminose)
Für Vitamin C ist die Hypervitaminose, wie sie beispielsweise bei Vitamin A vorkommen kann, sehr selten, da der Körper einen Überschuss an Ascorbinsäure wieder über die Nieren ausscheidet.
In einer Studie am NIH wurden sieben Freiwillige zunächst mit einer Vitamin C-armen Diät Vitamin C-depletiert und dann wieder mit Vitamin C versorgt. Die renale (über die Niere) Ausscheidung an unverändertem Vitamin C begann ab etwa 100 mg/Tag. Die Zufuhr über 400 mg/Tag wurde – soweit überhaupt im Darm aufgenommen (die Resorption von Megadosen senkt die Resorptionsquote deutlich) – praktisch vollständig renal ausgeschieden. Ab etwa 1 g pro Tag steigen die Oxalat- und sekundär auch die Harnsäure-Konzentrationen im Blutplasma.[6] Da ein Teil der Ascorbinsäure im Stoffwechsel zu Oxalsäure umgesetzt wird, besteht bei entsprechend disponierten Menschen ein erhöhtes Risiko für Calciumoxalat-Nierensteine (CaC2O4). Schon bei normaler Zufuhr stammen etwa 30−50 % des Plasmaoxalats aus dem Vitamin-C-Abbau.
Es wurde festgestellt, dass Vitamin C in sehr hohen Dosen Vitamin B12 zerstören kann.
Hohe (orale) Einzeldosen (5−10 g) können einen vorwiegend osmotisch bedingten Durchfall sowie evtl. vorübergehende Schlaflosigkeit (ähnlich Koffein) auslösen. Auch findet sich ein Bericht, bei dem ein älterer Patient nach intravenöser Gabe von 80 g L-Ascorbinsäure nach zwei Tagen an einer akuten Niereninsuffizienz verstarb.
Bei Menschen mit Glucose-6-Phosphatdehydrogenase-Mangel (G6PDH-Mangel, Favismus), einer insbesondere in Afrika sehr weit verbreiteten, erblichen Krankheit, können hohe Vitamin-C-Dosen zur Hämolyse führen.
Bei Langzeitgabe mit hohen Dosen (etwa 2−3 g/Tag) können Übelkeit, osmotischer Durchfall, Blähungen, Magenkrämpfe und Flush-Symptome auftreten. Auch eine osmotische Diurese ist möglich.
Es wird von Einzelfällen mit längerfristiger Einnahme sehr hohe Dosen (über 20 g pro Tag) berichtet, die sogar durch Calcifizierung des Herzens tödlich geendet haben sollen.
Säuglingsskorbut tritt dann auf, wenn während der Schwangerschaft sehr große Mengen an Vitamin C aufgenommen werden. Die Ausscheidung überschüssiger Ascorbinsäure erfolgt über eigene Kanal-Proteine in der Niere. Bei hoher Konzentration werden diese vermehrt, was auch beim Embryo erfolgt. Nach der Geburt scheidet der Säugling deshalb zu viel Vitamin C aus, das durch die normale Menge in der Babynahrung nicht mehr ersetzt wird, so dass der Säugling an einem Vitamin C-Mangel leidet.
Der LD50-Wert für oral aufgenommenes Vitamin C liegt bei der Maus bei 3,3 g je Kilogramm Körpergewicht, bei infundiertem Vitamin C liegt der LD50-Wert bei der Maus bei 518 mg/kg Körpergewicht.
Vitamin C und Krebs
Vitamin C stärkt sowohl die zelluläre Immunabwehr, indem es die Lymphozyten und die Makrophagen aktiviert als auch die hormonelle Abwehr, weil es die Serumkonzentrationen der Immunglobuline erhöht. Einige Studien zeigen einen durchgängigen Zusammenhang zwischen niedrigen Plasmaspiegeln von Vitamin C und erhöhtem Vorkommen bestimmter Krebsarten.
Die Schutzwirkung des Vitamin C vor unerwünschten Oxidationen ist an die eigene Oxidation gekoppelt, damit wird das Molekül aber selbst unwirksam, kann aber von anderen Reduktionsmitteln oder durch entsprechende Enzyme regeneriert werden. Daher müssen für eine ausreichende Schutzwirkung auch diese reduzierenden Substanzen in ausreichender Konzentration vorhanden sein. Außerdem muss das Antioxidans Vitamin C in adäquater Dosierung zugeführt werden. In hohen (Mega-) Dosen wirken Antioxidantien meist prooxidativ: sie beschleunigen radikalische Reaktionen. Zu hohe Dosen führen zu einem Ansteigen der Konzentrationen an Radikalen insbesondere in Anwesenheit von freiem Eisen (typisch für Raucher).
Forschung in den USA zeigt dass Vitamin C nicht nur als Radikalfänger zellschützend wirken kann, sondern auch die DNA (Erbgut) schädigen kann. Dies ist allerdings umstritten, da nicht benötigte Mengen ausgeschieden werden.[7] Die Forscher verwendeten in ihren Versuchen Vitamindosen von 500 mg täglich. Wissenschaftler der University of Leicester fanden Hinweise auf eine erbgutschädigende Wirkung von hohen Vitamin-C-Dosen.[8]
siehe dazu auch: Vitamin-C-Infusion
Biosynthese
Die Bildung der Ascorbinsäure im Organismus beginnt mit der Oxidation von UDP-D-Glucose zu UDP-D-Glucuronsäure durch das Enzym UDP-Glucose-Dehydrogenase. Oxidationsmittel ist dabei das NAD+.
Nach hydrolytischer Abspaltung des UDP bildet sich die D-Glucuronsäure, die durch selektive Reduktion durch die Glucuronsäure-Reduktase und NADPH+H+ in L-Gulonsäure überführt wird. Der Lactonisierung (Ringbildung) mittels Gulonsäure-Lactonase zum L-Gulofuranolacton folgt die selektive Oxidation mit Sauerstoff und Gulofuranolacton-Oxidase zur Ascorbinsäure.
Physikalische Eigenschaften
Die chemische Summenformel lautet C6H8O6, die molare Masse von Ascorbinsäure beträgt 176,13 g/mol.
Der Schmelzpunkt liegt bei 190 °C. Ein Siedepunkt kann nicht angegeben werden, da sich Ascorbinsäure bereits ab dem Schmelzpunkt zersetzt.
Ascorbinsäure ist gut in Wasser löslich (333 g/l bei 20 °C).
Chemische Eigenschaften
Struktur
Ascorbinsäure enthält mehrere Strukturelemente, die zu ihrem chemischen Verhalten beitragen: eine Lactonstruktur, zwei enolische Hydroxylgruppen sowie eine sekundäre und eine primäre Alkoholgruppe. Die Endiol-Struktur bedingt die reduzierenden (antioxidativen) Eigenschaften der Ascorbinsäure, da Endiole leicht zu Diketonen oxidiert werden können:
Endiole mit benachbarter Carbonylgruppe nennt man daher auch Reduktone.
Ascorbinsäure bildet zwei intramolekulare Wasserstoffbrückenbindungen (in untenstehender Abbildung rot eingezeichnet), die maßgeblich zur Stabilität und damit zu den chemischen Eigenschaften der Endiol-Struktur beitragen.
Acidität
Obwohl Ascorbinsäure keine der „klassischen“, sauren funktionellen Gruppen (Carbonsäure, Sulfonsäure, Phosphonsäure, etc.) aufweist, ist sie beträchtlich sauer. Mit einem pKs-Wert von 4,2 ist sie sogar saurer als Essigsäure (pKs = 4,8).
Dies ist zum Einen auf die Endiol-Struktur zurückzuführen. Enole sind bereits deutlich saurer als Alkohole. Zusätzlich wird die Azidität bei Ascorbinsäure durch die zweite enolische OH-Gruppe und durch die benachbarte Carbonylgruppe noch verstärkt. Zum Anderen wird das nach Abspaltung des Protons entstehende Enolat-Anion mittels Keto-Enol-Tautomerie stabilisiert. Die dann bestehende negative Ladung am Sauerstoff wird dabei sowohl über die Doppelbindung zwischen den beiden Kohlenstoffatomen, als auch über die Carbonylfunktion delokalisiert, also verteilt, und somit stabilisiert.
Strukturell könnte man diese Gruppierung auch als vinyloge Carbonsäure auffassen, d. h. als eine Carbonsäure-Funktion mit „eingeschobener“ C-C-Doppelbindung zwischen Carbonylgruppe und OH−Gruppe.
Die andere enolische OH-Gruppe (in den Strukturformeln rechts unten) hat nur schwach saure Eigenschaften (pKs = 11,8), da hier das Anion weniger mesomere Grenzstrukturen zur Stabilisierung ausbilden kann.
Antioxidative Wirkung
Die wichtigste Funktion der Ascorbinsäure im menschlichen Organismus beruht auf ihrer Eigenschaft als Reduktionsmittel. Sie ist also in der Lage Elektronen auf andere Moleküle zu übertragen.
Man kann zwei grundsätzliche Aufgaben unterscheiden:
Ascorbinsäure als Radikalfänger (Scavenger)
Ascorbinsäure dient im tierischen Organismus als Radikalfänger, da es in der Lage ist eben solche auf andere Moleküle zu übertragen. Die Grafik zeigt nicht den tatsächlichen Reaktionsmechanismus, sondern schematisch die Fähigkeit der Ascorbinsäure, unter Reaktion zur Dehydroascorbinsäure zwei Radikale freisetzen zu können:
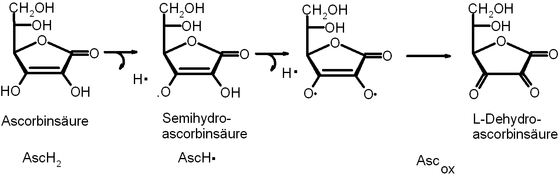
Bei der Verstoffwechslung des Sauerstoffs in der Zelle kann es zur Bildung des Superoxidradikals O2-. kommen, wenn der molekulare Sauerstoff O2 bei der Endreaktion der Atmungskette statt vier nur ein Elektron erhalten hat. Das Superoxidradikal ist aufgrund dieses Elektronenmangels extrem reaktiv und in der Lage molekulare Zellstrukuren zu schädigen. Die Reaktion mit Ascorbinsäure überführt dieses in Wasserstoffperoxid[9]:
Das Wasserstoffperoxid wird von dem Enzym Katalase abgebaut[9].
Ascorbinsäure als Cofaktor in Redoxreaktionen
Wie bereits erwähnt, ist die Ascorbinsäure in der Lage ein stabiles Enolatanion zu bilden. Dieses ist in der Lage formal ein Hydridanion auf eine andere Spezies zu übertragen[10][11].
Schematische Darstellung der Reaktion der Ascorbinsäure zur Dehydroascorbinsäure unter formaler Freisetzung eines Hydridanions:
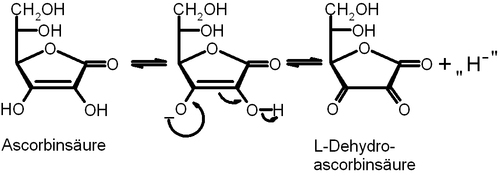
Von Bedeutung ist diese Eigenschaft beispielsweise bei der Synthese von Collagen im menschlichen Stoffwechsel. Zur Darstellung dieses Strukturproteins muss die Aminosäure Prolin zu ihrer oxidierten Form, Hydroxyprolin, umgewandelt werden. Ascorbinsäure dient dazu, das in dieser Reaktion genutzte Oxidationsmittel Fe(II), zu regenerieren. Besteht ein Mangel an Vitamin C, kann die Bildung des Hydroxyprolins bei der Collagensynthese nur begrenzt erfolgen, so dass die typischen Symptome der Skorbut wie Zahnfleischbluten, Zahnausfall und Hautschäden auftreten.
Stereochemie
Ascorbinsäure existiert in vier verschiedenen stereoisomeren Formen, die optische Aktivität aufweisen, da das 4. und 5. C-Atom jeweils Asymmetriezentren sind:
- L-Ascorbinsäure
- D-Ascorbinsäure
- L-Isoascorbinsäure
- D-Isoascorbinsäure
Die Moleküle L- und D−Ascorbinsäure verhalten sich wie Bild und Spiegelbild zueinander, sie sind Enantiomere, ebenso die L− und die D−Isoascorbinsäure.
L-Ascorbinsäure und D-Isoascorbinsäure sowie D-Ascorbinsäure und L-Isoascorbinsäure sind Epimere, sie unterscheiden sich jeweils in der Konfiguration nur eines C-Atoms. Trotz dieser geringen Unterschiede sind die Stereoisomere der L-Ascorbinsäure im Körper fast alle inaktiv, da die am Stoffwechsel beteiligten Enzyme spezifisch L-Ascorbinsäure erkennen. Lediglich die D-Isoascorbinsäure weist eine geringe Wirkung auf.
Nachweis
Der quantitative Nachweis von Ascorbinsäure lässt sich unter anderem durch Titration mit Tillmans' Reagenz (2,6-Dichlorphenolindophenol, abgekürzt DCPIP) durchführen, bei der das Reagenz durch die Ascorbinsäure zu einer Leukoverbindung reduziert wird. Dabei ist ein Farbumschlag von tiefblau zu farblos zu sehen.
Quellen
- ↑ Weber, P.: Vitamin C. ; Vitamine, Spurenelemente und Mineralstoffe, 2002, 57-69.
- ↑ Harden A; Zilva S S: The Antiscorbutic Factor in Lemon Juice; The Biochemical journal, 1918, 12, 259-69.
- ↑ GB-Patent Nr.443901 Improvements in or relating to the manufacture of ascorbic acid and its analogues
- ↑ R. Douglas, H. Hemilä (2005): PLoS Medicine, Bd. 2, Nr. 6, S. e168
- ↑ Reinhart Jarisch (2004): „Histamin-Intoleranz, Histamin und Seekrankheit“, Kapitel 11, S.168/169; Thieme, ISBN 3-13-105382-8
- ↑ M. Levine et al. (1996): „Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance“, Proc. Nat. Acad. Sci., Vol. 93, S. 3704-9. Volltext
- ↑ S.H. Lee et al (2001): „Vitamin C-induced decomposition of lipid hydroperoxides to endogenous genotoxins“, Science, 292(5524), S. 2083-6. PMID 11408659
- ↑ Podmore I D; Griffiths H R; Herbert K E; Mistry N; Mistry P; Lunec J: Vitamin C exhibits pro-oxidant properties.; Nature, 1998, 392, 559. [1]
- ↑ a b Becher G; Winsel K: Short scientific report. Vitamin C lessens superoxide anion(O2)-induced bronchial constriction; Zeitschrift fur Erkrankungen der Atmungsorgane; 1989, 173, 100-4. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Becher1989“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Calyden, Greeves, Warren and Wothers: Organic Chemistry, Oxford Press, New York 2004, ISBN 0198503466.
- ↑ Ioannou, Panayiotis V.; Siskos, Michael G.: Ascorbic acid acts as a hydride donor towards 2-arsonocarboxylic acids. Applied Organometallic Chemistry, 2001, 15, 511-514.
Literatur
- Hans K. Biesalski, Josef Köhrle, Klaus Schümann: Vitamine, Spurenelemente und Mineralstoffe. Prävention und Therapie mit Mikronährstoffen., Thieme, Stuttgart 2002, ISBN 3131293713.
- Linus Pauling: Linus Paulings Vitamin- Programm. Plädoyer für ein gesundes Leben. Bertelsmann, 1990, ISBN 357002671X
- Herwig Lange: Mit Linus Paulings Forschungsergebnissen gesund werden - gesund bleiben. Vitamin C. poli-c-books, 2006, ISBN 3938456140
Weblinks
- Vitamin C gegen Krebszellen
- Das Ende der Vitamin C-Legende − Analyse von mehr als 50 Studien zeigt: Vitamin C schützt nicht vor Erkältungen
- Vitaminversorgung in Deutschland (DGE Angaben)
- Untersuchungen zur Oxidation und Reduktion des Ascorbinsäure / Dehydroascorbinsäure-Redoxsystems sowie zur hydrolytischen Verseifung von der Dehydroascorbinsäure zur Diketogulonsäure Dissertation Universität Gießen 1992
- WDR-Sendung Quarks & Co.: Vitamin C auf der Spur
Sicherheitsdatenblätter
Sicherheitsdatenblätter für L-(+)-Ascorbinsäure verschiedener Hersteller in alphabetischer Reihenfolge:





