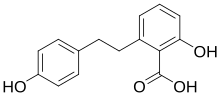
Lunularsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lunularsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C15H14O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 258,27 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
201–202 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Die Lunularsäure ist eine organische Säure aus der Gruppe der Phenolcarbonsäuren und weist eine 2,6-Kresotinsäure-Untereinheit auf.
Geschichte
Untersuchungen zum Vorkommen phenolischer Verbindungen bei niederen Pflanzen wurden am Beispiel der Lebermoose erstmals im Jahr 1966 durchgeführt und in den Folgejahren fortgeführt.[3][4][5] 1996 wurde erstmalig die Lunularsäure aus dem Mondbechermoos isoliert.[6] Bei Untersuchungen der Chemie der Moose wurde die Verbindung 1971 auch im Lebermoos gefunden.[7][8]
Vorkommen

Die organische Verbindung kommt in Lebermoosen, wie zum Beispiel im Alpen-Brunnenlebermoos (Marchantia alpestris Nees) und im Mondbechermoos (Lunularia cruciata (L.) DUM) vor.[8] Vereinzelt ist sie auch in Laubmoosen und häufig in Algen zu finden.[1]
Synthese
Frühe Synthesen der Lunularsäure waren sehr aufwändig bei einer geringen Gesamtausbeute.[9][10]
1988 wurde eine Synthese im Labormaßstab unter Verwendung gut zugänglicher Ausgangsstoffe mit einer Gesamtausbeute von 50 % über 3 bis 6 Stufen publiziert.[11] Diese geht von 6-Methylsalicylsäureethyester – zugänglich in einer zweistufigen Sequenz aus Acetessigester und Crotonaldehyd – aus, der bereits das vicinale 1,2,3-Substitutionsmuster der Lunularsäure aufweist.
Zunächst wird die Hydroxygruppe als Methylether oder Acetat geschützt. Im Anschluss wird die 6-Methylgruppe mit verschiedenen Methoden funktionalisiert und in das Diphenylethan-System überführt.
Dies kann beispielsweise über eine Metallierung des 6-Methylethers und die anschließende Alkylierung durch p-Methoxybenzylchlorid passieren. Das Zwischenprodukt ist der OH-geschützte Lunularsäureethylester, der nach der Esterverseifung und einer Demethylierung mittels Bortribromid in die Lunularsäure überführt wird.
Weitere Synthesen
- 1997: Synthese über eine modifizierte Suzuki-Reaktion[12]
- 1998: Totalsynthese der Naturstoffe beziehungsweise. Naturstoffderivate Lunularsäure, Lunularin und weiterer verwandter Verbindungen als potentielle Inhibitoren der Arachidonsäurekaskade[13]
Chemische Eigenschaften
Während die Lunularsäure unter normalen Bedingungen chemisch stabil ist, sollten direkte Sonneneinstrahlung, sowie extreme Temperaturen vermieden werden. Hierbei kann es zur Freisetzung von reizenden Gasen und Dämpfen kommen. Außerdem besteht eine Unverträglichkeit gegenüber Wasser und starken Oxidationsmitteln.[2]
Biologische Bedeutung
In niederen Pflanzen fungiert sie als Wachstumsregulator.[8] Einige ihrer Derivate haben außerdem eine stark molluskizide Wirkung.[1] Die Lunularsäure selbst und prenylierte Diphenylethan-Derivate, die sich von ihrem Strukturtyp ableiten, weisen im Allgemeinen eine hohe antibakterielle Aktivität auf.[11]
Sicherheitshinweise
Im Brandfall sind alkoholbeständiger Schaum, Kohlenstoffdioxid (CO2),Trockenlöschmittel oder Wassernebel als Löschmittel zu verwenden. Es kann unter Hitzeeinwirkung zur thermischen Zersetzung kommen, wobei reizende Dämpfe und Gase freigesetzt werden können. Feuerwehrleute sollten daher neben vollständiger Schutzkleidung ein umgebungsluftunabhängiges Atemschutzgerät verwenden (Druckanforderungsmodus gemäß MSHA/NIOSH).[2]
Nachweis
Die Phenolcarbonsäure kann mittels Dünnschichtchromatografie auf Kieselgel oder Gaschromatografie auf XE-60 sowie OV-17-Säulen identifiziert werden.[8]
Einzelnachweise
- ↑ a b c d Eintrag zu Lunularsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2024.
- ↑ a b c d Sicherheitsdatenblatt. 2-Hydroxy-6-(4-hydroxyphenethyl)benzoic acid. BLD Pharmatech, 15. November 2023, abgerufen am 14. Juni 2024.
- ↑ "Beitrag zur Phytochemie der Hepaticae" R. Mues and H. D. Zinsmeister: Österreichische Botanische Zeitschrift (1973), S. 151–154.
- ↑ R. Mues, H. D. Zinsmeister: Beitrag zur Phytochemie der Hepaticae. In: Österreichische botanische Zeitschrift. Band 121, Nr. 1, 1973, S. 151–154, doi:10.1007/BF01373374.
- ↑ H. Reznik, R. Wiermann: Quercetin und Kämpferol im Thallusgewebe vonCorsinia coriandrina. In: Naturwissenschaften. Band 53, Nr. 9, 1966, S. 230–231, doi:10.1007/BF00633905.
- ↑ I. F. M. Valio, R. S. Burdon, W. W. Schwabe: New Natural Growth Inhibitor in the Liverwort Lunularia cruciata (L) Dum. In: Nature. Band 223, Nr. 5211, 1969, S. 1176–1178, doi:10.1038/2231176a0.
- ↑ R. J. Pryce: Lunularic acid, a common endogenous growth inhibitor of liverworts. In: Planta. Band 97, Nr. 4, 1971, S. 354–357, doi:10.1007/BF00390214.
- ↑ a b c d Siegfried Huneck, R. J. Pryce: Inhaltsstoffe der Moose, IX. Lunularsäure aus Marchantia alpestris / Constituents of Liverworts and Mosses, IX. Lunularic Acid from Marchantia alpestris. In: Zeitschrift für Naturforschung B. Band 26, Nr. 7, 1971, S. 738–738, doi:10.1515/znb-1971-0726.
- ↑ Siegfried Huneck, Klaus Schreiber: Synthese der lunularsäure. In: Phytochemistry. Band 16, Nr. 7, 1977, S. 1013–1016, doi:10.1016/s0031-9422(00)86712-6.
- ↑ Yoshitsugu Arai, Tadao Kamikawa, Takashi Kubota, Yoshio Masuda, Ryoichi Yamamoto: Synthesis and properties of lunularic acid. In: Phytochemistry. Band 12, Nr. 9, 1973, S. 2279–2282, doi:10.1016/0031-9422(73)85134-9.
- ↑ a b Theophil Eicher, Kristin Tiefensee, Rigobert Pick: Synthese von Bryophyten-Inhaltstoffen 1. Neue Synthesen der Lunularsäure und einiger ihrer Derivate. In: Synthesis. Band 1988, Nr. 07, 1988, S. 525–529, doi:10.1055/s-1988-27624.
- ↑ Ekaterini Nikolakis: Modifizierte SUZUKI-Reaktion: Anwendung auf die Synthese von Combretastatin A-4, A-5 und Lunularsäure; zur Synthese des Brefeldin C-Gerüsts via RCM. Dissertation. Dortmund 1997.
- ↑ Jürgen Krauss: Totalsynthese der Naturstoffe bzw. Naturstoffderivate Secocurvularin, Curvulin, Lunularsäure, Lunularin, (R)-Zearalan, (S)-Zearalan, Zeranol und (R)-Zearalanon und verwandter Verbindungen als potentielle Inhibitoren der Arachidonsäurekaskade. Dissertation. Braunschweig 1998.





