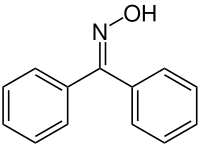
Benzophenonoxim
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzophenonoxim | ||||||||||||||||||
| Andere Namen |
N-Hydroxy-1,1-diphenylmethanimin | ||||||||||||||||||
| Summenformel | C13H11NO | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
146 °C[2] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Benzophenonoxim ist eine organische Verbindung aus der Gruppe der Oxime. Es leitet sich von Benzophenon ab.
Herstellung
Benzophenonoxim kann aus Benzophenon und Hydroxylaminhydrochlorid in Gegenwart von Natriumhydroxid hergestellt werden.[3] Die Reaktion unterliegt einem Gleichgewicht, nur bei höherem pH-Wert entsteht bevorzugt das Oxim. Im Sauren wird die Verbindung dagegen leicht wieder hydrolysiert.[4]
Eigenschaften
Benzophenonoxim kristallisiert im monoklinen Kristallsystem mit den Gitterparametern a = 9,459 Å; b = 8,383 Å, c = 26,690 Å und β = 92,807 °.[2]
Reaktionen
Benzophenonoxim eignet sich als Reagenz zur Herstellung von Alkylchloriden aus Carbonsäuren. Die Carbonsäuren werden zunächst zum Oxim-Ester umgesetzt und dann bestrahlt. In einer radikalischen Reaktion wird die N-O-Bindung homolytisch gespalten und dann Kohlenstoffdioxid freigesetzt. Das Chloratom stammt aus dem Lösungsmittel Tetrachlormethan.[5] Durch Reaktion mit Carbonsäurechloriden (beispielsweise Benzoylchlorid) in Gegenwart von Pyridin können aus Benzophenonoxim Oxim-Ester hergestellt werden. Durch Deprotonierung mit Natriumhydrid und Umsetzung mit Alkylchloriden können Oxim-Ether hergestellt werden.[6] Durch Reaktion mit Singulett-Sauerstoff führt zur Oxidation, die Benzophenon und salpetrige Säure als Produkte ergibt.[7]
Einzelnachweise
- ↑ a b c d e f Datenblatt Benzophenone oxime, 98% bei Fisher Scientific, abgerufen am 11. Juni 2024 (PDF).
- ↑ a b M. Rajasekar, K. Muthu, V. Meenatchi, G. Bhagavannarayana, C.K. Mahadevan, Sp. Meenakshisundaram: Growth, crystalline perfection and characterization of benzophenone oxime crystal. In: Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. Band 92, Juni 2012, S. 207–211, doi:10.1016/j.saa.2012.02.070.
- ↑ Arthur Israel Vogel: A text-book of practical organic chemistry: incl. qualitative organic analysis. 3. ed. ; new impr. Longmans, London 1977, ISBN 978-0-582-44245-0, S. 741.
- ↑ Arthur Lachman: THE BECKMANN REARRANGEMENT. II. In: Journal of the American Chemical Society. Band 47, Nr. 1, Januar 1925, S. 260–265, doi:10.1021/ja01678a038.
- ↑ Masato Hasebe, Takashi Tsuchiya: Photodecarboxylative chlorination of carboxylic acids via their benzophenone oxime esters. In: Tetrahedron Letters. Band 29, Nr. 48, Januar 1988, S. 6287–6290, doi:10.1016/S0040-4039(00)82327-8.
- ↑ Billy B. Wylie, Eugene I. Isaacson, Jaime N. Delgado: Synthesis of Oxime Esters and Ethers as Potential Psychotropic Agents. In: Journal of Pharmaceutical Sciences. Band 54, Nr. 9, September 1965, S. 1373–1376, doi:10.1002/jps.2600540932.
- ↑ Carl C. Wamser, John W. Herring: Photooxidation of benzophenone oxime and derivatives. In: The Journal of Organic Chemistry. Band 41, Nr. 8, April 1976, S. 1476–1477, doi:10.1021/jo00870a045.






