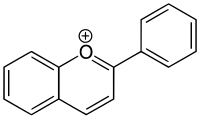
Flavylium
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Flavylium | |||||||||
| Summenformel | C15H10O+ | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 306,70 g·mol−1 (Perchlorat) | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Das Flavylium-Kation ist die für viele Anthocyane bzw. Anthocyanidine charakteristische Grundstruktur, welche auch als in 2-Stellung durch einen Phenylrest substituiertes Benzopyrylium-Kation betrachtet werden kann. Der Name kann von dem Heterocyclus Flavan (2-Phenylchroman) abgeleitet werden, besser von dem dehydrierten Heterocyclus 2-Phenylchromen (Flaven). Formal kann es durch Abstraktion eines Hydrid-Ions aus Flaven entstehen. Weniger systematisch, aber näher an der Realität ist die Ableitung des Namens von dem heterocyclischen Keton Flavon, dessen Derivate oft eine gelbliche Farbe besitzen (Lateinisch: flavus, gelb, blond). Im Prinzip könnte durch Reduktion des Flavons das Flavylium-Kation erzeugt werden. Das unsubstituierte Flavylium-Kation kommt in der Natur nicht vor, jedoch zahlreiche Derivate mit Hydroxy-Gruppen (Pelargonidin, Cyanidin, Delphinidin). Salze des Flavylium-Kations mit komplexen Anionen, z. B. das Perchlorat, wurden durch Chemische Synthese gewonnen.
Geschichte
Auf einer Sitzung der Gesellschaft Deutscher Chemiker in Berlin im Jahr 1907 berichtete Hermann Decker über Untersuchungen zur Synthese sogenannter Phenopyryliumsalze, die er an der Technischen Hochschule Hannover mit Theodor von Fellenberg durchgeführt hatte.[2] Nachdem die Konstitution (Struktur) der Verbindungen erkannt worden war, wurde der Name Flavyliumsalze (s. o.) bevorzugt.
Zwei Verfahren wurden beschrieben:
- Die gleichzeitig von Josef Houben untersuchte Umsetzung von Cumarin mit dem Grignard-Reagens Phenylmagnesiumbromid.
- Die Reaktion von Salicylaldehyd mit Acetophenon und Chlorwasserstoff.
Die Ergebnisse wurden im selben Jahr in Justus Liebigs Annalen der Chemie publiziert.[3]
Gewinnung
Zur Synthese aus Cumarin wurde das mit Phenylmagnesiumbromid entstehende Reaktionsgemisch mit Mineralsäure hydrolysiert. Durch Zusatz von Perchlorsäure konnte ein Salz isoliert werden, welches als „Phenopyryliumperchlorat“ bezeichnet wurde.[4] Die Ausbeute war jedoch gering.
Höhere Ausbeuten wurden nach der zweiten Methode erzielt: Eine Mischung äquimolarer Mengen Salicylaldehyd und Acetophenon wurde – mit oder ohne Lösungsmittel – mit Chlorwasserstoffgas behandelt. Die Reaktionsmasse wurde mit Salzsäure extrahiert. Der Extrakt wurde mit Eisen(III)-chlorid versetzt, wodurch das gelbe Tetrachloroferrat (FeCl4−) ausfiel. Ein besseres Ergebnis wurde durch Erhitzen der Edukte in einem Gemisch von Essigsäure und konzentrierter Salzsäure erzielt. Das gebildete Flavyliumchlorid konnte wiederum durch Zusatz von Eisen(III)chlorid als Tetrachloroferrat isoliert werden.[5]
Diese Kondensationsreaktion beruht auf dem Prinzip der Aldolreaktion. Wie bei allen Aldolreaktionen mit verschiedenen Komponenten (Edukten) tritt das Problem der Selektivität auf, was Schwierigkeiten bei der Reinigung und den erzielten Ausbeuten zur Folge hat. Die Reaktion muss durch Zusatz von Basen (OH−) oder starken Säuren katalysiert werden. Im vorliegenden Fall handelt es sich um eine „saure Aldolkondensation“. Analog wurde Flavyliumperchlorat durch Reaktion von Salicylaldehyd mit Acetophenon in Gegenwart von konzentrierter Salzsäure und Perchlorsäure in unreiner Form erhalten. Lässt man Salicylaldehyd mit Acetophenon unter basischen Bedingungen (OH−) reagieren, erhält man o-Hydroxybenzylidenacetophenon. Es soll vorteilhaft sein, dieses Hydroxyketon mit Salzsäure zum Flavyliumchlorid zu cyclisieren (zweistufige Synthese).
Eigenschaften
Physikalische Eigenschaften
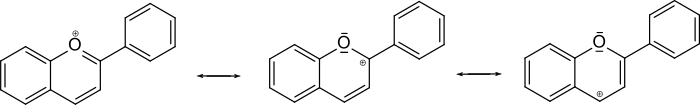
Wie in den Pyrylium-Kationen liegt ein konjugiertes System von π-Elektronen vor. Die positive Ladung des Kations ist delokalisiert, was im Rahmen der „valence bond“-(VB)-Theorie durch drei Grenzstrukturen symbolisiert werden kann.
Nach quantenchemischen Rechnungen zeigt das Kation (schwache) Resonanz (Mesomerie) im Pyrylium-Ring, jedoch keine Wechselwirkung mit dem π-Elektronensystem der Phenylgruppe.[6][7]
Chemische Eigenschaften
Das Flavylium-Kation bzw. die Verbindung Flavyliumperchlorat wurde mit zahlreichen Verbindungen umgesetzt. Da es eine positive Ladung trägt, sind Reaktionen mit nukleophilen Partnern charakteristisch. Diese (symbolisiert mit Nu) können sich mit den Kohlenstoffatomen in 2- oder 4-Position assoziieren, was zu Derivaten des 2H- bzw. 4H-Phenylchromens führt.
4-Ethoxyflav-2-en (4-Ethoxy-2-phenyl-4H-chromen) entsteht bei Raumtemperatur mit ethanolischer Natronlauge.[5] Dagegen reagiert Piperidin (Diethylether, Raumtemperatur) in 2-Stellung.[5] Die Reduktion mit Hydrid-Reagenzien führt zu Flavenen: Während Natriumborhydrid in Acetonitril Flav-2-en (2-Phenyl-4H-chromen) liefert, ergibt Lithiumaluminiumhydrid in Diethylether Flav-4-en (2-Phenyl-2H-chromen), letzteres allerdings in mäßiger Ausbeute.[5][8]
Verwendung
Das Perchlorat kann als Reagens zur papierchromatographischen Analyse von Pflanzenextrakten verwendet werden.[9]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Decker, Th. von Fellenberg: Synthese von Derivaten des Phenopyryliums. In: Berichte der deutschen chemischen Gesellschaft. Band 40, Nr. 3, 1907, S. 3815–3818, doi:10.1002/cber.190704003183.
- ↑ Herman Decker, Theodor von Fellenberg: Phenopyrylium und höhere homologe und isologe Pyryliumringe. In: Justus Liebigs Annalen der Chemie. Bd. 356, Heft 3, 1907, S. 281–342.
- ↑ Herman Decker, Paul Becker: Zur Synthese von Phenopyrylium-Salzen. In: Berichte der deutschen chemischen Gesellschaft. Band 47, Nr. 2, 1914, S. 2288–2292, doi:10.1002/cber.191404702146.
- ↑ a b c d John Arthur Joule, George Fouet Smith: Heterocyclic Chemistry. 2. Aufl., Van Nostrand Reinhold Company, London u. a. O. 1978.
- ↑ Grace K. Pereira, Paulo M. Donate, Sergio E. Galembeck: Electronic structure of hydroxylated derivatives of the flavylium cation. In: Journal of Molecular Structure: THEOCHEM. Band 363, Nr. 1, 29. März 1996, S. 87–96, doi:10.1016/0166-1280(95)04423-X.
- ↑ Laura Estévez, Ricardo A. Mosquera: Where is the positive charge of flavylium cations? In: Chemical Physics Letters. Band 451, Nr. 1, 17. Januar 2008, S. 121–126, doi:10.1016/j.cplett.2007.11.065.
- ↑ George Arthur Reynolds, James A. VanAllan: Reduction of some flavylium salts with sodium borohydride. In: Journal of Organic Chemistry. Bd. 32, Heft 11, 1967, S. 3616–3618, doi:10.1021/jo01286a070.
- ↑ K. Formanek, H. Höller: Flavyliumperchlorat als Reagens in der Papierchromatographie. In: Journal of Chromatography A. Bd. 2, 1959, S. 652–654, doi:10.1016/S0021-9673(01)86360-3.