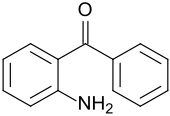
2-Aminobenzophenon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Aminobenzophenon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H11NO | |||||||||||||||
| Kurzbeschreibung | gelber[1] kristalliner Feststoff bzw. blass- bis dunkelgelbes Kristallpulver[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 197,24 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | praktisch unlöslich in Wasser, löslich in Methanol und Dimethylsulfoxid[4][5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
2-Aminobenzophenon weist neben einer aromatische Ketongruppe eine Aminogruppe auf und dient als Ausgangsstoff für viele benzoanellierte Heterocyclen, sowie für Pestizide, pharmazeutische Arzneistoffe und Pigmente.
Vorkommen und Darstellung
Im Jahr 1894 berichteten Carl Graebe und Fritz Ullmann die Synthese von o-Aminobenzophenon durch Hofmann-Umlagerung von o-Benzoylbenzoesäureamid mit aus Brom im Alkalischen gebildeten Natriumhypobromit.[6][7] Von Hans-Jürgen Quadbeck-Seeger und Mitarbeiter stammt eine Variante des Hofmann-Abbaus mit Natriumhypochlorit, wobei 2-Aminobenzophenon in 98%iger Ausbeute erhalten wird.[8]

Eine dreistufige Synthese von 2-Benzoylanilin, ausgehend von 2-Nitrobenzylchlorid, wurde kurz darauf von Siegmund Gabriel beschrieben.[9]

In einer Friedel-Crafts-Alkylierung wird dabei 2-Nitrobenzylchlorid mit Benzol umgesetzt, die Methylengruppe mit Chromtrioxid CrO3 zur Ketongruppe oxidiert und die aromatische Nitrogruppe mit Zinn(II)-chlorid SnCl2 zum Amin reduziert. Die Gesamtausbeute über alle Stufen betrug ca. 54 %.
Ein Standardverfahren geht aus von preisgünstiger Anthranilsäure, die nach Schutz der Aminogruppe mit Tosylchlorid mit Phosphorpentachlorid zum Säurechlorid umgesetzt wird, das mit Benzol in einer Friedel-Crafts-Acylierung zum geschützten Benzophenon reagiert.[10]
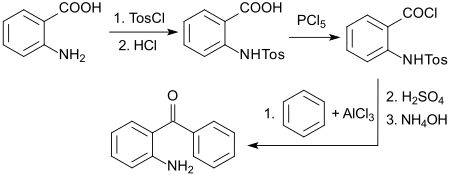
Die Tosylgruppe wird mit starken Säuren, wie z. B. konzentrierter Schwefelsäure oder Salzsäure[11] abgespalten und die Aminofunktion mit Ammoniumhydroxid freigesetzt. Die Gesamtausbeute beträgt 54 %.
Eine Reihe von Alternativrouten ist in der Literatur beschrieben,[12] die sich aber wegen teurer Reaktanden, mehrstufiger Reaktionsfolgen und geringer Ausbeuten nicht durchgesetzt haben.
Eigenschaften
2-Aminobenzophenon ist ein gelber kristalliner Feststoff, der in Wasser praktisch unlöslich ist und sich in Methanol, heißem Ethanol und DMSO löst.
Anwendungen
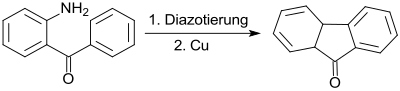
Das Diazoniumsalz von 2-Aminobenzophenon kann mit Kupfer in einer Pschorr-Cyclisierung zu Fluorenon cyclisiert werden.[6]
Benzoanellierte Heterocyclen aus 2-Aminobenzophenon
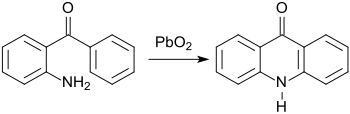
In frühen Arbeiten von C. Graebe und S. Gabriel wurde bereits die Darstellung benzoanellierter Stickstoff-Heterocyclen aus 2-Aminobenzophenon beschrieben, wie z. B. das Acridin-Derivat Acridon[6] durch Oxidation mit Blei(IV)-oxid PbO2
und das Chinazolin-Derivat 4-Phenylchinazolin-2-on[9] durch Reaktion mit Harnstoff.

Stellungsisomere Acridone werden bei der säurekatalysierten Umsetzung von 2-Aminobenzophenon mit 1,3-Diketonen, wie z. B. 1,3-Cyclohexandion erhalten.[13]

Sauerstofffreie Chinazoline sind in hohen Ausbeuten bis 95 % durch Reaktion von 2-Aminobenzophenon mit Benzylaminen und Oxidation mit Iod/tert-Butylhydroperoxid I2/TBHP[14]
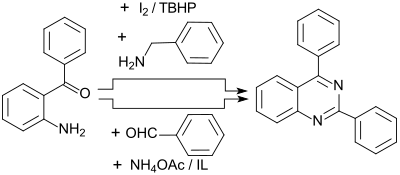
oder mit Benzaldehyden und Ammoniumacetat in Gegenwart ionischer Flüssigkeiten (engl. ionic liquids IL) zugänglich.[15] Die intermediär entstehenden 1,2-Dihydrochinazoline[16] werden auch durch Luftsauerstoff zu Chinazolinen oxidiert.
In neuerer Zeit wurden auch stickstoffhaltige benzoanellierte Heterocyclen mit drei Stickstoffatomen, wie 1,2,3-Benzotriazine, über das entsprechende Hydrozon und dessen Oxidation mit Blei(IV)-acetat synthetisiert.[17]

Pharmakologisch aktive Wirkstoffe aus 2-Aminobenzophenon
2-Benzoylanilin wird als Ausgangsstoff für Benzodiazepine, wie z. B. Nitrazepam MogadanR [18] eingesetzt.
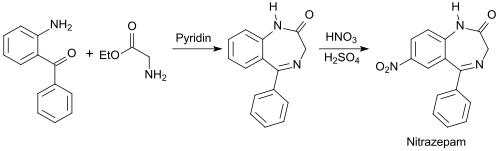
während die Herstellung von Chlordiazepoxid LibriumR [19] von 2-Amino-5-chlorbenzophenon ausgeht.
Das Antihistaminikum Epinastin kann in einer mehrstufigen Synthese aus 2-Aminobenzophenon erhalten werden.[20]
Pigmente aus 2-Aminobenzophenon
Die Reaktion von Diethylsuccinylosuccinat mit 2-Aminobenzophenon liefert in einer säurekatalysierten Friedlaender-Kondensation ein blassgelbes Kondensationsprodukt, das mit Chloranil zu einer violetten Zwischenstufe oxidiert wird, die beim Erhitzen ein metallisch grünes unlösliches Pigment ergibt.[21]

Eine Reaktionsvariante[22] unterwirft das lösliche Kondensationsprodukt direkt einer oxidativen Cyclisierung bei hoher Temperatur (255 °C), wobei das Tetrabenzodiazaketoperylen-Pigment als schwarzer kristalliner Feststoff in 95 % Ausbeute anfällt. Pigmentpräparationen der Verbindung zeigen lichtstabile dunkelviolette bis schwarze Farbtöne.
Mit 1,2-Diiodbenzol reagiert 2-Aminobenzophenon in einer Ullmann-Reaktion in Gegenwart von Kaliumcarbonat und Kupfer zu einem gelben Dibenzophenanthrolin-Pigment.[23]

Einzelnachweise
- ↑ a b Datenblatt 2-Aminobenzophenon bei Sigma-Aldrich, abgerufen am 15. März 2019 (PDF).
- ↑ a b c Eintrag zu 2-Aminobenzophenone bei TCI Europe, abgerufen am 15. März 2019.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2016, ISBN 978-0-323-28659-6, S. 322.
- ↑ a b c Datenblatt 2-Aminobenzophenone bei Alfa Aesar, abgerufen am 15. März 2019 (Seite nicht mehr abrufbar).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–32.
- ↑ a b c C. Graebe, F. Ullmann: Darstellung von o-Aminobenzophenon und Synthese von Acridon. In: Ber. Dtsch. Chem. Ges. Band 27, Nr. 3, 1894, S. 3483–3484, doi:10.1002/cber.189402703170.
- ↑ C. Graebe, F. Ullmann: Ueber o-Aminobenzophenon. In: Liebigs Ann. Chem. Band 291, Nr. 1–2, 1896, S. 8–16, doi:10.1002/jlac.18962910103.
- ↑ Patent US4082749: Process for the production of amines. Angemeldet am 3. Juni 1974, veröffentlicht am 4. April 1978, Anmelder: BASF AG, Erfinder: H.-J. Quadbeck-Seeger.
- ↑ a b S. Gabriel, R. Stelzner: Zur Kenntnis der Chinazolinverbindungen. In: Ber. Dtsch. Chem. Ges. Band 29, Nr. 2, 1896, S. 1300–1316, doi:10.1002/cber.18960290226.
- ↑ H.J. Scheifele, Jr., D.F. DeTar: 2-Aminobenzophenone In: Organic Syntheses. 32, 1952, S. 8, doi:10.15227/orgsyn.032.0008; Coll. Vol. 4, 1963, S. 34 (PDF).
- ↑ Patent US6310249B1: Process for producing 2-aminobenzophenone compound. Angemeldet am 22. Juli 1999, veröffentlicht am 30. Oktober 2001, Anmelder: Nissan Chemical Industries, Ltd., Erfinder: H. Matsumoto, T. Horiuchi.
- ↑ D.A. Walsh: The Synthesis of 2-Aminobenzophenones. In: Synthesis. Band 9, 1980, S. 677–688, doi:10.1055/s-1980-29169.
- ↑ L.J. Kumar, S. Sarveswari, V. Vijayakumar: DMFDMA catalyzed synthesis of 2-((Dimethylamino)methylene)-3,4-dihydro-9arylacridin-1(2H)-ones and their derivatives: invitro antifungal, antibacterial and antioxidant evaluations. In: Open Chem. Band 16, 2018, S. 1077–1088, doi:10.1015/chem-2018-0110.
- ↑ J. Zhang, D. Zhu, C. Yu, C. Wan, Z. Wang: A simple and efficient approach to the synthesis of 2-phenylquinazolines via sp3 C–H functionalization. In: Org. Lett. Band 12, Nr. 12, 2010, S. 2841–2843, doi:10.1021/ol100954x.
- ↑ S.K. Panja, S. Saha: Recyclable, magnetic ionic liquid bmim[FeCl4]-catalyzed, multicomponent, solvent-free, green synthesis of quinazolines. In: RSC Adv. Band 3, 2013, S. 14495–14500, doi:10.1039/c3ra42039f.
- ↑ C. Derabli, R. Boulcina, G. Kirsch, B. Carboni, A. Debache: A DMAP-catalyzed mild and efficient synthesis of 1,2-dihydroquinazolines via a one-pot three-component protocol. In: Tetrahedron Lett. Band 55, Nr. 1, 2014, S. 200–204, doi:10.1016/j.tetlet.2013.10.157.
- ↑ B.M. Adger, S. Bradbury, M. Keating, C.W. Rees, R.C. Storr, M.T. Williams: 1,2,3-Benzotriazines. In: J. Chem. Soc., Perkin Trans. 1. Band 0, Nr. 1, 1975, S. 31–40, doi:10.1039/P19750000031.
- ↑ Patent DE2252378: Verfahren zur Herstellung von Benzodiazepin-Derivaten. Angemeldet am 25. Oktober 1972, veröffentlicht am 24. Mai 1973, Anmelder: F. Hoffmann-La Roche & Co., AG, Erfinder: H. Boemches, H. Meyer.
- ↑ Patent US2893992: 1,4-Benzodiazepine 4-oxides. Angemeldet am 15. Mai 1958, veröffentlicht am 7. Juli 1959, Anmelder: F. Hoffmann-La Roche Inc., Erfinder: Leo Sternbach.
- ↑ Patent CN103012408A: Synthesis method of epinastin. Angemeldet am 28. November 2012, veröffentlicht am 3. April 2013, Anmelder: Guangzhou Inst. Biomed & Health, Erfinder: Q. Cai, J. Liu.
- ↑ K. Kitahara, H. Nishi: New heterocyclic compounds derived from diethyl 2,5‐dioxo‐1,4‐cyclohexanedicarboxylate and 2‐aminobenzophenone. In: J. Heterocycl. Chem. Band 25, Nr. 4, 1988, S. 1063–1065, doi:10.1002/jhet.5570250403.
- ↑ Patent US5028643: Tetrabenzodiazaketoperylene pigment. Angemeldet am 27. Juni 1989, veröffentlicht am 2. Juli 1991, Anmelder: Ciba-Geigy Corp., Erfinder: E.E. Jaffe.
- ↑ D. Hellwinkel, P. Ittemann: Eine allgemeine Synthesemethode für Dibenzo[b,j][x,z]phenanthroline mit x,z = 1,7; 4,7 und 1,10. In: Liebigs Ann. Chem. Band 1985, Nr. 7, 1985, S. 1501–1507, doi:10.1002/jlac.198519850722.





