Cope-Eliminierung
Die Cope-Eliminierung ist eine Namensreaktion in der organischen Chemie; sie wurde nach dem US-amerikanischen Chemiker Arthur C. Cope (1909–1966) benannt, der mehrere Arbeiten über diese Reaktion verfasste. Zuerst beschrieben wurde sie von Leonhard Mamlock und Richard Wolffenstein.[1]
Übersichtsreaktion
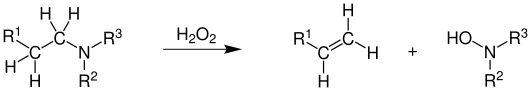
Bei der Cope-Eliminierung handelt es sich um die Abspaltung eines Alkylrests von einem tertiären Aminoxid unter Bildung des entsprechenden Olefins und sekundären Hydroxylamins.
Die Reaktion verläuft mit Peroxiden, wie hier mit dem starken Oxidationsmittel Wasserstoffperoxid. Bei den Resten R1 bis R3 handelt es sich um organische Reste, z. B. Alkylreste.
Reaktionsmechanismus
Die Reaktion verläuft nach folgendem Mechanismus. Die Reste R1, R2 und R3 sind auch hier organische Reste. Diese können unterschiedlich aber auch identisch sein.
Das tertiäre Amin 1 wird durch ein starkes Oxidationsmittel, hier Wasserstoffperoxid oder auch durch andere Peroxide, zu einem Aminoxid 2 oxidiert. Bedingung ist hier, dass an die Reste R in α-Stellung keine aziden Wasserstoffatome gebunden sind. Das Aminoxid 2 ist ein angenommener Übergangszustand, der durch thermische Entwicklung ab ca. 100 °C umgewandelt wird. Es entstehen als Produkte ein terminales Olefin 3 bzw. Alken sowie ein Aminhydroxid 4. Das Aminhydroxid trägt noch zwei der Reste des Ausgangsamins. Der dritte Rest befindet sich nun am Alken.[2][3][4]
Siehe auch
Einzelnachweise
- ↑ L. Mamlock, R. Wolffenstein: Zur Einwirkung von Wasserstoffsuperoxyd auf Fettamine. In: Berichte der deutschen chemischen Gesellschaft. Band 33, Nr. 1, 1900, S. 159–161, doi:10.1002/cber.19000330120.
- ↑ A. C. Cope, E. R. Trumbull: Olefins from Amines: The Hofmann Elimination Reaction and Amine Oxide Pyrolysis. In: Org. React. Band 11, 1960, S. 317–493.
- ↑ A. C. Cope, T. T. Foster, P. H. Towle: Thermal Decomposition of Amine Oxides to Olefins and Dialkylhydroxylamines. In: J. Am. Chem. Soc. Band 71, Nr. 12, 1949, S. 3929–3934, doi:10.1021/ja01180a014.
- ↑ B. P. Mundy, M. G. Ellerd, F. G. Favaloro, Jr.: Name Reactions and Reagents in organic Synthesis. 2. Auflage, John Wiley & Sons, Hoboken, New Jersey 2005, ISBN 978-0-471-22854-7, S. 96.