Blei(II)-acetat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(II)-acetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
farblose, süßlich schmeckende, monokline Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,25 g·cm−3 (wasserfrei)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung: ab 200 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
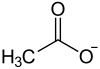
Blei(II)-acetat, ein farbloser kristalliner Feststoff, ist das Blei(II)-salz der Essigsäure mit der Konstitutionsformel Pb(CH3COO)2. Neben der wasserfreien Substanz ist auch das Trihydrat[5] Pb(CH3COO)2 · 3 H2O bekannt.
Darstellung
Blei(II)-acetat kann durch Reaktion von Blei(II)-oxid mit Essigsäure gewonnen werden
Verwendung

Blei(II)-acetat dient vor allem zur Gewinnung anderer Bleiverbindungen, beispielsweise Blei(II)-chromat (Chromgelb) und basisches Blei(II)-carbonat (Bleiweiß). Blei(II)-acetat dient auch als Nachweisreagenz für Sulfide.
Bekannt ist Blei(II)-acetat als Bleizucker, da es süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum 19. Jahrhundert als Zuckerersatz (Defrutum) verwendet – insbesondere wurde Wein damit gesüßt. Ludwig van Beethovens Tod durch verpanschte Weine wurde kontrovers diskutiert.[6][7][8]
Bleipapier, ein mit einer einprozentigen wässrigen Lösung von Bleiacetat getränktes und in schwefelwasserstofffreier Luft getrocknetes Filterpapier,[9] dient zur qualitativen Erkennung von Schwefelwasserstoff (H2S), es entsteht braungraues, metallisch glänzendes Bleisulfid.[1]
Bei der Isolierung von Naturstoffen kann Blei(II)-acetat genutzt werden, um störende Gerbstoffe und Flavonoide auszufällen. Der Niederschlag kann im Anschluss per Filtration abgetrennt werden. Überschüssige Pb2+-Ionen können durch Zugabe von SO42−-Ionen als Blei(II)-sulfat gefällt werden.[10]
Weblinks
Einzelnachweise
- ↑ a b Eintrag zu Bleiacetate. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d e f g h Eintrag zu Blei(II)-acetat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Eintrag zu Lead di(acetate) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Blei(II)-acetat-Trihydrat: CAS-Nummer: 6080-56-4, EG-Nummer: 612-031-2, ECHA-InfoCard: 100.115.474, PubChem: 16693916, ChemSpider: 21062, Wikidata: Q27115555.
- ↑ Brigitte M. Gensthaler: Beethoven und Blei - Tödliches Zusammenspiel. In: Pharmazeutische Zeitung, 30, 2001, abgerufen am 12. Mai 2018.
- ↑ Beethovens Tod: Blei war nicht die Ursache n-tv.de, 29. Mai 2010.
- ↑ Die Leiden des Ludwig van Beethoven. In: Deutschlandfunk. (deutschlandfunk.de [abgerufen am 18. Dezember 2016]).
- ↑ Walter Wittenberger: Chemische Laboratoriumstechnik, Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 94, ISBN 3-211-81116-8.
- ↑ Egon Stahl, Werner Schild: Isolierung und Charakterisierung von Naturstoffen. 1. Auflage. Gustav Fischer Verlag, Stuttgart/New York 1986, ISBN 3-437-30511-5, S. 59 f.


![{\displaystyle {\mathsf {\ \!\ {\Biggr ]}_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b6fdac125e69369863b23ad61f5faf1a2e1819e)






