Blei(II)-acetat
| Strukturformel | ||||||||
|---|---|---|---|---|---|---|---|---|
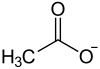
| ||||||||
| Allgemeines | ||||||||
| Name | Blei(II)-acetat | |||||||
| Andere Namen |
| |||||||
| Summenformel | C4H6O4Pb | |||||||
| Kurzbeschreibung |
farblose, süßlich schmeckende, monokline Kristalle[1] | |||||||
| Externe Identifikatoren/Datenbanken | ||||||||
| ||||||||
| Eigenschaften | ||||||||
| Molare Masse | 325,28 g·mol−1 (wasserfrei) | |||||||
| Aggregatzustand |
fest | |||||||
| Dichte | ||||||||
| Schmelzpunkt | ||||||||
| Siedepunkt |
Zersetzung: ab 200 °C[2] | |||||||
| Löslichkeit | ||||||||
| Sicherheitshinweise | ||||||||
| ||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||
Blei(II)-acetat (Pb(CH3COO)2), ein farbloser kristalliner Feststoff, ist das Blei(II)-salz der Essigsäure. Neben der wasserfreien Substanz kommt auch ein Trihydrat vor (Pb(CH3COO)2 · 3 H2O).
Darstellung
Blei(II)-acetat kann durch Reaktion von Blei(II)-oxid mit Essigsäure gewonnen werden
Verwendung

Blei(II)-acetat dient vor allem zur Gewinnung anderer Bleiverbindungen, beispielsweise Bleichromat (Chromgelb) und basisches Bleicarbonat (Bleiweiß). Blei(II)-acetat dient auch als Nachweisreagenz für Sulfide.
Bekannt ist Blei(II)-acetat als Bleizucker, da es süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum 19. Jahrhundert als Zuckerersatz (Defrutum) verwendet – insbesondere wurde Wein damit gesüßt.
Ludwig van Beethovens Tod durch verpanschte Weine wurde kontrovers diskutiert.[3][4]
Bleipapier, ein mit einer 1%-igen wässrigen Lösung von Bleiacetat getränktes und in Schwefelwasserstoff-freier Luft getrocknetes Filterpapier,[5] dient zur qualitativen Erkennung von Schwefelwasserstoff (H2S), es entsteht braungraues, metallisch glänzendes Bleisulfid.[6]
Einzelnachweise
- ↑ Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f Eintrag zu Blei(II)-acetat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Pharmazeutische Zeitung zu Beethovens wahrscheinlicher Bleivergiftung
- ↑ Beethovens Tod: Blei war nicht die Ursache n-tv.de, 29. Mai 2010
- ↑ Walter Wittenberger: Chemische Laboratoriumstechnik, Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 94, ISBN 3-211-81116-8.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006


![{\displaystyle {\mathsf {\ \!\ {\Biggr ]}_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b6fdac125e69369863b23ad61f5faf1a2e1819e)






