„Blei(II)-acetat“ – Versionsunterschied
| [ungesichtete Version] | [gesichtete Version] |
KKeine Bearbeitungszusammenfassung |
Eichg (Diskussion | Beiträge) →Verwendung: neueste Beethoven-Forschung ergänzt |
||
| (179 dazwischenliegende Versionen von mehr als 100 Benutzern, die nicht angezeigt werden) | |||
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie |
|||
{| width="40%" {{prettytable-R}} |
|||
| Strukturformel = [[Datei:Pb2+.svg|x35px|Bleiion]] <math>\mathrm{ \ \Biggl[}</math> [[Datei:Acetat-Ion.svg|100px|Acetation]] <math>\mathsf{ \ \!\ \Biggr]_2}</math> |
|||
|- |
|||
| Suchfunktion = C4H6O4Pb C4H12O7Pb |
|||
! colspan="2" style="background-color:#ffdead;" | Strukturformel |
|||
| Andere Namen = * Bleiacetat |
|||
|- style="background-color:#ffffff;" |
|||
* Bleizucker |
|||
| colspan="2" style="text-align:center;" | Pb<sup>2+ </sup> 2 [[Bild:Acetat.PNG]] * 3H<sub>2</sub>O |
|||
* Bleiessig |
|||
|- |
|||
* essigsaures Blei |
|||
! colspan="2" style="background-color:#ffdead;" | Allgemeines |
|||
* essigsaures Bleioxyd (veraltet) |
|||
|- |
|||
* ''Plumbum aceticum'' (lat.) |
|||
| Name || Blei(II)-acetat |
|||
| Summenformel = * C<sub>4</sub>H<sub>6</sub>O<sub>4</sub>Pb (wasserfrei) |
|||
|- |
|||
* C<sub>4</sub>H<sub>12</sub>O<sub>7</sub>Pb (Trihydrat) |
|||
| Andere Namen || Bleiacetat, Bleizucker, essigsaures Blei, Blei(II)-acetat-trihydrat |
|||
| CAS = * {{CASRN|301-04-2}} (wasserfrei) |
|||
|- |
|||
* {{CASRN|6080-56-4|Q27115555}} (Trihydrat) |
|||
| [[Summenformel]] || [[Kohlenstoff|C]]<sub>4</sub>[[Wasserstoff|H]]<sub>6</sub>[[Sauerstoff|O]]<sub>4</sub>[[Blei|Pb]] · 3H<sub>2</sub>O |
|||
| EG-Nummer = 206-104-4 <!-- (wasserfrei), 612-031-2 (Trihydrat) --> |
|||
|- |
|||
| ECHA-ID = 100.005.551 <!-- (wasserfrei), 100.115.474 (Trihydrat) --> |
|||
| [[CAS-Nummer]] || 6080-56-4 |
|||
| PubChem = 16685321 |
|||
|- |
|||
| ChemSpider = |
|||
| Kurzbeschreibung || farblose Kristalle |
|||
| Beschreibung = farblose, süßlich schmeckende, monokline Kristalle<ref name=roempp>{{RömppOnline|ID=RD-02-01901|Name=Bleiacetate|Abruf=2014-04-11}}</ref> |
|||
|- |
|||
| Molare Masse = * 325,28 [[Gramm|g]]·[[mol]]<sup>−1</sup> (wasserfrei) |
|||
! colspan="2" style="background-color:#ffdead;" | Eigenschaften |
|||
* 379,33 [[Gramm|g]]·[[mol]]<sup>−1</sup> (Trihydrat) |
|||
|- |
|||
| Aggregat = fest |
|||
| [[Molmasse]] || 379,34 g/[[mol]] |
|||
| Dichte = 3,25 g·cm<sup>−3</sup> (wasserfrei)<ref name="GESTIS">{{GESTIS|Name=Blei(II)-acetat|ZVG=510072|CAS=|Abruf=2016-02-01}}</ref> |
|||
|- |
|||
| Schmelzpunkt = * 280 [[Grad Celsius|°C]] (wasserfrei)<ref name="GESTIS" /> |
|||
| [[Aggregatzustand]] || fest |
|||
* 75 °C (Trihydrat)<ref name="GESTIS" /> |
|||
|- |
|||
| Siedepunkt = Zersetzung: ab 200 °C<ref name=roempp /> |
|||
| [[Dichte]] || 2,55 g/cm³ |
|||
| Dampfdruck = |
|||
|- |
|||
| Löslichkeit = leicht löslich in Wasser (456 g·[[Liter|l]]<sup>−1</sup> bei 20 °C)<ref name="GESTIS" /> |
|||
| [[Schmelzpunkt]] || 75 [[Grad Celsius|°C]] |
|||
| CLH = {{CLH-ECHA|ID=100.005.551|Name=Lead di(acetate)|Abruf=2016-02-01}} |
|||
|- |
|||
| Quelle GHS-Kz = <ref name="GESTIS" /> |
|||
| [[Siedepunkt]] || 200 °C (Zersetzung) |
|||
| GHS-Piktogramme = {{GHS-Piktogramme|08|09}} |
|||
|- |
|||
| GHS-Signalwort = Gefahr |
|||
| [[Dampfdruck]] || ? [[Pascal (Einheit)|Pa]] (x °C) |
|||
| H = {{H-Sätze|360Df|373|410}} |
|||
|- |
|||
| EUH = {{EUH-Sätze|-}} |
|||
| [[Löslichkeit]] || gut in Wasser |
|||
| P = {{P-Sätze|201|273|308+313|501}} |
|||
|- |
|||
| Quelle P = <ref name="GESTIS" /> |
|||
! colspan="2" style="background-color:#ffdead;" | Sicherheitshinweise |
|||
| REACH = {{REACH|ECHA-ID=100.005.551|Zulassungspflicht=|Artikel57=c|Abruf=2015-10-18}} |
|||
|- |
|||
| ToxDaten = {{ToxDaten |Typ=LD50 |Organismus=Ratte |Applikationsart=oral |Wert=4670 mg·kg<sup>−1</sup>|Quelle=<ref name="GESTIS" /> }} |
|||
| colspan="2" align="center" | {{Gefahrensymbol_2|T|N}} |
|||
}} |
|||
|- |
|||
| [[R- und S-Sätze]] || |
|||
R: 33-48/22-61-62<br /> |
|||
S: 45-53 |
|||
|- |
|||
| [[Maximale Arbeitsplatz-Konzentration|MAK]] || 0,1 mg/m³ |
|||
|- |
|||
! colspan="2" style="background-color:#ffdead;" |<small>Soweit möglich und gebräuchlich, werden [[SI-Einheitensystem|SI-Einheiten]] verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei [[Standardbedingungen]].</small> |
|||
|- |
|||
|} |
|||
'''Blei(II)-acetat''' |
'''Blei(II)-acetat''', ein farbloser kristalliner Feststoff, ist das [[Blei]]([[Oxidationszahl|II]])-[[Salze|salz]] der [[Essigsäure]] mit der [[Konstitutionsformel]] Pb(CH<sub>3</sub>COO)<sub>2</sub>. Neben der wasserfreien Form ist auch das Trihydrat<ref>{{Substanzinfo|Name=Blei(II)-acetat-Trihydrat |CAS=6080-56-4 |Wikidata=Q27115555 |ECHA-ID=100.115.474 |EG-Nummer=612-031-2 |ZVG= |PubChem=16693916 }}</ref> Pb(CH<sub>3</sub>COO)<sub>2</sub> · 3 H<sub>2</sub>O bekannt. |
||
== Darstellung == |
|||
Bekannt ist Blei(II)-acetat als '''Bleizucker''', welcher süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum [[19. Jahrhundert]] als [[Zucker]]-Ersatz verwendet - insbesondere wurde Wein damit gesüßt. Der Komponist [[Ludwig van Beethoven]] ist wahrscheinlich an einer durch solchermaßen verpanschte Weine verursachten Bleivergiftung gestorben. |
|||
Elementares Blei löst sich kaum in kalter, jedoch leicht in siedender [[Essigsäure]]. Einfacher kann Blei(II)-acetat durch Reaktion von [[Blei(II)-oxid]] mit Essigsäure gewonnen werden: |
|||
:<math>\mathrm{PbO \ + \ 2 \ CH_3COOH \rightarrow Pb(CH_3COO)_2 \ + \ H_2O}</math> |
|||
== Eigenschaften == |
|||
Die berühmten Wasserleitungen im [[Römisches Reich|römischen Reich]] bestanden innerhalb der Häuser im Wesentlichen aus Bleirohren. Da sich durch die Reaktion mit [[Kohlensäure]] im Wasser mit der Zeit eine passivierende Schutzschicht aus [[Bleicarbonat]] (PbCO<sub>3</sub>) über die Leitungen legte, war dies eigentlich unbedenklich. Allerdings ließen manche Römer an Festtagen die Wasserleitungen mit Wein füllen, worauf sich die Schutzschicht löste und schließlich Bleizucker in großen Mengen entstand. |
|||
Beim Erhitzen des kristallinen Trihydrates zersetzt sich dieses wieder in Essigsäure und Wasser (die abdampfen) sowie gelbes Blei(II)-oxid: |
|||
:<math>\mathrm{Pb(CH_3COO)_2 \ * \ 3 \ H_2O \ + \ Energie \rightarrow PbO \ + \ 2 \ CH_3COOH \ + \ 2 \ H_2O}</math> |
|||
== Verwendung == |
|||
[[Kategorie:Acetat]] |
|||
[[Datei:Lead(II)Acetate.jpg|mini|links|Bleizucker in kristalliner Form]] |
|||
[[Kategorie:Chemische Verbindung]] |
|||
Blei(II)-acetat dient vor allem zur Gewinnung anderer Bleiverbindungen, beispielsweise [[Blei(II)-chromat]] (Chromgelb) und basisches [[Blei(II)-carbonat]] (Bleiweiß). Blei(II)-acetat dient auch als Nachweisreagenz für [[Sulfide]]. |
|||
[[Kategorie:Gift]] |
|||
Bekannt ist Blei(II)-acetat als '''Bleizucker''', da es süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum 19. Jahrhundert als [[Zucker]]ersatz ([[Defrutum]]) verwendet – insbesondere wurde [[Wein]] damit gesüßt. [[Ludwig van Beethoven]]s Tod durch verpanschte Weine wurde kontrovers diskutiert.<ref name="beethoven1">Brigitte M. Gensthaler: [https://www.pharmazeutische-zeitung.de/index.php?id=magazin_30_2001 ''Beethoven und Blei - Tödliches Zusammenspiel'']. In: Pharmazeutische Zeitung, 30, 2001, abgerufen am 12. Mai 2018.</ref><ref>[https://www.n-tv.de/wissen/Blei-war-nicht-die-Ursache-article895849.html Beethovens Tod: Blei war nicht die Ursache] n-tv.de, 29. Mai 2010.</ref><ref>{{Literatur |Titel=Die Leiden des Ludwig van Beethoven |Sammelwerk=Deutschlandfunk |Datum= |Online=https://www.deutschlandfunk.de/die-leiden-des-ludwig-van-beethoven.676.de.html?dram:article_id=22997 |Abruf=2016-12-18}}</ref> Laut neuesten Untersuchungen, bei der drei seiner Haarlocken „aufgebraucht“ wurden, litt er tatsächlich an einer chronischen Bleivergiftung.<ref>{{Internetquelle |autor=Julia Sica |url=https://www.derstandard.at/story/3000000218358/starb-beethoven-an-bleivergiftung-analyse-liefert-neue-hinweisel |titel=Starb Beethoven an Bleivergiftung? |titelerg=Analyse liefert neue Hinweise |werk=[[Der Standard]] |hrsg= |datum=2024-05-07 |seiten=|format=|abruf=2024-05-08 |abruf-verborgen=1 |kommentar=}}</ref> |
|||
{{Gesundheitshinweis}} |
|||
Eine Bleizuckerfabrik, die Anfang des 19. Jahrhunderts auf dem Gelände des [[Schloss Sacrow|Sacrower]] Schlossparks betrieben wurde, konnte archäologisch untersucht werden.<ref>{{Literatur |Autor=Annett Dittrich/Kerstin Gessner |Titel=Bittersüßes Salz.pdf |Sammelwerk=Bittersüßes Salz – Ausgrabung der Bleizuckerfabrik im Schlosspark Sacrow, Stadt Potsdam. In: Archäologie in Berlin und Brandenburg (2013) |Datum=2015-01-01 |Online=https://www.academia.edu/38203258/Bitters%C3%BC%C3%9Fes_Salz_pdf |Abruf=2023-02-18}}</ref> |
|||
''Bleipapier'', ein mit einer einprozentigen wässrigen Lösung von Bleiacetat getränktes und in schwefelwasserstofffreier Luft getrocknetes Filterpapier,<ref name="Wittenberger">Walter Wittenberger: ''Chemische Laboratoriumstechnik'', Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 94, ISBN 3-211-81116-8.</ref> dient zur qualitativen Erkennung von [[Schwefelwasserstoff]] (H<sub>2</sub>S), es entsteht braungraues, metallisch glänzendes [[Blei(II)-sulfid|Bleisulfid]].<ref name=roempp /> |
|||
Bei der Isolierung von [[Naturstoff]]en kann Blei(II)-acetat genutzt werden, um störende [[Gerbstoffe]] und [[Flavonoide]] [[Fällung|auszufällen]]. Der Niederschlag kann im Anschluss per Filtration abgetrennt werden. Überschüssige Pb<sup>2+</sup>-Ionen können durch Zugabe von [[Sulfate|SO<sub>4</sub><sup>2−</sup>]]-Ionen als [[Blei(II)-sulfat]] gefällt werden.<ref>{{Literatur |Autor=Egon Stahl, Werner Schild |Titel=Isolierung und Charakterisierung von Naturstoffen |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=1 |Verlag=Gustav Fischer Verlag |Ort=Stuttgart/New York |Datum=1986 |ISBN=3-437-30511-5 |Seiten=59 f}}</ref> |
|||
[[cs:Olověný cukr]] |
|||
[[de:Blei(II)-acetat]] |
|||
== Weblinks == |
|||
[[en:Lead(II) acetate]] |
|||
{{wikisource|Bekanntmachung, betreffend die Einrichtung und den Betrieb der Bleifarben- und Bleizuckerfabriken|Bekanntmachung, betreffend die Einrichtung und den Betrieb der Bleifarben- und Bleizuckerfabriken, Deutschland (1886)}} |
|||
[[nl:Loodacetaat]] |
|||
[[pt:Acetato de chumbo]] |
|||
== Einzelnachweise == |
|||
[[ru:Свинцовый сахар]] |
|||
<references /> |
|||
[[Kategorie:Acetat]] |
|||
[[Kategorie:Bleiverbindung]] |
|||
[[Kategorie:Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 30]] |
|||
[[Kategorie:Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 63]] |
|||
[[Kategorie:Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72]] |
|||
Aktuelle Version vom 8. Mai 2024, 20:18 Uhr
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
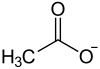
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(II)-acetat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung |
farblose, süßlich schmeckende, monokline Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,25 g·cm−3 (wasserfrei)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung: ab 200 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Blei(II)-acetat, ein farbloser kristalliner Feststoff, ist das Blei(II)-salz der Essigsäure mit der Konstitutionsformel Pb(CH3COO)2. Neben der wasserfreien Form ist auch das Trihydrat[5] Pb(CH3COO)2 · 3 H2O bekannt.
Darstellung
Elementares Blei löst sich kaum in kalter, jedoch leicht in siedender Essigsäure. Einfacher kann Blei(II)-acetat durch Reaktion von Blei(II)-oxid mit Essigsäure gewonnen werden:
Eigenschaften
Beim Erhitzen des kristallinen Trihydrates zersetzt sich dieses wieder in Essigsäure und Wasser (die abdampfen) sowie gelbes Blei(II)-oxid:
Verwendung

Blei(II)-acetat dient vor allem zur Gewinnung anderer Bleiverbindungen, beispielsweise Blei(II)-chromat (Chromgelb) und basisches Blei(II)-carbonat (Bleiweiß). Blei(II)-acetat dient auch als Nachweisreagenz für Sulfide.
Bekannt ist Blei(II)-acetat als Bleizucker, da es süß schmeckt und gut in Wasser löslich ist. Trotz seiner Giftigkeit wurde Bleizucker bis zum 19. Jahrhundert als Zuckerersatz (Defrutum) verwendet – insbesondere wurde Wein damit gesüßt. Ludwig van Beethovens Tod durch verpanschte Weine wurde kontrovers diskutiert.[6][7][8] Laut neuesten Untersuchungen, bei der drei seiner Haarlocken „aufgebraucht“ wurden, litt er tatsächlich an einer chronischen Bleivergiftung.[9]
Eine Bleizuckerfabrik, die Anfang des 19. Jahrhunderts auf dem Gelände des Sacrower Schlossparks betrieben wurde, konnte archäologisch untersucht werden.[10] Bleipapier, ein mit einer einprozentigen wässrigen Lösung von Bleiacetat getränktes und in schwefelwasserstofffreier Luft getrocknetes Filterpapier,[11] dient zur qualitativen Erkennung von Schwefelwasserstoff (H2S), es entsteht braungraues, metallisch glänzendes Bleisulfid.[1]
Bei der Isolierung von Naturstoffen kann Blei(II)-acetat genutzt werden, um störende Gerbstoffe und Flavonoide auszufällen. Der Niederschlag kann im Anschluss per Filtration abgetrennt werden. Überschüssige Pb2+-Ionen können durch Zugabe von SO42−-Ionen als Blei(II)-sulfat gefällt werden.[12]
Weblinks
Einzelnachweise
- ↑ a b c Eintrag zu Bleiacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. April 2014.
- ↑ a b c d e f g Eintrag zu Blei(II)-acetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu Lead di(acetate) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 18. Oktober 2015.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Blei(II)-acetat-Trihydrat: CAS-Nummer: 6080-56-4, EG-Nummer: 612-031-2, ECHA-InfoCard: 100.115.474, PubChem: 16693916, ChemSpider: 21062, Wikidata: Q27115555.
- ↑ Brigitte M. Gensthaler: Beethoven und Blei - Tödliches Zusammenspiel. In: Pharmazeutische Zeitung, 30, 2001, abgerufen am 12. Mai 2018.
- ↑ Beethovens Tod: Blei war nicht die Ursache n-tv.de, 29. Mai 2010.
- ↑ Die Leiden des Ludwig van Beethoven. In: Deutschlandfunk. (deutschlandfunk.de [abgerufen am 18. Dezember 2016]).
- ↑ Julia Sica: Starb Beethoven an Bleivergiftung? Analyse liefert neue Hinweise. In: Der Standard. 7. Mai 2024.
- ↑ Annett Dittrich/Kerstin Gessner: Bittersüßes Salz.pdf. In: Bittersüßes Salz – Ausgrabung der Bleizuckerfabrik im Schlosspark Sacrow, Stadt Potsdam. In: Archäologie in Berlin und Brandenburg (2013). 1. Januar 2015 (academia.edu [PDF; abgerufen am 18. Februar 2023]).
- ↑ Walter Wittenberger: Chemische Laboratoriumstechnik, Springer-Verlag, Wien, New York, 7. Auflage, 1973, S. 94, ISBN 3-211-81116-8.
- ↑ Egon Stahl, Werner Schild: Isolierung und Charakterisierung von Naturstoffen. 1. Auflage. Gustav Fischer Verlag, Stuttgart/New York 1986, ISBN 3-437-30511-5, S. 59 f.


![{\displaystyle {\mathsf {\ \!\ {\Biggr ]}_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b6fdac125e69369863b23ad61f5faf1a2e1819e)







